
Andreyanov ON
.pdf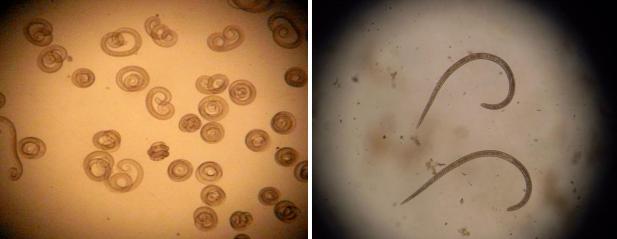
Рисунок 33. Жизнеспособные |
Рисунок 34. Нежизнеспособные |
|
личинки трихинелл. Увеличение х80 |
||
личинки. Увеличение х80 (оригинал) |
||
(оригинал) |
||
|
Выдельщики шкур, скорняки, охотники иногда используют технологию выделки свежеснятых шкур зверей без первичной обработки пушного сырья.
Было определено, что личинки трихинелл в этом случае сохранили жизнеспособность на этапе отмоки шкуры (состав среды погружения шкурки – водопроводная вода при температуре 20±2°C) и частично на этапе пикелевания в течение 2 суток (среда – 1%-ный раствор NaCl, 0,5%-ный раствор соляной кислоты HCl в воде, при температуре 20±2°C).
Таблица 27 - Устойчивость личинок трихинелл в мездре шкур промысловых животных при отрицательных температурах
|
Устойчивость личинок трихинелл, мес. |
|
|
||||||
Температура |
|
|
|
|
|
|
|
|
|
исследования, °C |
Контроль (свеже |
0 |
|
1 |
3 |
6 |
|
12 |
14 |
|
выделенный материал) |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
минус 12±2 |
Жизнеспособность |
+ |
|
+ |
+ |
+ |
|
+ |
+ |
личинок |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Жизнеспособность |
+ |
|
+ |
+ |
+ |
|
+ |
+ |
|
личинок |
|
|
||||||
минус 24±2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Инвазионность личинок |
|
|
+ |
|
+ |
+ |
||
|
|
|
|
|
|
|
|
|
|
|
161 |
|
|
|
|
|
|
|
|
Таблица 28 - Устойчивость личинок трихинелл при смене фаз замораживания и оттаивания
|
Кратность исследований, раз |
|
|
|
|||||
Показатель |
|
|
|
|
|
|
|
|
|
устойчивости |
Контроль (свеже |
|
|
|
|
|
|
|
|
личинок |
выделенный |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
материал) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Жизнеспособность |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
|
|
|
|
|
|
|
|
|
Во время промысловых охот на пушного зверя для охотников основным трофеем является его шкура. Она состоит из эпидермиса, дермы, жирового,
мускульного слоев и подкожной клетчатки. Жировой, мускульный слой и подкожная клетчатка в совокупности называется мездрой или бахтармой. В
процессе первичной обработки шкур (мездрения) эти слои удаляются. В
сельских поселениях мездра шкур пушных зверей может служить источником и фактором передачи трихинеллеза домашним животным.
Для достижения качества выделки шкур, требуемого ГОСТами на пушное сырье, первичная обработка шкур пушных зверей должна проводиться в типовых помещениях. Она включает в себя съёмку, обезжиривание, правку,
сушку (при температуре 25 – 30°C, влажности до 65%, с обильной циркуляцией воздуха), пролежку, откатку по мездре, выворачивание, откатку по волосу,
очистку меха (В.А. Берестов, 2002; Наставления по технологии первичной обработки шкурок клеточных пушных зверей, 1982). В настоящее время выделкой шкурок промысловых зверей занимаются частные предприниматели,
не соблюдая требования технологии выделки, из которой иногда выпадают этапы обезжиривания, выворачивания, откатки и очистки. Неотмездреные или плохо отмездреные шкуры животных складируются и хранятся в бытовках,
сараях, сеновалах в зимний сезон. Такое пушное сырье и технологические отходы после первичной обработки (мездра, подкожные мышцы) могут служить источником и фактором передачи трихинеллеза в синантропном биоценозе.
162
При положительной температуре личинки трихинелл в мездре шкуры обыкновенной лисицы сохраняют жизнеспособность и инвазионность несколько дней: при температуре 20±2°C в течение 2 суток, при температуре
4±2°C до 4 дней. При отрицательных температурах (минус 12±2°C и минус
24±2°C) жизнеспособность трихинелл сохраняется до 14 месяцев.
В заключение можно отметить, что представленная информация,
основанная на экспериментальных исследованиях, свидетельствует о высокой устойчивости инкапсулированных личинок трихинелл к температурным факторам. Данные особенности трихинелл необходимо учитывать при разработке профилактических мероприятий.
4.4. Биологические особенности природных видов трихинелл, выделенных от животных, циркулирующих на территории Центрального региона России
4.4.1. Изучение биологических свойств трихинелл на лабораторных грызунах
В задачу нашей работы входило сравнение некоторых свойств возбудителей трихинеллеза видов T. nativа и T. spiralis, циркулирующих в настоящее время на территории Центрального региона России. Зная особенности «локальных» видов возбудителей гельминтозооноза, можно планированировать ветеринарно-санитарные мероприятия, направленные на профилактику трихинеллеза.
Для изучения биологических свойств трихинелл проведено пассирование их изолятов на лабораторных животных (16 белых беспородных крысах и 21
мыши) по методике Ф.К. Скворцовой (2006). Методом молекулярно-
генетической диагностики (ПЦР) были идентифицированы два капсулообразующих вида трихинелл - T. spiralis и T. nativа, выделенных из мышечной ткани куницы и лисицы (А.В. Тулов и др., 2013). Отработка биологических свойств гельминтов была проведена на белых беспородных
163
мышах (19 головах), имбредных мышах линии DBA и C57BL6 (по 20 голов каждая), песчанках (18 головах) и белых крысах линии Wistar (18 головах).
Приживаемость гельминтов изучили после заражения 100±2 личинками per os
лабораторных грызунов на 7-й день опыта (О.Н. Андреянов, 2014). Подсчет половозрелых нематод провели компрессорно с помощью стереоскопического микроскопа Motic при увеличении х10 – 40 или после выделения гельминтов из вскрытого кишечника в аппарате Бермана (Г.А. Котельников, 1991). Величину приживаемости выразили в процентах. Интенсивность заражения устанавливали на 60-й день по числу выделенных мышечных личинок трихинелл. Подсчет выделенных личинок провели в камере Л.Д. Мигачевой,
Г.А. Котельникова (1987). Изучение устойчивости личинок трихинелл к глубокому замораживанию провели при температуре минус 70±2ºС на 45
тушках белых беспородных крыс, массой 450±30 грамм, в камере биомедицинского морозильника. Возраст мышечных трихинелл у белых крыс составил 60 – 65 суток. Для подсчета выживаемости трихинелл пастеровской пипеткой отобрали пробу личинок, выпавших в осадок, после переваривания тушки животного. Данный показатель определили как отношение жизнеспособных личинок трихинелл к общему числу выделенный личинок гельминтов, выраженных в процентах.
Результаты исследований представлены в таблицах 29 и 30.
Приживаемость личинок трихинелл на лабораторных грызунах оказалась различной. Так, вид трихинелл T. nativa обладал приживаемостью 9,7% (средний показатель). Наибольшая приживаемость гельминтов отмечена у монгольской песчанки - 17,2%, наименьшая у белых беспородных мышей - 1,2%. Одна из обследованных белых мышей не заразилась. От 6,7% до 12,4%
прижившихся нематод зарегистрировали у линейных мышей и белых крыс.
Природный изолят возбудителя T. spiralis показал немного бóльшую приживаемость гельминтов - 16,2%. Высокий показатель прижившихся нематод отмечен у песчанок - 20,7%, белых мышей - 19,7% и крыс - 18,0%,
164
Таблица 29 - Сравнительный анализ биологических свойств возбудителей трихинеллеза
|
|
Доза |
|
|
Биологические свойства трихинелл |
|
|||
Вид |
Вес, |
Приживаемость, % |
Интенсивность заражения (плодовитость) |
||||||
заражения, |
|||||||||
животного |
г |
|
|
T. spiralis |
|
|
T. spiralis |
||
личинок |
T. nativa |
T. spiralis |
T. nativa |
T. spiralis |
|||||
|
|
(лаб. изолят) |
(лаб. изолят) |
||||||
|
|
|
|
|
|
|
|||
Мыши |
|
|
|
|
|
|
|
|
|
белые |
25 |
|
1,2±1,7 |
19,7±7,4 |
28,3±5,7 |
9300±2100 |
18500±4100 |
27800±4500 |
|
беспородные |
|
|
|
|
|
|
|
|
|
Линейные |
|
|
|
|
|
|
|
|
|
инбредные |
|
|
6,7±1,5 |
14,0±2,9 |
32,6±4,9 |
12400±1500 |
24700±2200 |
36100±5300 |
|
мыши DBA |
|
|
|||||||
|
|
|
|
|
|
|
|
||
(серые) |
20 |
|
|
|
|
|
|
|
|
Инбредные |
100±2 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|||
мыши |
|
|
11,3±2,5 |
8, 7±4,0 |
30,7±6,3 |
19500±3400 |
18780±3800 |
38400±6200 |
|
C57BL6 |
|
|
|||||||
|
|
|
|
|
|
|
|
||
(черные) |
|
|
|
|
|
|
|
|
|
Песчанка |
80 |
|
17,2±4,0 |
20,7±2,1 |
25,6±4,1 |
158300±29700 |
62000±11700 |
104000±13200 |
|
монгольская |
|
||||||||
|
|
|
|
|
|
|
|
||
Крыса белая |
100 |
|
12,4±4,2 |
18,0±3,6 |
40,1±12,3 |
17000±5200 |
100800±34400 |
189000±11200 |
|
Vistar |
|
||||||||
|
|
|
|
|
|
|
|
||
Среднее значение |
9,7±6,2 |
16,2±4,9 |
31,5±5,5 |
43300±64400 |
44956±36700 |
79060±68620 |
|||
165
низкий у инбредных мышей линий DBA и C57BL6 по 14,0% и 8,7%
соответственно. Лабораторный изолят трихинелл, выделенный в 1972 г. из мышечной ткани свиньи на Минском мясокомбинате (Белоруссия) и
привезенный А.С. Бессоновым в институт, показал высокую приживаемость –
31,5%, что в 2 и более раза выше по сравнению с дикими изолятами - 31,5%.
Высокий процент приживаемости отмечен у белых крыс - 40,1%, наименьший у песчанок - 25,6%. Средний показатель приживаемости лабораторного изолята трихинелл отмечен у беспородных и линейных мышей (28,3 - 32,6%).
Таблица 30 - Выживаемость мышечных личинок трихинелл при глубоком замораживании (минус 70±2ºС) тушек лабораторных белых крыс
Вид трихинелл |
|
Время экспозиции, часы |
|
|
|||
|
|
|
|
|
|
|
|
0 |
1 |
2 |
3 |
|
4 |
5 |
|
|
|
||||||
|
|
|
|
|
|
|
|
T. nativa |
97,5 |
95,8 |
97,2 |
32,9 |
|
0,29 |
0 |
|
|
|
|
|
|
|
|
T. spiralis |
98,3 |
70,3 |
28,4 |
0 |
|
0 |
0 |
|
|
|
|
|
|
|
|
T. spiralis лаб. изолят |
96,9 |
38,6 |
0 |
0 |
|
0 |
0 |
|
|
|
|
|
|
|
|
Интенсивность заражения лабораторных грызунов природными изолятами,
была почти в 2 раза меньше по сравнению с лабораторным изолятом. Наиболее высокий показатель плодовитости трихинелл T. nativa отмечен только у песчанок – 158 300 личинок на голову, наименьший у белых мышей – 9 300
личинок на голову. Средний показатель по интенсивности заражения личинками трихинелл отмечен у инбредных мышей и крыс (12 400 – 19 500
выделенных мышечных личинок трихинелл из тушки животного). Высокая интенсивность T. spiralis отмечена у белых крыс – 100 800 и песчанок – 62 000
личинок на голову. У мышей плодовитость трихинелл была приблизительно на одном уровне (18 500 – 24 700 личинок на голову). Лабораторный изолят T. spiralis интенсивно заражал белых крыс и песчанок – 189 000 экз. и 104 000
экз., на животноесоответственно. Значительно меньшая плодовитость нематод отмечена у беспородных и линейных мышей (27 800 – 38 400 личинок на голову).
166
Резистенстность к отрицательным температурам у разных видов трихинелл также не совпала. Наиболее устойчивым к глубокому замораживанию оказался вид трихинелл T. nativa. Жизнеспособность мышечных личинок была на уровне
95,8 – 97,5% в течение первых двух часов экспозиции. На 3-м часу выдержки в морозильной камере жизнеспособность личинок трихинелл снизилась до 32,9%,
на 4-м часу она составила 0,29%. Через 5 часов жизнеспособных личинок T. nativa в мышечной ткани экспонированных крыс не обнаружено.
Возбудитель T. spiralis, циркулирующий в природном биоценозе, был также устойчив к отрицательной температуре в течение первых двух часов (1-й
час – 70,3%, 2-й час – 28,4%), на 3-м часу экспозиции мышечные инкапсулированные личинки трихинелл погибли. Личинки T. spiralis
лабораторного изолята были устойчивы к глубокому замораживанию только в течение первого часа выдержки (38,6%). Через 2 часа замораживания мышечные личинки трихинелл погибли.
Биологические особенности гельминтов рода Trichinella, пассированных на лабораторных животных, изучены достаточно хорошо и описаны в работах отечественных и зарубежных исследователей (Э.Р. Геллер, Е.В. Тимонов, 1976;
Н.А. Куликова, 1992; Ф.К. Скворцова, 2003). Полученные нами данные по биологическим особенностям трихинелл согласуются с результатами Э.Р.
Геллера, Е.В. Тимоновой (1976), Н.А. Куликовой (1992). Плохо приживаемыми,
менее плодовитыми, но устойчивыми к глубокому замораживанию оказались естественно циркулирующие виды возбудителя трихинеллеза T. nativa и T. spiralis. Лабораторный изолят трихинелл T. spiralis успешно адаптировался к лабораторному хозяину – белой беспородной крысе и мыше, поэтому потерял свойственные для природных видов трихинелл особенности. Н.А. Куликова
(1992) сообщает, что при повторном и третичном пассировании природных изолятов гельминта изменяются биологические свойства трихинелл. Такие показатели как приживаемость и плодовитость увеличиваются. Биологические особенности трихинелл у линейных мышей с высоким и низким уровнем иммунитета не сильно отличались от показателей беспородных животных.
167
Менее прижившимся в тонком отделе кишечника и плодовитым оказался вид T. nativa. Интересно отметить, что этот вид обладает высокой устойчивостью к замораживанию, поэтому он циркулирует среди пушных и морских животных, обитающих в северных широтах. Высокий уровень интенсивности заражения личинками трихинелл T. nativa отмечен у монгольской песчанки. Неизвестно, какие эпизоотии может вызвать этот вид возбудителя в южных регионах, если личинки попадут к подобному хозяину в природном биоценозе.
4.4.2. Особенности локализации личинок трихинелл в мышечной ткани естественно инвазированных животных
Целью работы было изучение естественного распределения капсулообразующих личинок трихинелл в отдельных группах мышечной ткани тушек и мездры шкур промысловых пушных зверей.
Нами исследовались животные семейств Canidae и Mustellidae (2 рыжие лисицы, 1 енотовидная собака, куницы каменная и лесная), добытые в Касимовском и Шиловском районах Рязанской области. Анализу подвергли 6 групп мышц тушек животных, а именно: головы, шеи, плечевого пояса, туловища (включая диафрагму и ее ножки), таза и задней конечности, хвоста. Далее изучили мышечный слой мездры шкур пушных зверей. С учетом топографии по отношению к различным частям тела подкожные поперечнополосатые мышцы кожи были объединены в 3 группы: мышцы головы, подкожные мышцы шеи, подкожные мышцы туловища.
Из каждой препарированной мышцы взяли навеску и подвергли искусственному ферментированию. Полученные данные статистичеки обработали путем определения среднего количества личинок в 1 грамме каждой мышцы. Доверительные интервалы ИИ мышц личинками трихинелл для 95% исследованного материала соответствовали уровню p<0,05.
В результате исследований поперечнополосатой мускулатуры тушек зверей, естественно инвазированных трихинеллами, установлено, что личинки гельминта неравномерно распределены по группам мышц (табл. 31 и 32).
168
Таблица 31 - Распределение личинок трихинелл в мышечной ткани тушки естественно инвазированных животных
|
Название мышцы – латинское название |
Количество личинок трихинелл в 1 г мышц |
||||
№ |
|
Енотовидная |
Куница |
Куница |
||
мускула |
Лисица |
|||||
|
собака |
лесная |
каменная |
|||
|
|
|
||||
|
Мышцы головы |
|
|
|
||
1 |
Собственно язычный – musculus lingvalis |
12,2±3,30 |
28 |
11 |
51 |
|
proprius |
||||||
|
|
|
|
|
||
2 |
Щечный – m. malaris |
5,7±2,84 |
34 |
6 |
36 |
|
3 |
Височный – m. temporalis |
9,1±0,41 |
41 |
9 |
43 |
|
4 |
Большой жевательный – m. masseter |
18,9±2,13 |
56 |
13 |
68 |
|
5 |
Крыловидный – m. pterigoidaeus |
18,4±0,84 |
48 |
7 |
54 |
|
6 |
Двубрюшный – m. digastricus |
9,1±3,33 |
31 |
5 |
51 |
|
|
Мышцы шеи |
|
|
|
||
7 |
Плечеголовый – m. brachiocephalicus |
13,1±4,17 |
23 |
7 |
55 |
|
8 |
Пластыревидный – m. splenius, |
8,5±0,68 |
19 |
4 |
58 |
|
9 |
Грудинощитовидный – m. sternothyroideus |
12,0±1,30 |
28 |
4 |
47 |
|
10 |
Длинниейшый головы и атланта – m. |
15,0±0,43 |
17 |
9 |
54 |
|
longissimus capitis et atlantis |
||||||
|
|
|
|
|
||
|
Мышцы плечевого пояса и передней конечности |
|
|
|||
11 |
Предостный – m. supraspinatus |
18,9±5,42 |
34 |
7 |
53 |
|
12 |
Трапециевидный – m. trapezius |
21,7±2,30 |
25 |
14 |
65 |
|
13 |
Заостный - m. infraspinatus |
26,9±9,18 |
30 |
8 |
60 |
|
14 |
Двуглавый – m. biceps brachii |
27,5±7,41 |
49 |
21 |
75 |
|
15 |
Трехглавый – m. triceps brachii |
24,1±2,30 |
54 |
19 |
47 |
|
16 |
Лучевой разгибатель запястья – m.extensor |
19,4±3,31 |
35 |
18 |
58 |
|
carpi radialis |
||||||
|
|
|
|
|
||
|
Мышцы туловища |
|
|
|
||
17 |
Косой брюшной наружний - m. obliquus |
11,6±0,53 |
31 |
1 |
4 |
|
externus abdominis |
||||||
|
|
|
|
|
||
18 |
Длиннейшый поясницы и груди - m. |
12,7±5,84 |
20 |
8 |
7 |
|
longissimus lumborum thoracis |
||||||
|
|
|
|
|
||
19 |
Межреберный - m.intercostalеs externuset |
16,2±1,39 |
19 |
9 |
21 |
|
internus |
||||||
|
|
|
|
|
||
20 |
Широчайшый спины - m. latissimus dorsi |
9,1±1,41 |
17 |
2 |
9 |
|
21 |
Вентральный зубчатый - m. serratus |
12,7±2,48 |
23 |
3 |
12 |
|
ventralis |
||||||
|
|
|
|
|
||
22 |
Диафрагма - m. diaphragmats |
15,7±1,73 |
34 |
8 |
51 |
|
|
Мышцы таза и задней конечности |
|
|
|||
23 |
Приводящий – m. adductor magnus |
24,9±0,19 |
37 |
7 |
48 |
|
24 |
Икроножный - m. gastrocnemius |
19,6±1,63 |
31 |
13 |
63 |
|
25 |
Средний ягодичный - m. gluteus medius |
20,1±3,53 |
35 |
16 |
40 |
|
26 |
Двухглавый бедра – m. biceps femoris |
27,0±8,47 |
51 |
24 |
58 |
|
27 |
Четырехглавый бедра – m. quadriceps |
29,7±6,56 |
43 |
23 |
41 |
|
femoris |
||||||
|
|
|
|
|
||
|
Мышцы хвоста |
|
|
|
||
28 |
Мышцы корня хвоста – m. caudatus |
2,8±0,17 |
4 |
0 |
11 |
|
Примечание: для лисицы даны средние показатели (исследовано 2 особи)
169
У семейства псовых максимальное количество личинок трихинелл зарегистрировано в мышцах плечевого пояса и передних конечностей (лисица - 23,1 лич./г, енотовидная собака – 37,8 лич./г) и мышцах таза и тазовых конечностей (лисица – 24,3 лич./г, енотовидная собака – 39,4 лич./г). К тому же у енотовидной собаки интенсивная инвазия личинками отмечена в мышцы головы (39,7 лич./г).
Среди животных семейства куньих большое количество личинок было выделено из мышц плечевого пояса, передних конечностей, таза и тазовых конечностей (лесная куница – 14,5 и 16,6 лич./г, каменная куница – 59,7 и 50,0
лич./г). Также у каменной куницы обилие личинок гельминта отмечено в мышцах шеи и головы (53,4 и 50,5 лич./г).
У лисиц максимальная концентрация личинок трихинелл обнаружена в заостном мускуле - 26,9 экз./г, двуглавом мускуле плеча - 27,5 экз./г и бедра - 27,0 экз./г, четырехглавом мускуле бедра - 29,7 экз./г. Наибольшее количество личинок выделено у енотовидной собаки из большой жевательной мышцы
(массетера) - 56 лич./г, трехглавой мышцы плеча - 54 лич./г, двуглавой мышцы бедра - 51 лич./г. В мышечной ткани лесной куницы высокая концентрация личинок была отмечена в двуглавой мышце бедра и плеча - 24 и 21 лич. /г и четырехглавой мышце бедра - 23 лич. /г. У каменной куницы максимальное количество личинок обнаружено в двуглавом мускуле плеча - 75 лич. /г и большом жевательном мускуле - 68 лич. /г.
После термостатического пептолиза мясного фарша в ИЖС наименьшее число личинок трихинелл выделилось из мышц головы и шеи у лисиц (по 12,2
лич. /г в каждой группе), мышц шеи и туловища у енотовидной собаки (по 21,8
и 24,0 лич. /г), мышц шеи и туловища у лесной куницы ( по 6,0 и 5,2 лич. /г) и
мышц туловища у каменной куницы (17,3 лич. /г). У всех тушек исследуемых животных абсолютное минимальное количество личинок гельминта выпало в осадок после искусственного пептолиза из мышечной ткани хвоста (от 0 до 11
лич. /г).
170
