
- •Амины: классификация, номенклатура; химическая идентификация, спектральные характеристики. Представители: анилин, n–метиланилин, n,n–диметиланилин, толуидины, фенетидины, дифениламин.
- •Амины: реакции первичных, вторичных и третичных алифатических и ароматических аминов с азотистой кислотой; карбиламинная реакция (изонитрильная проба).
- •Ароматические амины: влияние аминогруппы на реакционную способность ароматического ядра; реакции галогенирования, сульфирования, нитрования. Защита аминогруппы.
- •Диазосоединения: номенклатура; реакция диазотирования (вопр. 29), механизм и условия проведения; строение солей диазония; влияние рН среды на устойчивость солей диазония.
- •Диазосоединения: реакции солей диазония с выделением азота, синтетические возможности реакций.
- •Диазосоединения: реакции без выделения азота; реакция азосочетания, ее механизм, диазо– и азосоставляющие; использование реакции азосочетания для идентификации фенолов и ароматических аминов.
- •Азосоединения: азокрасители (метиловый оранжевый), индикаторные свойства; основы теории цветности.
- •Альдегиды и кетоны: факторы, определяющие реакционную способность; реакции присоединения воды и спиртов, механизм, роль кислотного катализа в образовании ацеталей и полуацеталей.
- •Альдегиды и кетоны: механизм аn; присоединение гидросульфита натрия, циановодорода, магнийорганических соединений, значение этих реакций.
- •Альдегиды и кетоны: реакции присоединения-отщепления – образование иминов, оксимов, гидразонов, семикарбазонов, использование этих реакций для идентификации оксосоединений.
- •Альдегиды и кетоны: реакции восстановления – гидридами и комплексными гидридами, восстановление по Кижнеру–Вольфу и Клемменсену; реакции окисления альдегидов катионами серебра (I) и меди (II).
- •Карбоновые кислоты: кислотные свойства, строение карбоксилат-аниона; сравнительная характеристика кислотных свойств алифатических и ароматических моно- и дикарбоновых кислот; образование солей.
- •Карбоновые кислоты: реакции нуклеофильного замещения, механизм; образование функциональных производных.
- •Сложные эфиры: номенклатура, кислотный и щелочной гидролиз, аммонолиз; идентификация.
- •Дикарбоновые кислоты: специфические свойства. Представители: щавелевая, малоновая, янтарная, глутаровая, фталевая кислоты.
- •Фталевая кислота, фталевый ангидрид, фталимид; синтез фенолфталеина, его индикаторные свойства.
- •Аминокислоты: номенклатура, химические свойства как гетерофункциональных соединений; специфические реакции –, β–, –аминокислот; лактамы, дикетопиперазины, отношение к гидролизу.
- •Пептиды и белки: первичная структура, строение (электронное, пространственное) пептидной группы, частичный и полный гидролиз.
- •Кето-енольная таутомерия β – дикарбонильных соединений (ацетилацетон, ацетоуксусный эфир, щавелевоуксусная кислота). Реакции кетонной и енольной форм ацетоуксусного эфира.
- •Ацетоуксусный эфир: строение, таутомерия; синтез карбоновых кислот и кетонов.
- •Сульфаниловая кислота: строение, биполярная структура; реакция диазотирования (вопр. 29); сульфаниламид (стрептоцид), общий принцип строения сульфаниламидных лекарственных препаратов.
-
Альдегиды и кетоны: механизм аn; присоединение гидросульфита натрия, циановодорода, магнийорганических соединений, значение этих реакций.
Нуклеофильное присоединение.
Реакции с серосодержащими нуклеофилами.
Реакция с гидросульфитом натрия. Альдегиды и кетоны при взаимодействии с гидросульфитом натрия образуют гидросульфитные производные (α-гидроксисульфонаты натрия):

В эту реакцию вступают большинство альдегидов, метилкетоны и циклические кетоны. Реакцию проводят с насыщенным раствором гидросульфита натрия, при этом выпадает в осадок кристаллическое гидросульфитное производное альдегида или кетона. Гидросульфитные производные гидролизуются в исходные соединения в кислой или щелочной среде, их образование используют в целях выделения из смеси и очистки карбонильных соединений.
Реакции с углеродсодержащими нуклеофилами.
В результате взаимодействия альдегидов и кетонов с углеродсодержащими нуклеофилами наращивается углеродный скелет карбонильного соединения, благодаря чему эти реакции имеют широкое применение в синтетической органической химии. Такими нуклеофилами служат циановодородная кислота, реактивы Гриньяра, различные соединения с выраженными СН-кислотными свойствами.
Присоединение циановодородной кислоты. Реакция приводит к образованию гидроксинитрилов и позволяет удлинить углеродную цепь на один атом углерода:
![]()
Реакция катализируется основаниями, потому что в слабой циановодородной кислоте концентрация активных нуклеофильных частиц — цианид-ионов — очень низка. Медленной стадией является присоединение цианид-иона.

Гидроксинитрилы гидролизуются в кислой среде в α-гидроксикарбоновые кислоты:

Присоединение магнийорганических соединений. Взаимодействие альдегидов и кетонов с магнийорганическими соединениями RMgHal (реактивами Гриньяра) является одним из универсальных способов синтеза спиртов: из фомальдегида получают первичные спирты, из других альдегидов — вторичные, а из кетонов — третичные:

На первой стадии реакции, которая проводится обычно в среде безводного диэтилового эфира, происходит нуклеофильное присоединение магнийорганического соединения к альдегиду или кетону. На следующем этапе образовавшийся магниевый алкоголят гидролизуется разбавленной минеральной кислотой или, если образующийся спирт чувствителен к действию кислоты, раствором хлорида аммония.
Аналогично магнийорганическим соединениям происходит присоединение литийорганических соединений. Литийорганические соединения более реакционноспособны, чем реактивы Гриньяра, поэтому их применяют в реакциях с малоактивными карбонильными соединениями.
-
Альдегиды и кетоны: реакции присоединения-отщепления – образование иминов, оксимов, гидразонов, семикарбазонов, использование этих реакций для идентификации оксосоединений.
Нуклеофильное присоединение.
Реакции с азотсодержащими нуклеофилами.
Альдегиды и кетоны взаимодействуют с различными соединениями, содержащими аминогруппу, при этом нуклеофильное присоединение чаще всего сопровождается отщеплением воды:
![]()
Реакция катализируется как кислотами, так и основаниями, соответственно и гидролиз полученных производных может осуществляться в кислой и щелочной средах. Присоединение нуклеофила к карбонильному соединению протекает через биполярный ион (I) и приводит к образованию неустойчивого гем-аминоспирта (II), который затем подвергается дегидратации в конечный продукт. Такой ход реакций альдегидов и кетонов с соединениями, содержащими аминогруппу, обусловливает их общее название как реакций присоединения-отщепления:

Скорость реакций присоединения-отщепления зависит от pH среды. При сравнительно высоких значениях pH медленной (скоростьопределяющей) стадией является отщепление воды от протонированной формы гем-аминоспирта (III). По мере увеличения кислотности среды концентрация катиона (III) возрастает и скорость реакции растет. При низких значениях pH медленной стадией является взаимодействие карбонильного соединения с нуклеофилом. Это связано с тем, что в сильнокислой среде нуклеофил XNH2 существует в виде неактивного аммониевого иона XNH3+. Таким образом, кривая зависимости скорости реакции от pH среды имеет колоколообразную форму, как это показано на примере реакции образования оксима ацетона (CH3)2C=NOH. Оптимум процесса в данном случае приходится на pH ~ 4.

Реакция с аминами. При взаимодействии альдегидов и кетонов с первичными аминами образуются N-замещенные имины (основания Шиффа):
![]()
Имины, полученные из алифатических аминов и алифатических карбонильных соединений, обычно малоустойчивы, быстро разлагаются или полимеризуются. Производные ароматических аминов или ароматических альдегидов более стабильны. Образование иминов происходит в ряде биохимических реакций, например, на одной из стадий зрительного цикла.
Реакция с гидразинами. При взаимодействии альдегидов и кетонов с гидразином и замещенными гидразинами получаются гидразоны. Свободная аминогруппа гидразона способна вступать в реакцию со второй молекулой карбонильного соединения с образованием азина, поэтому гидразоны в большинстве случаев бывает трудно выделить.
![]()
Замещенные гидразины, особенно арилгидразины, образуют в реакциях с карбонильными соединениями устойчивые гидразоны. Арилгидразоны представляют собой хорошо кристаллизующиеся соединения с четкими температурами плавления, благодаря чему их можно использовать для идентификации карбонильных соединений (качественная реакция).

С помощью высокоэффективной жидкостной хроматографии 2,4-динитрофенилгидразонов проведено количественное определение альдегидов и кетонов, образующихся в атмосфере при фотохимическом окислении углеводородов.
Реакция с гидроксиламином. При взаимодействии альдегидов и кетонов с гидроксил амином получаются соответствующие оксимы, например:

Оксимы представляют собой кристаллические вещества, однако из-за низких температур плавления они не пригодны для идентификации альдегидов или кетонов. Образование оксимов лежит в основе оксимного титрования, используемого в фармацевтическом анализе для количественного определения достаточно активных альдегидов и кетонов, например, таким методом определяют камфору (качественная реакция). Альдегид или кетон вводят в реакцию с гидрохлоридом гидроксиламина, выделившийся при этом хлороводород оттитровывают щелочью.
Реакция с семикарбазидом. При взаимодействии альдегидов и кетонов с семикарбазидом получаются семикарбазоны:

Семикарбазоны — кристаллические вещества с четкими температурами плавления, и поэтому, как и гидрозоны, их используют для идентификации альдегидов и кетонов (качественная реакция). Некоторые семикарбазоны применяют в качестве лекарственных средств.
-
Альдегиды и кетоны: реакции с участием -СН-кислотного центра – енолизация, строение енолят-иона, кето-енольная таутомерия, галоформная реакция, иодоформная проба, альдольная и кротоновая конденсации. Реакция Канниццаро (механизм).
Нуклеофильное присоединение. Реакции с углеродсодержащими нуклеофилами.
С соединениями, обладающими СН-кислотными свойствами, альдегиды и кетоны способны вступать в различные реакции конденсации. Соединение, содержащее подвижный водород, в этих реакциях выступает в качестве нуклеофильного реагента и называется метиленовой компонентой, а альдегид или кетон — карбонильной компонентой. Реакции присоединения часто сопровождаются отщеплением воды. Реакции конденсации карбонильных соединений протекают в условиях кислотного и основного катализа.
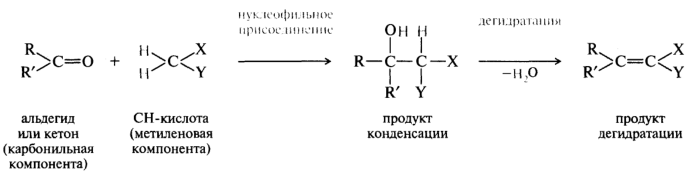
где X и Y — электроноакцепторные заместители (один или два).
Альдольная конденсация. Реакция протекает при действии на альдегиды или кетоны разбавленных щелочей. При этом одна молекула альдегида представляет собой карбонильную компоненту, а другая — метиленовую.
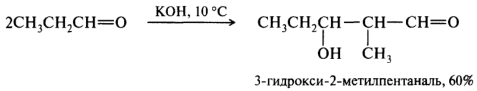
При действии основания альдегид отщепляет протон от α-СН-кислотного центра и превращается в карбанион (I), заряд в котором делокализован за счет сопряжения. Карбанион, являясь сильным нуклеофилом, присоединяется к другой молекуле альдегида. Стабилизация образовавшегося аниона (II) происходит за счет отщепления протона от какой-либо слабой кислоты, например воды.

Альдольная конденсация — обратимая, обратный процесс называется альдольным расщеплением (ретроальдольной реакцией). Если альдольная конденсация сопровождается отщеплением воды (часто происходит при повышенной температуре), то такая реакция называется кротоновой конденсацией. Протеканию дегидратации способствует наличие в альдоле α-СН-кислотного центра и π,π-сопряжения в образующемся α,β-ненасыщенном альдегиде или кетоне:

Реакции альдольной или кротоновой конденсации часто проводятся в смешанном варианте, когда карбонильная и метиленовая компоненты — разные соединения. Подбор партнеров для этих реакций осуществляется исходя из того, что карбонильная компонента должна иметь высокую реакционную способность в реакциях нуклеофильного присоединения, обычно это различные альдегиды. В то же время метиленовая компонента должна обладать достаточно высокой СН-кислотностью, поэтому ею могут быть разнообразные альдегиды или кетоны, имеющие α-атом водорода. Правильный выбор реагентов позволяет свести к минимуму побочные реакции — самоконденсацию метиленовой компоненты, альтернативную смешанную конденсацию. Например, ароматические альдегиды не имеют α-атома водорода и могут быть только карбонильными компонентами:

Восстановление.
Карбонильные соединения могут быть восстановлены в спирты. Альдегиды восстанавливаются в первичные спирты, кетоны — во вторичные. Некоторые методы позволяют восстановить карбонильную группу в метиленовую.
Диспропорционирование. Альдегиды, у которых отсутствует подвижный водород у α-атома углерода, при действии концентрированного раствора щелочи подвергаются диспропорционированию — реакции Канниццар. При этом половина всего количества альдегида восстанавливается в спирт, а другая — окисляется в карбоновую кислоту:

Вначале молекула альдегида присоединяет в качестве нуклеофила гидроксид-ион. Медленной стадией реакции является перенос гидрид-иона от образовавшегося на первой стадии аниона к другой молекуле альдегида. Именно на этой стадии молекула альдегида — донор гидрид-иона — окисляется, а молекула, присоединяющая гидрид-ион, восстанавливается. На последней стадии происходит перенос протона от сильной кислоты (бензойная кислота) к сильному основанию (бензилоксид-ион).

Катион металла стабилизирует шестизвенное переходное состояние. Если в реакционную смесь добавить 18-краун-6, который образует с металлом прочный комплекс, то выход продуктов резко снижается.
Галоформная реакция. Метилкетоны, а также ацетальдегид при взаимодействии с хлором, бромом или иодом в щелочной среде галогенируются по метильной группе, превращаясь в тригалогенопроизводные. Образовавшийся тригалогенокетон или тригалогеноацетальдегид в щелочной среде расщепляется на карбоновую кислоту (в виде соли) и галоформ (хлороформ, бромоформ, иодоформ).
![]()
Галоформную реакцию используют как способ получения карбоновых кислот, а также для обнаружения метилкетонов и ацетальдегида. Этим целям служит иодоформная проба, проведение которой сопровождается образованием йодоформа СНI3 — кристаллического вещества бледно-желтого цвета с характерным запахом. Иодоформная проба позволяет также идентифицировать этанол и вторичные спирты, имеющие в своем составе фрагмент СН3—СН(ОН)— (качественная реакция). Эти спирты в условиях опыта окисляются в соответствующие карбонильные соединения.
