
2л4
.pdf
ЛЕКЦИЯ 4
Химия элементов VIIВ группы

1.Общая характеристика d-элементов VIIВ группы
2.Природные ресурсы
3.Физические и химические свойства
4.Важнейшие соединения
5.Применение в фармацевтическом анализе и в медицине
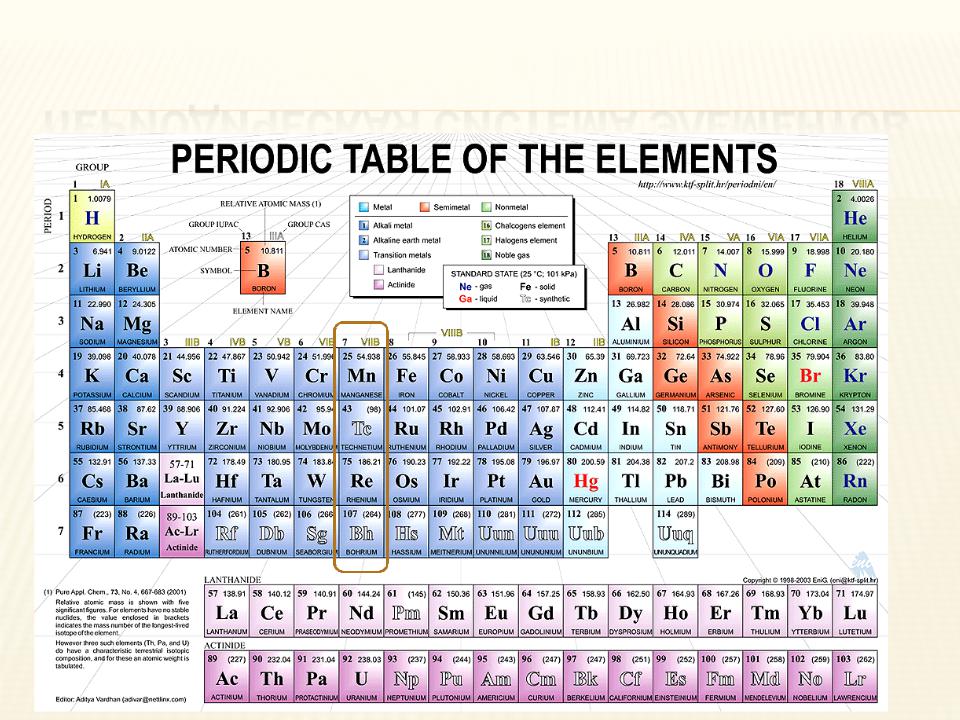
ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ

Некоторые свойства элементов VII В группы
|
Mn |
Tc |
Re |
Содержание в земной коре (мас. доля, %) |
3,2·10-2 |
следы |
8,5·10-9 |
Электронная конфигурация |
[Ar]4s23d5 |
[Kr]4s23d5 |
[Xe]4s23d5 |
Радиус атома, нм |
0,127 |
0,136 |
0,137 |
Энергия ионизации, кДж/моль |
717 |
702 |
756 |
Электроотрицательность |
1,60 |
1,36 |
1,46 |
|
|
|
|
t плавления, 0С |
1245 |
≈2250 |
3190 |
Плотность, г/см3 |
7,44 |
11,5 |
21,0 |
Степень окисления в соединениях |
+2,+3,+4, |
+2,+4, |
+2,+3,+4, |
|
+6, +7 |
+6, +7 |
+6, +7 |
|
|
|
|

Элементы VIIВ группы Mn, Tc, Re, Bh
Вряду стандартных электродных
потенциалов металлов Mn стоит до Н2, а Tc и Re располагаются после Н2.
Всоединениях Mn, Tc, Re проявляют переменную степень окисления: 0, +2, +3, +4, +6, +7
Нулевую степень окисления Mn имеет в карбониле марганца Mn2(CO)10.
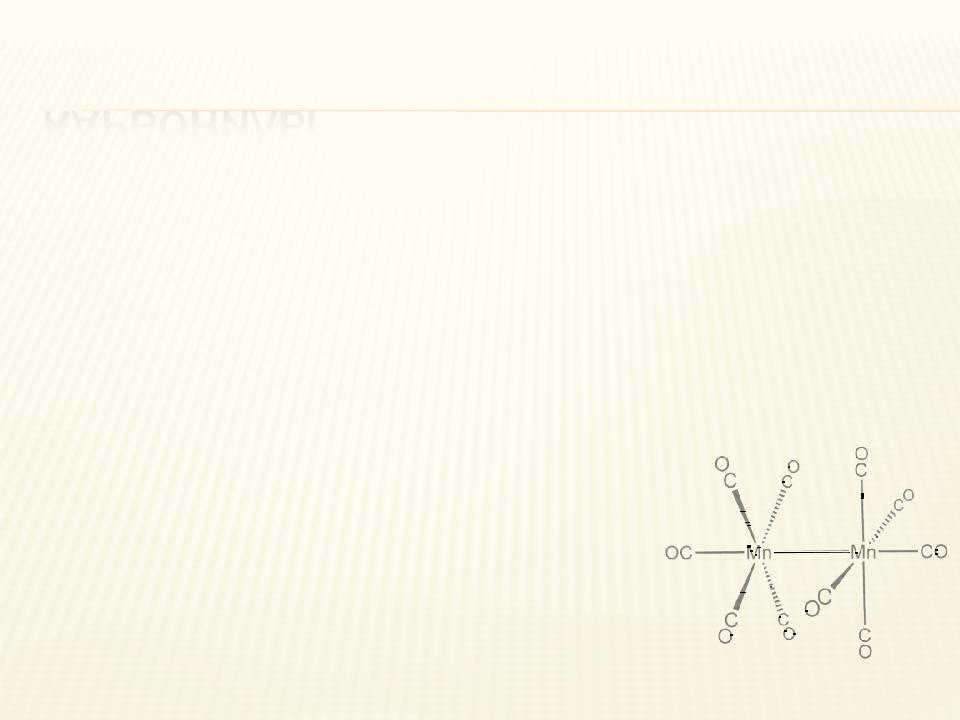
КАРБОНИЛЫ
ÒАтом металла в карбониле находится в нулевой степени окисления. Карбонилы бывают одно-, двух- и многоядерными, при этом d-элементы с чётным
числом валентных электронов образуют одноядерные, а с нечётным — двухъядерные карбонилы со связью металл-металл.
ÒОбщий способ получения карбонилов металлов заключается во взаимодействии окиси углерода (CO) с металлами или их солями при повышенных температурах и давлении.
ÒТермическое разложение карбонилов используется для нанесения металлических покрытий на поверхности сложной формы.
ÒНекоторые карбонилы применяются в качестве катализаторов важных химических процессов: при синтезе карбоновых кислот и их производных.

В солях наиболее устойчивая степень окисления
Mn+2 (MnSO4);
в оксидах самая устойчивая степень окисления
Mn+4 (MnO2).
Наиболее устойчивы соединения Tc и Re содержат эти элементы в степени окисления +7.
Характер связи Mn, Tc, Re в соединениях с другими атомами изменяется в зависимости от их степени окисления. Соединения с низкой степенью окисления (+2) имеют ионный характер связи; в соединениях с высокой степенью окисления (+7) наблюдается ковалентный характер связи (с кислородом).

2. ПРИРОДНЫЕ РЕСУРСЫ
Только Mn и Re встречаются в природе в виде соединений; Тс получают с помощью ядерных превращений.
Пиролюзит MnO2,
Родохрозит MnCO3
Железо – марганцевые конкреции
Рений содержащий (промышленный) минерал – молибденит MoS2. В нем находят до 1,88% Re.
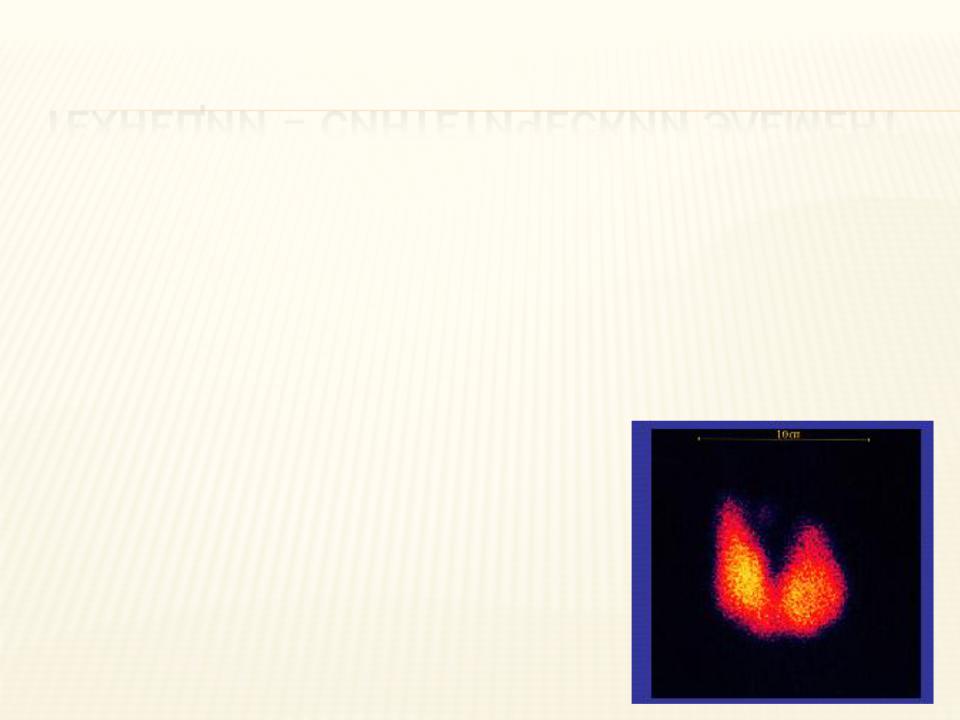
ТЕХНЕЦИЙ – СИНТЕТИЧЕСКИЙ ЭЛЕМЕНТ
Технеций не имеет стабильных изотопов.
Широко используется в ядерной медицине для исследований мозга, сердца, щитовидной железы, легких, печени, желчного пузыря, почек, костей скелета, крови, а также для диагностики опухолей.
Технеций при введении в организм попадает почти во все органы, но в основном задерживается в желудке и щитовидной железе.

3. ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА МАРГАНЦА
ÒСеребристо-белый, твердый, стойкий на воздухе. Чистый Mn можно прокатывать и штамповать. При обычной температуре не обладает заметной реакционной способностью, но при нагревании бурно реагирует с большинством неметаллов
