
- •Амины: классификация, номенклатура; химическая идентификация, спектральные характеристики. Представители: анилин, n–метиланилин, n,n–диметиланилин, толуидины, фенетидины, дифениламин.
- •Амины: реакции первичных, вторичных и третичных алифатических и ароматических аминов с азотистой кислотой; карбиламинная реакция (изонитрильная проба).
- •Ароматические амины: влияние аминогруппы на реакционную способность ароматического ядра; реакции галогенирования, сульфирования, нитрования. Защита аминогруппы.
- •Диазосоединения: номенклатура; реакция диазотирования (вопр. 29), механизм и условия проведения; строение солей диазония; влияние рН среды на устойчивость солей диазония.
- •Диазосоединения: реакции солей диазония с выделением азота, синтетические возможности реакций.
- •Диазосоединения: реакции без выделения азота; реакция азосочетания, ее механизм, диазо– и азосоставляющие; использование реакции азосочетания для идентификации фенолов и ароматических аминов.
- •Азосоединения: азокрасители (метиловый оранжевый), индикаторные свойства; основы теории цветности.
- •Альдегиды и кетоны: факторы, определяющие реакционную способность; реакции присоединения воды и спиртов, механизм, роль кислотного катализа в образовании ацеталей и полуацеталей.
- •Альдегиды и кетоны: механизм аn; присоединение гидросульфита натрия, циановодорода, магнийорганических соединений, значение этих реакций.
- •Альдегиды и кетоны: реакции присоединения-отщепления – образование иминов, оксимов, гидразонов, семикарбазонов, использование этих реакций для идентификации оксосоединений.
- •Альдегиды и кетоны: реакции восстановления – гидридами и комплексными гидридами, восстановление по Кижнеру–Вольфу и Клемменсену; реакции окисления альдегидов катионами серебра (I) и меди (II).
- •Карбоновые кислоты: кислотные свойства, строение карбоксилат-аниона; сравнительная характеристика кислотных свойств алифатических и ароматических моно- и дикарбоновых кислот; образование солей.
- •Карбоновые кислоты: реакции нуклеофильного замещения, механизм; образование функциональных производных.
- •Сложные эфиры: номенклатура, кислотный и щелочной гидролиз, аммонолиз; идентификация.
- •Дикарбоновые кислоты: специфические свойства. Представители: щавелевая, малоновая, янтарная, глутаровая, фталевая кислоты.
- •Фталевая кислота, фталевый ангидрид, фталимид; синтез фенолфталеина, его индикаторные свойства.
- •Аминокислоты: номенклатура, химические свойства как гетерофункциональных соединений; специфические реакции –, β–, –аминокислот; лактамы, дикетопиперазины, отношение к гидролизу.
- •Пептиды и белки: первичная структура, строение (электронное, пространственное) пептидной группы, частичный и полный гидролиз.
- •Кето-енольная таутомерия β – дикарбонильных соединений (ацетилацетон, ацетоуксусный эфир, щавелевоуксусная кислота). Реакции кетонной и енольной форм ацетоуксусного эфира.
- •Ацетоуксусный эфир: строение, таутомерия; синтез карбоновых кислот и кетонов.
- •Сульфаниловая кислота: строение, биполярная структура; реакция диазотирования (вопр. 29); сульфаниламид (стрептоцид), общий принцип строения сульфаниламидных лекарственных препаратов.
-
Карбоновые кислоты: кислотные свойства, строение карбоксилат-аниона; сравнительная характеристика кислотных свойств алифатических и ароматических моно- и дикарбоновых кислот; образование солей.
Кислотные свойства.
Карбоновые кислоты обладают более сильными кислотными свойствами, чем спирты и фенолы. В водных растворах они слабо диссоциированы, кислая среда обнаруживается с помощью индикаторов. При взаимодействии с основаниями карбоновые кислоты образуют соли:

Карбоновые кислоты в целом — слабые кислоты: в водных растворах их соли сильно гидролизованы. Дикарбоновые кислоты образуют два ряда солей — кислые и средние. Соли некоторых карбоновых кислот, например ацетаты и цитраты, используются для приготовления буферных растворов.
Более сильные кислотные свойства карбоновых кислот по сравнению с другими ОН-кислотами (спиртами и большинством фенолов) объясняются тем, что их анионы стабилизированы за счет сопряжения. В анионе происходит полная делокализация π-электронной плотности, вследствие чего отрицательный заряд поровну распределяется между двумя атомами кислорода:
![]()
Симметричное строение аниона, равноценность атомов кислорода, одинаковые длины связей углерод—кислород подтверждаются данными рентгеноструктурного анализа.
Строение радикала влияет на кислотные свойства карбоновых кислот. В целом электроноакцепторные заместители усиливают кислотность, а электронодонорные — снижают. Длина и разветвленность насыщенного алкильного радикала не оказывают существенного влияния на кислотные свойства. Так, значения рКа насыщенных алифатических кислот С2—С9 изменяются в пределах 4,8—5,0.
Ненасыщенные и ароматические кислоты обладают несколько большей кислотностью, чем насыщенные алифатические кислоты. Ароматические кислоты с заместителем в орто-положении более сильные кислоты, чем мета- и пара-изомеры, независимо от типа заместителя. В ряде случаев, например, у салициловой кислоты, повышенная кислотность орто-изомеров объясняется стабилизацией аниона за счет образования внутримолекулярных водородных связей:

Влияние электроноакцепторных заместителей на кислотные свойства карбоновых кислот в алифатическом ряду подчиняется довольно четким закономерностям как по числу этих заместителей, так и по взаимному расположению электроноакцепторной и карбоксильной групп. Вследствие затухания индуктивного эффекта второй карбоксильной группы кислотные свойства дикарбоновых кислот (по первой ступени диссоциации) уменьшаются по мере удаления карбоксильных групп друг от друга.
-
Карбоновые кислоты: реакции нуклеофильного замещения, механизм; образование функциональных производных.
Реакции нуклеофильного замещения.
Одну из важнейших групп реакций, характерных для карбоновых кислот, составляют реакции нуклеофильного замещения у sp2-12C карбоксильной группы, в результате которых гидроксильная группа замещается на другой нуклеофил. За счет положительного мезомерного эффекта гидроксильной группы электрофильность атома углерода карбоксильной группы значительно ниже, чем у атома углерода карбонильной группы альдегидов и кетонов, поэтому реакции нуклеофильного замещения в карбоксильной группе проводятся в присутствии кислотного катализатора. Используются также иные приемы, суть которых сводится к превращению плохой уходящей группы НО- в хорошую. В результате этих реакций образуются функциональные производные карбоновых кислот — сложные эфиры, амиды, ангидриды, галогенангидриды и др.
Реакции замещения у sp2-гибридизованного атома углерода карбоксильной группы по своему результату относительно участвующего во взаимодействии нуклеофильного реагента могут рассматриваться как реакции ацилирования, поскольку они сопровождаются введением в молекулу нуклеофильного реагента ацильной группы R—СО—. Важнейшие ацильные группы — ацетил СН3СО—, формил НСО—, бензоил С6Н5СО—.
Образование сложных эфиров. При взаимодействии карбоновых кислот со спиртами в присутствии кислотных катализаторов образуются сложные эфиры, а сама реакция называется реакцией этерификации:

В качестве катализаторов используют концентрированную серную кислоту, газообразный хлороводород, сульфоновые кислоты, катионообменные смолы в Н+-форме.
В случае сильных карбоновых кислот, таких, как щавелевая, муравьиная, трифтороуксусная, отпадает необходимость добавления минеральной кислоты, так как подобные карбоновые кислоты сами катализируют реакцию:
![]()
Реакция этерификации, как и многие другие реакции замещения у тригонального атома углерода, чаще всего протекает по тетраэдрическому механизму, обозначаемому ААС2 (кислотнокатализируемая ацильная бимолекулярная реакция). На стадии катализа протонируется карбонильный атом кислорода молекулы карбоновой кислоты; гидроксильная группа не присоединяет протон, потому что неподеленная пара электронов атома кислорода находится в сопряжении с карбонильной группой. Возникший карбокатион (I) обладает значительно более сильными электрофильными свойствами, чем исходная карбоновая кислота, и поэтому может присоединять даже слабый нуклеофил, каким является молекула спирта. В образовавшемся катионе (II) происходит перенос протона к одной из гидроксильных групп, и при этом формируется хорошая уходящая группа — молекула воды. После отщепления воды от катиона (III) и возврата катализатора образуется сложный эфир.
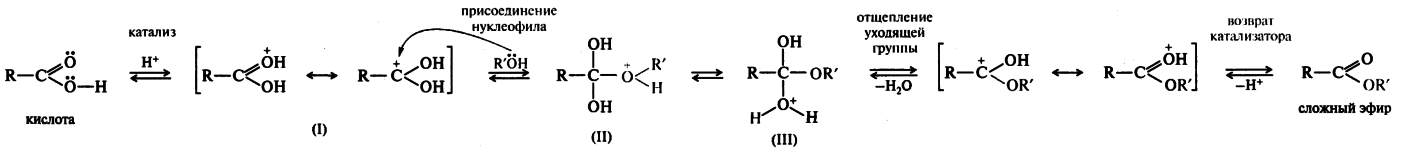
Все стадии реакции этерификации обратимы; обратная реакция представляет собой катализируемый кислотой гидролиз сложных эфиров. При получении сложных эфиров смещение равновесия вправо достигается разными способами: удалением воды азеотропной отгонкой или с помощью осушителей, либо с применением большого избытка спирта или кислоты, если тот или другой реактив достаточно доступен. Смещение равновесия достигается также путем отгонки образующегося сложного эфира.
Одним из доказательств приведенного выше механизма является то, что при гидролизе сложных эфиров водой, меченной по кислороду, изотопная метка целиком оказывается в образовавшейся кислоте:
![]()
Образование галогенангидридов. При взаимодействии карбоновых кислот с галогенидами фосфора(III) или фосфора(V), а также с фосфорилхлоридом РOС13, образуются галогенангидриды, иначе называемые ацилгалогенидами:

Для получения хлорангидридов, особенно высококипящих, часто используют также тионилхлорид SOC12:
![]()
Механизм реакции включает образование промежуточного смешанного ангидрида карбоновой и сернистой кислот (I), неорганическая часть которого является хорошей уходящей группой. Далее смешанный ангидрид подвергается нуклеофильной атаке хлорид-ионом и через тетраэдрический интермедиат (II) превращается в хлорангидрид.

Образование ангидридов. Под действием такого сильного водоотнимающего средства, как оксид фосфора(V), карбоновые кислоты превращаются в ангидриды:

Образование амидов. При нагревании аммониевых солей карбоновых кислот получаются амиды:

При взаимодействии карбоновых кислот с первичными или вторичными аминами образуются соответственно моно- и дизамещенные амиды:

-
Функциональные производные карбоновых кислот. Реакции нуклеофильного замещения у sp2–гибридного атома углерода (вопр. 43 и др.), механизм, роль кислотного и основного катализа. Ацилирующая способность функциональных производных карбоновых кислот. Химическая идентификация функциональных производных.
Функциональными производными называют производные карбоновых кислот, у которых ОН-группа замещена нуклеофильной частицей Z. Нуклеофильное замещение в карбоксильной группе приводит к образованию функциональных производных карбоновых кислот общей формулы R— C(О)Z. Химическая природа фрагмента Z варьирует в широком диапазоне, что обусловливает разнообразие функциональных производных.

Функциональные производные, подобно карбоновым кислотам, способны вступать в реакции ацилирования, и поэтому их можно рассматривать как ацильные производные различных нуклеофилов. Реакции ацилирования приводят к образованию других функциональных производных карбоновых кислот.
Реакции ацилирования с участием функциональных производных карбоновых кислот представляют собой реакции нуклеофильного замещения у sp2-гибридизованного атома углерода:
![]()
Реакционная способность функциональных производных в реакциях ацилирования (ацилирующая способность) зависит от природы частицы Z и коррелируется со стабильностью уходящего аниона Z-: (!) чем стабильнее анион, тем выше реакционная способность ацильного производного.
Наибольшей ацилирующей активностью обладают галогенангидриды и ангидриды, так как их ацильные остатки соединены с хорошими уходящими группами — галогенид-ионами и анионами карбоновых кислот. Сложные эфиры и амиды проявляют более низкую ацилирующую способность, потому что соответственно алкоксид- и амид-ионы не относятся к стабильным анионам и не являются хорошими уходящими группами. Такой подход к оценке ацилирующей способности показан ниже на примере сопоставления наиболее важных функциональных производных карбоновых кислот:

Место других ацильных производных в этом ряду можно прогнозировать, сравнивая относительную стабильность уходящих групп. При этом положение в ряду функциональных производных не следует рассматривать как раз и навсегда заданное. Например, известно, что сложные эфиры менее реакционноспособны, чем карбоновые кислоты, но имеются случаи, когда уходящая группа R'O- более стабильна, чем гидроксид-ион.
Так, сложные эфиры п-нитрофенола продуцируют хорошую уходящую группу — п-нитрофенолят-ион, а потому являются более сильными ацилирующими агентами, чем карбоновые кислоты (это обстоятельство используется в пептидном синтезе).

Реакции ацилирования протекают в основном по тетраэдрическому механизму, который включает две стадии. Первая, медленная стадия состоит в присоединении нуклеофила по двойной связи С=О и образовании тетраэдрического интермедиата. На стадии происходит отщепление уходящей группы.

Реакции ацилирования катализируются как кислотами, так и основаниями. Катализируемая кислотами бимолекулярная реакция ААС2 включает дополнительно стадию присоединения протона (катализатора) и стадию регенерации катализатора. По этому механизму протекают уже упоминавшиеся реакции этерификации и кислотного гидролиза сложных эфиров. Тетраэдрический механизм реализуется также в условиях основного катализа и сокращенно обозначается ВАС2, т. е. катализируемая основанием ацильная бимолекулярная реакция.
Галогенангидриды.
Галогенангидридами называются функциональные производные карбоновых кислот общей формулы RC(О)Hal. Термин «галогенангидрид» нельзя признать удачным, так как «ангидрид» означает удаление воды, чего не наблюдается при превращении карбоновой кислоты в галогенангидрид. Тем не менее именно этот термин используется в русской химической номенклатуре.
Галогенангидриды представляют собой жидкости или твердые вещества с резким навязчивым запахом, сильно раздражают кожу и слизистые оболочки. Практическое значение имеют ацилхлориды и ацилбромиды.
![]()
Реакции ацилирования. Галогенангидриды относятся к наиболее активным ацилирующим агентам, их используют для получения большинства других функциональных производных карбоновых кислот [(2)-(6)]. Ацилгалогениды очень легко гидролизуются в карбоновые кислоты [(1)], поэтому их хранят в условиях, исключающих доступ влаги воздуха. C помощью галогенангидридов удается проацилировать такие соединения, которые не вступают в реакцию с другими ацилирующими агентами, например, третичные спирты и фенолы.

Восстановление. Галогенангидриды восстанавливают комплексными гидридами металлов в первичные спирты:
![]()
Гидрирование галогенангидридов на палладиевом катализаторе приводит к альдегидам:

Ангидриды.
Ангидридами называются функциональные производные карбоновых кислот общей формулы RC(O)OC(O)R’.
Ангидриды можно рассматривать как продукты отщепления воды от карбоксильных групп двух молекул монокарбоновой кислоты или одной молекулы дикарбоновой кислоты. Существуют три основных типа ангидридов — симметричные, включающие остатки одинаковых карбоновых кислот, смешанные, содержащие остатки разных кислот, в том числе минеральных, и циклические ангидриды — производные дикарбоновых кислот:

Ангидриды представляют собой жидкости или твердые вещества, низшие ангидриды имеют раздражающий запах, похожий на запах соответствующей кислоты.
Реакции ацилирования. Высокая ацилирующая способность ангидридов используется для получения большинства функциональных производных карбоновых кислот, как показано на примере уксусного ангидрида:

Реакции ацилирования протекают в условиях как кислотного, так и основного катализа или без катализатора. В качестве кислотных катализаторов применяют серную и фосфорную кислоты, хлорид цинка, n-толуолсульфоновую кислоту и др. Ацетат натрия, алкоголяты и феноляты щелочных металлов применяют как основные катализаторы. Ангидриды, как и галогенангидриды, способны ацилировать такие малоактивные нуклеофилы, как третичные и другие пространственно затрудненные спирты, алкилфенолы, низкоосновные ароматические амины.
Из симметричных ангидридов наибольшее значение имеет уксусный ангидрид (ацетангидрид). Использование других симметричных ангидридов в реакциях ацилирования не оправдано из-за того, что при ацилировании ангидридами на один моль нуклеофила расходуется один моль ангидрида, т. е. идет двойной расход исходной карбоновой кислоты.
С помощью смешанных ангидридов в молекулу нуклеофила вводится остаток более слабой кислоты, потому что анион сильной кислоты является хорошей уходящей группой. Так, при ацилировании муравьиноуксусным или уксуснотрифтороуксусным ангидридом уходящими группами будут соответственно формиат- и трифтороацетат-ионы:

