
- •Амины: классификация, номенклатура; химическая идентификация, спектральные характеристики. Представители: анилин, n–метиланилин, n,n–диметиланилин, толуидины, фенетидины, дифениламин.
- •Амины: реакции первичных, вторичных и третичных алифатических и ароматических аминов с азотистой кислотой; карбиламинная реакция (изонитрильная проба).
- •Ароматические амины: влияние аминогруппы на реакционную способность ароматического ядра; реакции галогенирования, сульфирования, нитрования. Защита аминогруппы.
- •Диазосоединения: номенклатура; реакция диазотирования (вопр. 29), механизм и условия проведения; строение солей диазония; влияние рН среды на устойчивость солей диазония.
- •Диазосоединения: реакции солей диазония с выделением азота, синтетические возможности реакций.
- •Диазосоединения: реакции без выделения азота; реакция азосочетания, ее механизм, диазо– и азосоставляющие; использование реакции азосочетания для идентификации фенолов и ароматических аминов.
- •Азосоединения: азокрасители (метиловый оранжевый), индикаторные свойства; основы теории цветности.
- •Альдегиды и кетоны: факторы, определяющие реакционную способность; реакции присоединения воды и спиртов, механизм, роль кислотного катализа в образовании ацеталей и полуацеталей.
- •Альдегиды и кетоны: механизм аn; присоединение гидросульфита натрия, циановодорода, магнийорганических соединений, значение этих реакций.
- •Альдегиды и кетоны: реакции присоединения-отщепления – образование иминов, оксимов, гидразонов, семикарбазонов, использование этих реакций для идентификации оксосоединений.
- •Альдегиды и кетоны: реакции восстановления – гидридами и комплексными гидридами, восстановление по Кижнеру–Вольфу и Клемменсену; реакции окисления альдегидов катионами серебра (I) и меди (II).
- •Карбоновые кислоты: кислотные свойства, строение карбоксилат-аниона; сравнительная характеристика кислотных свойств алифатических и ароматических моно- и дикарбоновых кислот; образование солей.
- •Карбоновые кислоты: реакции нуклеофильного замещения, механизм; образование функциональных производных.
- •Сложные эфиры: номенклатура, кислотный и щелочной гидролиз, аммонолиз; идентификация.
- •Дикарбоновые кислоты: специфические свойства. Представители: щавелевая, малоновая, янтарная, глутаровая, фталевая кислоты.
- •Фталевая кислота, фталевый ангидрид, фталимид; синтез фенолфталеина, его индикаторные свойства.
- •Аминокислоты: номенклатура, химические свойства как гетерофункциональных соединений; специфические реакции –, β–, –аминокислот; лактамы, дикетопиперазины, отношение к гидролизу.
- •Пептиды и белки: первичная структура, строение (электронное, пространственное) пептидной группы, частичный и полный гидролиз.
- •Кето-енольная таутомерия β – дикарбонильных соединений (ацетилацетон, ацетоуксусный эфир, щавелевоуксусная кислота). Реакции кетонной и енольной форм ацетоуксусного эфира.
- •Ацетоуксусный эфир: строение, таутомерия; синтез карбоновых кислот и кетонов.
- •Сульфаниловая кислота: строение, биполярная структура; реакция диазотирования (вопр. 29); сульфаниламид (стрептоцид), общий принцип строения сульфаниламидных лекарственных препаратов.
-
Аминокислоты: номенклатура, химические свойства как гетерофункциональных соединений; специфические реакции –, β–, –аминокислот; лактамы, дикетопиперазины, отношение к гидролизу.
Аминокислоты — гетерофункциональные соединения, молекулы которых содержат одновременно аминогруппу и карбоксильную группу. В более широком смысле к аминокислотам могут быть отнесены и соединения с иной кислотной функцией, например аминосульфоновые кислоты.
В зависимости от местоположения функциональных групп в углеродном скелете молекулы различают аминокислоты алифатического и ароматического рядов. В свою очередь, с учетом взаимного расположения групп NH2 и СООН в углеродной цепи представители алифатического ряда подразделяются на α-, β-, γ-, δ-, ε-аминокислоты. Аминокислоты с более удаленными друг от друга функциональными группами объединяют в обозначении ω-аминокислоты. В зависимости от числа амино- и карбоксильных групп аминокислоты разделяют на моноаминомонокарбоновые, моноаминомонодикарбоновые, диаминомонокарбоновые.
Отметим еще раз, что буквы греческого алфавита не употребляются в заместительной номенклатуре ИЮПАК.

Среди аминокислот алифатического ряда наиболее распространенными и биологически значимыми являются α-аминокислоты, имеющие общую формулу R—CH(NH2)—СООН и отличающиеся друг от друга только строением радикала R. Они представляют собой структурные элементы многих природных соединений, главным образом белков. В настоящее время известно свыше 100 природных а-аминокислот, из которых только около 25 обнаружены в белках, а 20 аминокислот входят практически во все белковые молекулы.
В номенклатуре α-аминокислот прочно укрепились тривиальные названия, принятые номенклатурой ИЮПАК. Систематические названия α-аминокислот практически не применяются, хотя они допустимы. Сокращенное трехбуквенное обозначение аминокислот используется при записи строения пептидных и белковых молекул. Для обозначения стереохимии аминокислот традиционно используется D,L-система, более же универсальная R,S-система внедряется медленно. Всем L-аминокислотам, за исключением цистеина, соответствует S-конфигурация асимметрического центра.
Химические свойства аминокислот.
Свойства α-аминокислот.
Кислотно-основные свойства. Аминокислоты являются амфотерными соединениями, что обусловлено одновременным присутствием в молекуле основной (NH2) и кислотной (СООН) групп. И в кристаллическом состоянии, и в среде, близкой к нейтральной, аминокислоты существуют в виде внутренней соли — диполярного иона, называемого также цвиттер-ионом.
Реакции аминогруппы. Аминокислоты, содержащие первичную аминогруппу, подвергаются дезаминированию в реакции с азотистой кислотой. Используя эту реакцию, известную как метод Ван-Слайка, количественно определяют аминокислоты по объему выделившегося азота:
![]()
Несмотря на то что аминокислоты являются амфотерными соединениями, они могут быть оттитрованы щелочью по методу Сёренсена. Для этого аминокислоту предварительно обрабатывают избытком формалина, что приводит к образованию достаточно устойчивого N-гидроксиметильного производного, в котором основные свойства аминогруппы значительно понижены:

В результате становится возможным титрование полученного продукта, что и применяется в количественном анализе аминокислот. Этот метод называется также формальным титрованием. Методы Ван Слайка и Сёренсена сохранили лишь историческое значение в связи с появлением более эффективных методов анализа.
Аминокислоты подвергаются N-ацилированию по реакции Шоттена-Баумана при значениях pH, превышающих рI данной аминокислоты, т. е. когда аминогруппа не протонирована:
![]()
Если используются чувствительные к гидролизу хлорангидриды, то реакцию необходимо проводить при низкой температуре (0-10 °С) при строго контролируемом значении pH. N-Ацилирование часто служит способом защиты аминогруппы. Однако удаление этой защиты нередко бывает затруднительным, так как амиды карбоновых кислот гидролизуются в жестких условиях. В ряде случаев реакции N-ацилирования применяются для получения производных аминокислот с целью их последующего анализа высокочувствительными физическими методами. К таким производным относятся дансилъные производные, образующиеся при действии дансилхлорида.
Реакции карбоксильной группы. Одной из важнейших реакций аминокислот является этерификация. Принципиально эта реакция мало отличается от этерификации обычных карбоновых кислот; различие в том, что применяют не каталитическое количество минеральной кислоты, а больше чем эквивалентное. Причина этого заключается в амфотерности аминокислот. В качестве кислоты чаще всего применяют газообразный хлороводород. Сложные эфиры получаются при этом в виде соответствующих солей по аминогруппе. Перевод соли в эфир со свободной аминогруппой осуществляется действием различных реагентов: спиртовым раствором аммиака на холоду, третичными аминами, алкоксидами металлов (желательно того же спирта, которым проводилась этерификация, во избежание переэтерификации полученного эфира).

Хлорангидриды N-ациламинокислот, как и карбоновых кислот, образуются под действием пентахлорида фосфора или тионилхлорида на N-ациламинокислоты и были применены в синтезе первых пептидов.
![]()
α-Аминокислоты при нагревании c Ba(OH)2 подвергаются декарбоксилированию с образованием аминов:
![]()
Эта реакция не представляет практического интереса in vitro, но в биологических системах ее роль значительна. Амины, образующиеся в результате ферментативного декарбоксилирования аминокислот in vivo, называются биогенными аминами.
Реакции с одновременным участием амино- и карбоксильной групп.
При нагревании до температуры -200 °С α-аминокислоты подвергаются межмолекулярному ацилированию с образованием циклических шестичленных диамидов, называемых дикетопиперазинами (от аналогичного гетероцикла с двумяатомами азота — пиперазина):

Значительно легче вступают в подобную реакцию не сами аминокислоты, а их сложные эфиры (со свободной аминогруппой). Так, эфиры глицина в растворе самопроизвольно циклизуются в дикетопиперазины даже при комнатной температуре.
Свойства аминокислот с удаленными функциональными группами.
Аминокислоты этого типа по химическим свойствами во многом напоминают гидроксикислоты с аналогичным расположением функциональных групп.
γ- и δ-Аминокислоты. Специфической реакцией, протекающей при нагревании γ- и δ-аминокислот, является внутримолекулярное взаимодействие функциональных групп с образованием циклических амидов — лактамов. Этому способствует возможность для исходных аминокислот принимать клешневидную конформацию, а также термодинамическая устойчивость образующихся пяти- и шестичленного циклов.

В номенклатуре лактамов применяется тот же принцип, что и для лактонов, только с использованием суффикса -лактам (вместо -лактон или -олид). Кроме того, лактамы часто называются как оксопроизводные азотсодержащих гетероциклов.
γ- и δ-Лактамы являются типичными амидами и могут быть гидролизованы в соответствующие аминокислоты нагреванием с растворами сильных кислот или щелочей.

β-Аминокислоты.
Эти соединения при нагревании до 200 °С отщепляют молекулу аммиака, превращаясь в α,β-ненасыщенные кислоты. Элиминирование аммиака наблюдается в щелочной среде уже при 37 °С.
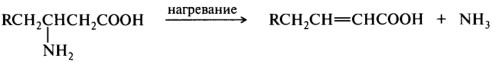
В этом отношении β-аминокислоты напоминают β-гидроксикислоты. Внутри- и межмолекулярное ацилирование аминогруппы здесь также не происходит вследствие неустойчивости четырех- или восьмичленного циклов. Однако четырехчленные циклические амиды (β-лактамы) образуются в мягких условиях при внутримолекулярном ацилировании в присутствии карбодиимидов:

Несмотря на гидролитическую нестабильность β-лактамного цикла, он является структурным фрагментом природных антибактериальных средств пенициллинов и цефалоспоринов, относящихся к группе β-лактамных антибиотиков.
-
α – Аминокислоты, входящие в состав белков, номенклатура. Классификация, стереоизомерия. Амфотерность, биполярная структура; химические свойства как гетерофункциональных соединений; реакции определения аминокислот.
Наиболее распространенными в природе и биологически значимыми являются α-аминокислоты, имеющие общую формулу и отличающиеся друг от друга только строением радикала R.
![]()
Они представляют собой структурные элементы многих природных соединений, главным образом белков. В настоящее время известно свыше 300 природных α-аминокислот, из которых только около 25 обнаружены в белках, а 20 аминокислот входят практически во все белковые молекулы, они получили название протеиногенных. Протеиногенными называются 20 аминокислот, которые кодируются генетическим кодом и включаются в белки в процессе трансляции.
Все алифатические аминокислоты, за исключением глицина (аминоуксусной кислоты) и ω-аминокислот (буква ω означает положение заместителя на конце углеродной цепи), содержат асимметрический атом углерода и могут поэтому существовать в виде стереоизомеров (в простейшем случае — энантиомеров).
В номенклатуре α-аминокислот прочно укрепились тривиальные названия, принятые номенклатурой ИЮПАК. Систематические названия α-аминокислот практически не применяются, хотя они, безусловно, допустимы. Сокращенное трехбуквенное обозначение аминокислот используется при записи строения пептидных и белковых молекул.

Классификация протеиногенных аминокислот.
Современная классификация аминокислот основана на полярности радикалов (R), т. е. способности их к взаимодействию с водой при физиологических значениях рН (близких к рН 7,0). Выделяют две группы аминокислот:
-
α-аминокислоты с неполярными (гидрофобными) радикалами;
-
α -аминокислоты с полярными (гидрофильными) радикалами;
Аминокислоты с неполярными радикалами. К аминокислотам с гидрофобным радикалом относятся аминокислоты с алифатическими и ароматическими боковыми радикалами. В структуре белков эти радикалы стремятся располагаться внутри глобул и участвуют в гидрофобном взаимодействии.
Аминокислоты с неполярным алифатическим радикалом:
-
глицин
-
аланин
-
валин
-
лейцин
-
изолейцин
-
пролин
Аминокислоты с неполярным ароматическим радикалом:
-
фенилаланин
-
тирозин
-
триптофан
Аминокислоты с полярными (гидрофильными) радикалами. Для гидрофильных радикалов α-аминокислот характерно наличие в них функциональных ионогенных или неионогенных групп. В структуре белков ионогенные группы α-аминокислот, как правило, располагаются на поверхности макромолекулы и обуславливают электростатические (ионные) взаимодействия. В полярных неионогенных радикалах α-аминокислот содержатся либо спиртовые, либо амидные группы. Эти неионогенные радикалы могут располагаться как на поверхности, так и внутри белковых молекул, участвуя в образовании водородных связей с другими полярными группами или молекулами.
Аминокислоты с полярным неионизирующимся радикалом:
-
Серин
-
Треонин
-
Цистеин
-
Метионин
-
Аспарагин
-
глутамин
Аминокислоты с полярным ионизирующимся положительно радикалом:
-
Лизин
-
Аргинин
-
гистидин
Аминокислоты с полярным ионизирующимся отрицательно радикалом:
-
аспарагиновая кислота
-
глутаминовая кислота
Многие α-аминокислоты синтезируются в организме, некоторые же необходимые для синтеза белков α-аминокислоты не синтезируются в организме и должны поступать с пищей, такие аминокислоты называют незаменимыми. К ним относятся: аргинин, валин, гистидин, изолейцин, лейцин, лизин, метионин, треонин, триптофан, фенилаланин. Аргинин и гистидин являются незаменимыми только для детей первого года жизни; в организме взрослого человека они синтезируются.
Стереохимия аминокислот.
Важнейшим свойством аминокислот, образующихся в процессе гидролиза природных белков, является их оптическая активность. Это свойство связано с наличием в молекуле всех природных аминокислот (за исключением глицина) в α-положении асимметрического атома углерода.
Большинство α-аминокислот содержит в молекуле один асимметрический атом углерода и существует в виде двух оптически активных энантиомеров и оптически неактивного рацемата.

Относительная конфигурация α-аминокислот определяется по конфигурационному стандарту — глицериновому альдегиду — с использованием «гидроксикислотного ключа». Расположение в проекционной формуле Фишера аминогруппы слева соответствует L-кон-фигурации (подобно ОН-группе в L-глицериновом альдегиде), справа — D-конфигурации хирального атома углерода.
Все аминокислоты, образующиеся при гидролизе природных белков в условиях, исключающих рацемизацию, принадлежат к L-ряду. Величина и знак оптического вращения зависят от природы радикалов аминокислот и значения рН раствора, в котором измеряют оптическую плотность.
Изолейцин и треонин содержат в молекуле по два хиральных центра и могут существовать в виде четырех диастереомеров (две пары энантиомеров).

Из этих четырех стереоизомеров только один используется для построения белков человеческого организма. В состав белков входит L-изолейцин. В названии той пары энантиомеров, стереоизомер которой не является структурным элементом белков, используется приставка алло-.
В белках микроорганизмов и пептидах могут встречаться и D-аминокислоты. Так, D-изомеры глутаминовой кислоты, аланина, валина, фенилаланина, лейцина и ряда других открыты в клеточной стенке бактерий. Согласно R,S-системе асимметрический атом углерода у α-аминокислот L-ряда имеет S-конфигурацию (исключение цистеин).
Химические свойства аминокислот. Свойства α-аминокислот.
Кислотно-основные свойства. Аминокислоты являются амфотерными соединениями, что обусловлено одновременным присутствием в молекуле основной (NH2) и кислотной (СООН) групп. Однако привычное написание формул аминокислот как соединений, содержащих амино- и карбоксильную группы — RCH(NH2)COOH, является условным и не отражает их истинного строения. И в кристаллическом состоянии, и в среде, близкой к нейтральной, аминокислоты существуют в виде внутренней соли — диполярного иона, называемого также цвиттер-ионом. В сильнокислой среде (pH 1—2) в аминокислотах полностью протонирована аминогруппа и не диссоциирована карбоксильная группа. В сильнощелочной среде (pH >12), напротив, свободна аминогруппа и полностью ионизирована карбоксильная:

Заметим, что при написании этого же кислотно-основного взаимодействия, исходя из «классической» формулы аминокислот, структуры ионных форм были бы такими же, как в приведенной схеме. Поэтому в записи схем реакций чаще используют формулы аминокислот в неионизированной форме.
α-Aминокислоты образуют соли как со щелочами, так и с кислотами:

Кроме солей, которые образуют α-аминокислоты с сильными кислотами или щелочами, известны комплексные соли многих аминокислот с ионами двухвалентных металлов. Наиболее устойчивы комплексы с ионами Сu2+, Ni2+, Zn2+, Со2+ (в порядке снижения стабильности). Так, с гидроксидом меди(II) получаются кристаллические хелатные соли синего цвета, которые используются для выделения и очистки аминокислот (качественная реакция):

Для каждой аминокислоты существует определенное значение pH, называемое изоэлектрической точкой (обозначается pI или pHi), при котором содержание диполярного иона максимально. Для алифатических аминокислот это 6,0, т. е. находится в слабокислой области. Это объясняется тем, что кислотность группы —NH3+ в диполярном ионе выше основности группы —СОO—. Для кислот с дополнительными слабокислотными функциональными группами (SH-группа цистеина и ОН-группы серина, треонина и тирозина) значения рI лежат в более кислой области (5,0-5,7). Аспарагиновая и глутаминовая кислоты, содержащие дополнительную карбоксильную группу, относятся к кислым аминокислотам (рI ~3) и превосходят по кислотности уксусную кислоту. Напротив, диаминокислота лизин, а также аргинин, где дополнительным центром основности служит гуанидиновая группировка, являются представителями основных аминокислот (рI 9,6 и 10,8). Их основность сопоставима с основностью аммиака и алифатических аминов. Кислотно-основные свойства обусловливают возможность разделения и идентификации методами ионообменной хроматографии и электрофореза.
Качественные реакции на аминокислоты (качественная реакция).
Реакция с нингидрином применяется для открытия и количественного определения -аминокислот.

Продукт реакции имеет сине-фиолетовое окрашивание, интенсивность окраски которого (при 570 нм) пропорциональна количеству аминокислоты.
Биуретовая реакция служит для обнаружения пептидных связей в пептидах и белках. В щелочном растворе с ионами меди (II) наблюдается характерное фиолетовое окрашивание. В пептидах и белках пептидная связь обычно находится в амидной форме (или кетоформе), но в щелочной среде она переходит в иминольную (енольную).


Реакция с n-диметиламинобензальдегидом в среде серной кислоты используется для обнаружения триптофана (красно-фиолетовое окрашивание). Эта реакция применяется для количественного определения триптофана в продуктах расщепления белков.
Для обнаружения цистеина используется реакция с ацетатом свинца. При нагревании раствора белка с ацетатом свинца в щелочной среде образуется PbS, осадок черного цвета.
Ксантопротеиновая реакция служит для обнаружения ароматических и гетероциклических α-аминокислот (фенилаланина, тирозина, гистидина, триптофана).
При действии концентрированной азотной кислоты НNО3 на раствор белка образуется нитросоединение, окрашенное в желтый цвет. При добавлении к нему щелочи окраска становится оранжевой в связи с ионизацией фенольной гидроксильной группы и увеличением вклада аниона в сопряжение.

