
- •Амины: классификация, номенклатура; химическая идентификация, спектральные характеристики. Представители: анилин, n–метиланилин, n,n–диметиланилин, толуидины, фенетидины, дифениламин.
- •Амины: реакции первичных, вторичных и третичных алифатических и ароматических аминов с азотистой кислотой; карбиламинная реакция (изонитрильная проба).
- •Ароматические амины: влияние аминогруппы на реакционную способность ароматического ядра; реакции галогенирования, сульфирования, нитрования. Защита аминогруппы.
- •Диазосоединения: номенклатура; реакция диазотирования (вопр. 29), механизм и условия проведения; строение солей диазония; влияние рН среды на устойчивость солей диазония.
- •Диазосоединения: реакции солей диазония с выделением азота, синтетические возможности реакций.
- •Диазосоединения: реакции без выделения азота; реакция азосочетания, ее механизм, диазо– и азосоставляющие; использование реакции азосочетания для идентификации фенолов и ароматических аминов.
- •Азосоединения: азокрасители (метиловый оранжевый), индикаторные свойства; основы теории цветности.
- •Альдегиды и кетоны: факторы, определяющие реакционную способность; реакции присоединения воды и спиртов, механизм, роль кислотного катализа в образовании ацеталей и полуацеталей.
- •Альдегиды и кетоны: механизм аn; присоединение гидросульфита натрия, циановодорода, магнийорганических соединений, значение этих реакций.
- •Альдегиды и кетоны: реакции присоединения-отщепления – образование иминов, оксимов, гидразонов, семикарбазонов, использование этих реакций для идентификации оксосоединений.
- •Альдегиды и кетоны: реакции восстановления – гидридами и комплексными гидридами, восстановление по Кижнеру–Вольфу и Клемменсену; реакции окисления альдегидов катионами серебра (I) и меди (II).
- •Карбоновые кислоты: кислотные свойства, строение карбоксилат-аниона; сравнительная характеристика кислотных свойств алифатических и ароматических моно- и дикарбоновых кислот; образование солей.
- •Карбоновые кислоты: реакции нуклеофильного замещения, механизм; образование функциональных производных.
- •Сложные эфиры: номенклатура, кислотный и щелочной гидролиз, аммонолиз; идентификация.
- •Дикарбоновые кислоты: специфические свойства. Представители: щавелевая, малоновая, янтарная, глутаровая, фталевая кислоты.
- •Фталевая кислота, фталевый ангидрид, фталимид; синтез фенолфталеина, его индикаторные свойства.
- •Аминокислоты: номенклатура, химические свойства как гетерофункциональных соединений; специфические реакции –, β–, –аминокислот; лактамы, дикетопиперазины, отношение к гидролизу.
- •Пептиды и белки: первичная структура, строение (электронное, пространственное) пептидной группы, частичный и полный гидролиз.
- •Кето-енольная таутомерия β – дикарбонильных соединений (ацетилацетон, ацетоуксусный эфир, щавелевоуксусная кислота). Реакции кетонной и енольной форм ацетоуксусного эфира.
- •Ацетоуксусный эфир: строение, таутомерия; синтез карбоновых кислот и кетонов.
- •Сульфаниловая кислота: строение, биполярная структура; реакция диазотирования (вопр. 29); сульфаниламид (стрептоцид), общий принцип строения сульфаниламидных лекарственных препаратов.
-
Диазосоединения: реакции без выделения азота; реакция азосочетания, ее механизм, диазо– и азосоставляющие; использование реакции азосочетания для идентификации фенолов и ароматических аминов.
Ароматические диазосоединения.
Реакции солей арилдиазония без выделения азота.
Азосочетание. В результате реакции азосочетания солей арилдиазония с ароматическими аминами или фенолами образуются азосоединения. Реакция протекает по механизму электрофильного замещения, электрофилом здесь является диазокатион. Из-за большого объема диазокатиона реакция азосочетания главным образом проходит в пара-положение, а если оно занято, то диазокатион атакует орто-положение. Соль диазония (электрофильный реагент) в этой реакции называется диазокомпонентой, а фенол или амин (ароматический субстрат) — азокомпонентой:

Образующиеся в результате реакций азосочетания вещества окрашены; многие из них используются как красители и кислотно-основные индикаторы.
Азосочетание с фенолами проводят в слабощелочной среде (pH 8—10). При этих значениях pH фенол превращается в феноксид-ион, анионный центр которого проявляет положительные мезомерный и индуктивный эффекты и является одним из самых сильных электронодоноров и соответственно активаторов бензольного кольца по отношению к электрофильной атаке. Указанный интервал значений pH оптимален. При более низкой щелочности раствора концентрация ионизированных молекул будет небольшой, что приведет к снижению скорости реакции, в то же время при более высоких значениях pH соль арилдиазония превращается в диазогидроксид, который уже не проявляет свойств электрофильной частицы и, следовательно, не будет вступать в реакцию азосочетания. В качестве примера сочетания в щелочной среде приведено взаимодействие диазотированной сульфаниловой кислоты с β-нафтолом, приводящее к образованию красителя кислотного оранжевого:

Азосочетание с ароматическими аминами проводят в более широком интервале значений pH (4—10). Амин в реакцию азосочетания вступает только в непротонированной форме:

В слабокислой среде амин находится в равновесии со своей протонированной формой, при этом концентрация свободного основания достаточно высока, что обеспечивает протекание реакции азосочетания:
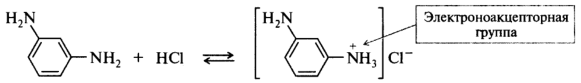
В сильнокислой среде амин полностью протонирован, образовавшаяся аммониевая группа является сильным электроноакцептором и дезактивирует ароматическое кольцо по отношению к реакции азосочетания. Азосочетание в нейтральной и слабощелочной средах проводят с теми аминами, которые при этих условиях хорошо растворимы в воде.
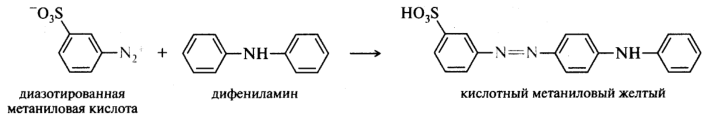
С некоторыми аминами азосочетание проводят в присутствии поверхностно-активных веществ, чтобы эмульгировать нерастворимый в воде амин. Так, дифениламин — очень слабое нерастворимое в воде основание, поэтому азосочетание с ним по одной из методик проводят в присутствии эмульгатора (зеленого мыла):
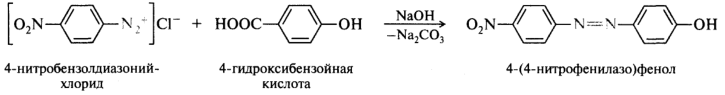
В процессе азосочетания может происходить электрофильное замещение сульфо- и карбоксильной групп, например:
-
Азосоединения: азокрасители (метиловый оранжевый), индикаторные свойства; основы теории цветности.
Азсоединениями (диазенами) называются соединения, содержащие азо-группу —N=N—, связанную с двумя углеводородными радикалами. В зависимости от строения углеводородного радикала азосоединения могут быть алифатическими, ароматическими и смешанными.
Атомы азота в азогруппе находятся в sp2-гибридном состоянии с расположением неподеленных пар электронов на гибридных орбиталях. Азосоединения способны существовать в виде π-диастереомеров, из них термодинамически более устойчив E-изомер. При облучении его УФ-светом он превращается в Z-изомер, который при нагревании снова переходит в более устойчивую E-форму
Индикаторные свойства.
Еще более ста лет назад окраску веществ связывали с наличием в их структуре так называемых хромофорных групп, к которым относятся некоторые ненасыщенные группировки, например, двойные связи С=С, С=O, C=N, N=N, N=O, ароматические фрагменты.
Изолированные хромофоры имеют полосы поглощения в электронном спектре в дальней ультрафиолетовой области (165—200 нм) и являются прозрачными в видимой области спектра. Сопряжение одного хромофора с другим вызывает сдвиг полос поглощения в сторону больших длин волн с одновременным увеличением их интенсивности. Окрашенные вещества поглощают в видимой области спектра (400—800 нм). Очевидно, что такие соединения должны иметь в своей структуре длинную цепь сопряжения. Типичным примером окрашенных веществ служат азосоединения, характеризующиеся наличием в структуре в качестве главного хромофора фрагмента азобензола. Сопряженная система азобензола включает два бензольных кольца и азогруппу:

Различные азосоединения в зависимости от длины сопряженной системы могут быть окрашены в желтый, оранжевый, красный, синий и зеленый цвета. Изменению и углублению окраски способствует наличие в структуре ауксохромов — атомов или групп атомов, вступающих в р,π- и π,π-сопряжение с π-электронной системой главного хромофора. Наиболее интенсивную окраску имеют те соединения, в которых с главным хромофором сопряжены одновременно электронодонорные и электроноакцепторные группы, находящиеся в пара- или орто-положении по отношению друг к другу. Примерами таких соединений могут служить метиловый оранжевый (гелиантин), имеющий электронодонорную диметиламиногруппу, и электроноакцепторную сульфогруппу, а также метиловый красный, конго красный и др.
Многие ароматические азосоединения при действии кислот и оснований изменяют свою окраску в определенном интервале pH среды, благодаря чему используются в аналитической химии как индикаторы. При изменении pH происходит протонирование или депротонирование молекулы индикатора, что влечет за собой перераспределение электронной плотности в сопряженной системе.
Например, индикатор метиловый оранжевый в нейтральной и щелочной средах окрашен в желтый цвет. В кислой среде вследствие протонирования одного из атомов азота происходит изменение в распределении электронной плотности в сопряженной системе молекулы, являющееся причиной изменения желтой окраски на красную.
Протонированная форма молекулы метилового оранжевого может быть описана двумя мезомерными структурами, одна из которых хиноидная. Полагают, что изменение окраски в основном обусловлено вкладом хиноидной структуры (выделена цветом):

Имеется большое число кислотно-основных индикаторов, относящихся к разным классам окрашенных веществ, интервалы перехода окраски которых перекрывают весь диапазон значений pH. Большую ценность представляют индикаторы с узким интервалом перехода, например нитразиновый желтый.
-
Альдегиды и кетоны: классификация; номенклатура; химическая идентификация, спектральные характеристики. Представители: формальдегид (формалин), ацетальдегид, хлораль (хлоральгидрат), акролеин, бензальдегид, ацетон, циклогексанон, ацетофенон.
Альдегидами называются соединения, в которых карбонильная группа соединена с углеводородным ради капом и атомом водорода, а кетонами карбонильные соединения с двумя углеводородными радикалами. В альдегидах и кетонах функциональной группой является карбонильная группа >С=O, поэтому оба класса этих родственных веществ относятся к карбонильным соединениям:

В зависимости от строения углеводородных радикалов альдегиды и кетоны бывают алифатическими (насыщенными и ненасыщенными) и ароматическими. Кетоны, у которых карбонильная группа соединена с одинаковыми углеводородными радикалами, называются симметричными.
Номенклатура. Родовое название альдегиды имеют соединения, у которых группа — СН=О присоединена к атому углерода. В названиях ациклических альдегидов группа —СНО, если она является старшей и находится в главной цепи, обозначается суффиксом -аль. Нумерация ведется в этом случае от нее, поэтому локант «1» опускается. Диальдегиды называют путем добавления суффикса -диаль к названию родоначальной структуры. Если группа —СНО не является старшей или находится не в главной цепи, то используют префикс формил-.
![]()
Названия циклических альдегидов, в которых группа —СНО как старшая связана с циклом, строятся добавлением суффикса -карбальдегид к названию циклической системы:

Если соответствующая альдегиду карбоновая кислота имеет тривиальное название, то из него может быть образовано и тривиальное название альдегида:
![]()
Сохраняются следующие тривиальные названия:

Родовое название кетоны имеют соединения, содержащие карбонильную группу >С=О, связанную с двумя атомами углерода (оксогруппой называется фрагмент =O). Кетоны называют, используя суффикс -он, если нет более старшей группы. В ее присутствии используется префикс оксо-.
![]()
Сохраняется тривиальное название «ацетон» для СН3СОСН3.
Кетоны Ar— СО—R, в которых карбонильная группа присоединена к бензольному или нафталиновому ядру, называют, заменяя частицу -ил в названии ацильного радикала R—СО— на суффиксы -офенон и -онафтон соответственно:

Дикетоны, производимые от ароматических соединений заменой двух фрагментов — СН= на группы >С=O с последующей перегруппировкой двойных связей, называют, добавляя суффикс -хинон к названию ароматического соединения (иногда это название подвергают модификации):

Низшие алифатические альдегиды и кетоны, за исключением газообразного формальдегида, представляют собой подвижные жидкости. Первые представители (формальдегид, ацетальдегид, ацетон) хорошо растворимы в воде за счет образования с ней водородных связей или гидратных форм. По мере удлинения углеродной цепи растворимость карбонильных соединений в воде снижается. Ароматические карбонильные соединения плохо растворимы в воде.

Отдельные представители.
Формальдегид — СН2О — простейший и единственный газообразный альдегид, обладает резким раздражающим запахом, хорошо растворим в воде и спиртах, хуже в эфире, бензоле. В промышленности формальдегид получают парофазным окислением метанола, железо-молибденовые катализаторы обеспечивают выходы до 92%:
![]()
Формальдегид склонен к полимеризации, в зависимости от условий образуется линейный олигомер (параформальдегид, или параформ) или циклические тример и тетрамер. Параформ представляет собой белый порошок, при нагревании разлагается с образованием формальдегида, поэтому используется как форма хранения и транспортировки формальдегида.

При взаимодействии формальдегида с аммиаком образуется гексаметилентетрамин (уротропин). Первоначально образующийся продукт нуклеофильного присоединения аммиака к альдегиду в несколько стадий превращается в уротропин, каркасная структура которого сходна с кристаллической решеткой алмаза:

Гексаметилентетрамин используется в медицине как антисептическое средство. Основная масса производимого промышленностью формальдегида используется для производства феноло- и мочевиноформальдегидных смол. Водный 40%-й раствор формальдегида, стабилизированный добавкой 6—10% метанола, называется формалином (антисептик).
Ацетальдегид — СН3СНО — низкокипящая жидкость с резким запахом, смешивается во всех отношениях с водой и большинством органических растворителей. Ацетальдегид, подобно формальдегиду, в присутствии кислот легко образует циклический тример (паральдегид) и тетрамер (метальдегид):
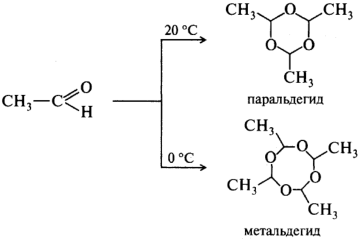
Метальдегид используется в качестве топлива (сухой спирт).
Ацетальдегид служит сырьем для промышленного получения многих соединений алифатического ряда — уксусной кислоты, уксусного ангидрида, этилацетата, бутанола-1, хлораля.
Хлораль (трихлорацетальдегид, трихлоруксусный альдегид) — CCl3CHO — бесцветная жидкость со специфическим резким запахом, растворим в органических растворителях и нерастворим в воде. Хлораль используют в производстве инсектицидов, в частности в производстве ДДТ, хлорофоса, дихлофоса.
Хлоральгидрат (2,2,2-трихлорэтандиол-1,1, C(Сl)3С(ОН)2Н) обладает снотворным и седативным действием, использующихся при анестезии. Чаще хлоралгидрат используется при психическом возбуждении и как противосудорожное средство при спазмофилии,столбняке и т. п. Входит в состав зубных капель «Дента».
Бензальдегид — С6Н5СНО — бесцветная жидкость с запахом горького миндаля. Пары бензальдегида обладают слезоточивым действием. Растворим в этаноле, диэтиловом эфире и других органических растворителях, практически нерастворим в воде. В природе встречается в виде гидроксинитрила C6H5CH(OH)CN (как составная часть амигдалина). Бензальдегид используют для синтеза коричной кислоты и альдегида, бензилбензоата, трифенилметановых красителей.
Акролеин (акриловый альдегид) — СН2=СНСНО — простейший ненасыщенный альдегид, представляющий собой бесцветную слезоточивую жидкость с резким запахом, образуется при термическом разложении жиров (кухонный чад), растворим в воде и органических растворителях. Акриловый альдегид легко полимеризуется и окисляется, поэтому его хранят в присутствии ингибиторов радикальных реакций. Применяют акриловый альдегид для синтеза акрилонитрила, глицерина, пиридина, некоторых аминокислот.
Ацетон — СН3СОСН3 — простейший кетон, бесцветная жидкость с характерным запахом, смешивается с водой и органическими растворителями. Образуется как продукт аномального расщепления углеводов у больных сахарным диабетом (ацетоновые тела). Ацетон находит широкое применение как растворитель лаков и красок, служит сырьем для синтеза уксусного ангидрида и кетена СН2=С=О.
Ацетофенон (метилфенилкетон) — C6H5COCH3 — бесцветная маслянистая жидкость, обладающая сильным запахом черёмухи. Хорошо растворяется в этаноле, диэтиловом эфире, ацетоне, хлороформе, бензоле. Ацетофенон и некоторые его производные используются как душистые вещества в парфюмерии. Кроме того, ацетофенон обладает снотворным действием. Его производное — хлорацетофенон — является слезоточивым веществом.
Циклогексанон — жидкость с раздражающим запахом (ацетон и мята), растворим в органических растворителях, ограниченно растворим в воде. Получают гидрированием фенола с последующим окислением или дегидрированием циклогексанола. Применяют для получения ɛ-капролактама и адипиновой кислоты, например:

Спектральная идентификация
ИК-спектроскопия. В ИК-спектрах альдегидов и кетонов имеется сильная полоса валентных колебаний группы С=О. У алифатических альдегидов максимум полосы поглощения находится около 1725 см-1, у кетонов 1715 см-1. Если карбонильная группа сопряжена с С = С или ароматической системой, максимум полосы поглощения смещается в низкочастотную область: у ароматических альдегидов — 1715-1695 см-1, у α,β-ненасышенных альдегидов — 1710-1685 см-1, у алкил-арилкетонов — около 1690 см-1, у диарилкетонов — около 1665 см-1, у α,β-ненасыщенных кетонов — ~1665 см-1. Для карбонильных групп хинонов характерна полоса поглощения при 1690—1660 см-1. Две полосы слабой интенсивности в области 2720-2690 и 2830-2810 см-1 соответствует валентным колебаниям связи С—Н альдегидов.
Спектроскопия ПМР. В спектрах ПМР альдегидов наиболее характеристичными являются сигналы протона альдегидной группы в интервале 9,4-10,4 м. д. (9,72 м. д. у ацетальдегида, 9,48 м. д. у акрилового альдегида, 9,96 м. д. у бензальдегида). Нахождение этого сигнала в столь слабом поле обусловлено магнитной анизотропией карбонильной группы. Внешнее магнитное поле Н0 индуцирует в π-электронной системе связи С=О циркуляцию электронов, которая в свою очередь создает области, где протоны подвергаются соответственно экранированию и дезэкранированию.
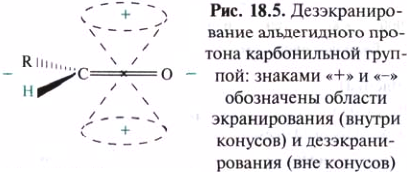
Карбонильная группа за счет индуктивного эффекта дезэкранирует протоны у α-атомов углерода альдегидов и кетонов. Сигналы метальных протонов групп, непосредственно связанных с карбонильной группой, наблюдаются в интервале от 1,9 до 2,2 м, д. (2,07 м. д. у ацетона, 1,93 м. д. у ацетальдегида). Метиленовые группы дают сигнал в более слабом поле, например, в спектре пропионового альдегида протоны метиленовой группы дают сигнал 2,40 м. д. В спектрах ПМР хинонов протоны кольца дают сигналы в области 6,7 м. д.
Электронная спектроскопия. Насыщенные и несопряженные альдегиды и кетоны имеют в УФ-спектре малоинтенсивную полосу поглощения 270—290 нм, обусловленную n→π*-переходом. Положение полосы n→π*-перехода зависит от растворителя; в полярных растворителях максимум поглощения смещается в коротковолновую область. Водородные связи, образуемые протонными растворителями (вода, спирты) с альдегидами и кетонами, понижают энергию несвязывающих электронов карбонильного атома кислорода. На возбуждение таких электронов требуется большая энергия, а значит, более жесткое излучение, с меньшей длиной волны. При подкислении растворов альдегидов и кетонов полоса n→π*-перехода сильно ослабевает или вообще исчезает. Интенсивная полоса поглощения, соответствующая π→π*-переходу, находится в области 180—195 нм и обычными спектрофотометрами не фиксируется.
В сопряженных карбонильных соединениях происходит смещение максимумов поглощения обеих полос в более длинноволновую область. В электронных спектрах хинонов наиболее важная полоса имеет максимум при 400—500 нм и соответствует n→π* -синглет-синглетному переходу.
