
- •Специальные разделы курса
- •Моносахариды: образование простых и сложных эфиров, отношение эфиров к гидролизу; гликозидов (на примере d–маннозы); строение гликозидов, o–,n–,s–гликозиды, отношение гликозидов к гидролизу.
- •Моносахариды: окисление в гликоновые, гликаровые и гликуроновые кислоты; представители – d–глюконовая, d–глюкуроновая, d–галактуроновая кислоты; аскорбиновая кислота (витамин с).
- •Моносахариды: восстановление в полиолы; представители: d–сорбит, ксилит; открытая и циклические формы моносахаридов (на примере d–фруктозы и d–ксилозы).
- •Олигосахариды: принцип строения невосстанавливающих дисахаридов; сахароза; номенклатура; отношение к гидролизу, окислению катионами серебра (I) и меди (II).
- •Полисахариды: классификация; принцип строения гомополисахаридов на примере крахмала (амилоза, амилопектин), тип гликозидной связи; отношение крахмала к гидролизу.
- •Полисахариды: классификация; принцип строения на примерах декстранов, инулина, пектиновых веществ, типы гликозидной связи.
- •Полисахариды: строение целлюлозы; простые и сложные эфиры целлюлозы – ацетаты, нитраты, метил–, карбоксиметил– и диэтиламиноэтилцеллюлоза.
- •Производные пятичленных азотсодержащих ароматических гетероциклов: пиразолон и его таутомерия, лекарственные средства на основе пиразолона–3; гистидин, гистамин, бензимидазол, дибазол.
- •Шестичленные кислородсодержащие гетероциклы с одним гетероатомом: бензопироны – хромон, кумарин, флавон; флавоноиды – лютеолин, кверцетин; цианидиновая проба; катехины (вопр. 18).
- •Шестичленные гетероциклы с двумя гетероатомами: гидрокси– и аминопроизводные пиримидина (урацил, тимин, цитодин) – электронное строение, лактим–лактамная таутомерия.
- •Шестичленные гетероциклы с двумя гетероатомами: барбитуровая кислота – синтез, виды таутомерии, кислотные свойства; производные барбитуровой кислоты – барбитал, фенобарбитал.
- •Конденсированные гетероциклы: электронное строение, кислотно–основные свойства, таутомерия пурина; гидрокси– и аминопроизводные пурина – гипоксантин, ксантин, их таутомерия.
- •Конденсированные гетероциклы: мочевая кислота, ее электронное строение, лактим–лактамная таутомерия, кислотные свойства; соли мочевой кислоты (ураты); мурексидная проба.
- •Конденсированные гетероциклы: пурин – строение, ароматичность; производные пурина – аденин, гуанин, их таутомерия (вопр. 22).
- •Нуклеозиды: строение, классификация, номенклатура; отношение к гидролизу.
- •Нуклеотиды: строение, номенклатура, отношение к гидролизу.
- •Нуклеотидные коферменты: атф–строение, отношение к гидролизу.
- •Нуклеиновые кислоты: рнк и днк, первичная структура.
- •Алкалоиды: химическая классификация; основные свойства, образование солей. Представители: хинин, никотин, атропин.
- •Алкалоиды: метилированные ксантины (кофеин, теофиллин, теобромин); кислотно-основные свойства; их качественные реакции.
- •Алкалоиды: группа пиридина (никотин, анабазин) – строение, реакционная способность, общие реакции алкалоидов.
- •Алкалоиды: группа хинолина (хинин) – строение, талейохинная проба, основные свойства, образование солей.
- •Алкалоиды: группа изохинолина и фенантренизохинолина (папаверин, морфин, кодеин) – строение, основные свойства, характеристика реакционной способности.
- •Алкалоиды: группа тропана (атропин, кокаин) – строение, основные свойства, характеристика реакционной способности.
- •Липиды: триацилглицерины – принцип строения, номенклатура, реакционная способность (гидролиз, гидрогенизация, окисление), аналитические характеристики (иодное число, число омыления).
- •Липиды: фосфатидная кислота – строение; фосфолипиды (фосфатидилколамины, фосфатидилхолины) – состав, строение, гидролиз.
- •Терпены и терпеноиды: состав, химическое и пространственное строение производных ментана (ментол, терпин), их реакционная способность.
- •Терпены и терпеноиды: состав и строение бициклических монотерпенов (-пинен, борнеол, камфора), их реакционная способность.
- •Терпены и терпеноиды: классификация по числу изопреновых звеньев; дитерпены и тетратерпены (ретинол, ретиналь, β–каротин) – строение, реакционная способность.
- •Стероиды: родоначальные углеводороды (эстран, андростан, прегнан, холан, холестан); стереоизомерия, цис–транссочленение циклогексановых колец, –,β–стереохимические ряды.
- •Стероиды: производные холестана (стерины) – холестерин, эргостерин, витамин d2: номенклатура, строение, характеристика реакционной способности.
- •Производные холана (желчные кислоты): холевая и дезоксихолевая кислоты; гликохолевая и таурохолевая кислоты; их дифильный характер; строение, номенклатура, реакционная способность.
- •Производные прегнана (кортикостероиды): дезоксикортикостерон, гидрокортизон, преднизолон; строение, номенклатура, характеристика реакционной способности.
- •Производные эстрана (эстрогенные гормоны): эстрон, эстрадиол, эстриол; строение, номенклатура, характеристика реакционной способности.
- •Производные андростана (андрогенные гормоны): тестостерон, андростерон; строение, номенклатура, характеристика реакционной способности.
- •Агликоны сердечных гликозидов: дигитоксигенин, строфантидин; общий принцип строения и реакционная способность сердечных гликозидов.
-
Полисахариды: классификация; принцип строения на примерах декстранов, инулина, пектиновых веществ, типы гликозидной связи.
Декстраны — (С6Н10О5)n — полисахариды бактериального происхождения, построены из α,D-глюкопиранозы. Их макромолекулы сильно разветвлены. Основным типом связи является α(16), а в местах разветвлений — α(14), α(13) и реже α(12)-гликозидные связи.
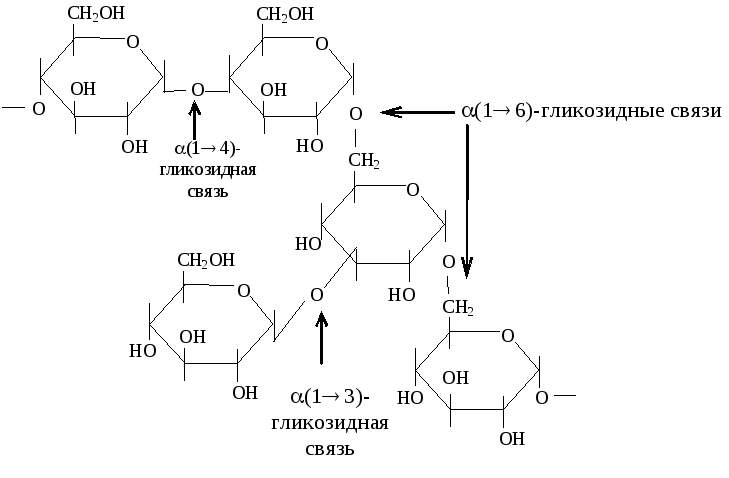
Декстран имеет молекулярную массу порядка 300 000–400 000 и используется для изготовления сефадексов, применяемых в гельфильтрации. Частично гидролизованный декстран с молекулярной массой 60 000–90 000 в изотоническом растворе NаСI (0,85 %) использовался ранее в качестве плазмозамещающих растворов. В настоящее время для этой цели применяются средства, изготовленные на основе модифицированного крахмала.
Пектины. Пектинами, или пектиновыми веществами, называют растительные гетерополисахариды, главным моносахаридным компонентом которых является D-галактуроновая кислота. В основе пектинов лежит пектовая кислота, которую долгое время считали гомополисахаридом, состоящим из α(1→4)- связанных остатков D-галактуроновой кислоты, как показано ниже. В действительности в цепи содержится некоторое, иногда значительное, количество остатков L-рамнозы, которые могут иметь боковые углеводные цепи.
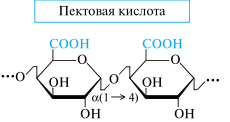
В пектинах содержится также пектиновая кислота, представляющая собой метиловый эфир пектовой кислоты различной степени этерификации (до 50%).
Растворимые пектины содержатся в соке растений, нерастворимые — в мякоти плодов. Практически ценным свойством пектинов является их способность образовывать гели вследствие межмолекулярной ассоциации отдельных цепей. Благодаря этому свойству пектины используются в пищевой промышленности для приготовления джемов, желе (мармелада), фруктовых консервов и т. д. В фармации они представляют интерес как вспомогательные вещества для создания детских лекарственных форм. Основное сырье для получения пектинов в промышленности — лимонная корка (до 40% пектинов), жом яблок и сахарной свеклы.
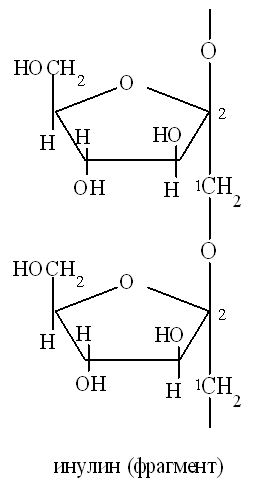
Инулин, (C6H10O5)n — органическое вещество из группы полисахаридов, полимер D-фруктозы. Имеет сладкий вкус. При гидролизе под действием кислот и фермента инулазы образует D-фруктозу и небольшое количество глюкозы. Инулин, как и промежуточные продукты его ферментативного расщепления — инулиды, не обладает восстанавливающими свойствами. Молекула инулина — цепочка из 30—35 остатков фруктозы в фуранозной форме.
-
Полисахариды: строение целлюлозы; простые и сложные эфиры целлюлозы – ацетаты, нитраты, метил–, карбоксиметил– и диэтиламиноэтилцеллюлоза.
Целлюлоза или клетчатка представляет собой линейный гомополисахарид, состоящий из остатков β,D-глюкопиранозы, соединенных между собой β(14)-гликозидными связями.
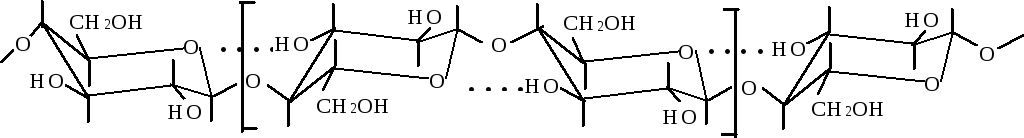
Структурным повторяющимся фрагментом в целлюлозе является биозный фрагмент — целлобиоза. В этом фрагменте второй моносахаридный остаток β,D-глюкопиранозы повернут на 180º по отношению к предыдущему. Это позволяет целлюлозе иметь линейную структуру, дополнительно стабилизированную водородными связями. Водородные связи могут образовываться между кислородным атомом пиранозного цикла и спиртовым гидроксилом 3-го углеродного атома следующего цикла, а также между соседними цепями. Такая упаковка цепей обеспечивает высокую механическую прочность, волокнистость, нерастворимость в воде и химическую инертность, позволяющие целлюлозе формировать клеточную стенку растений.
Клетчатка является субстратом для бактерий желудочно-кишечного тракта, синтезирующих витамины группы В, способствует адсорбции токсических веществ в толстом кишечнике и их выведению, что снижает риск развития злокачественных новообразований толстого кишечника.
Простые эфиры.
Широкое применение находят также производные целлюлозы. Химическая модификация целлюлозы сводится главным образом к ее превращению в простые и сложные эфиры. Получение простых эфиров напоминает синтез Вильямсона, в котором алкилированию подвергается так называемая «щелочная целлюлоза» — кристаллический комплекс целлюлозы, щелочи и воды. Этот комплекс образуется при действии концентрированных водных растворов щелочей на целлюлозу и записывается условно как алкоголят. Стехиометрический состав комплекса зависит от температуры и концентрации щелочи.
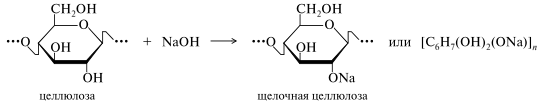
В реакциях алкилирования, проводимых в щелочной среде (т. е. фактически со щелочной целлюлозой), наиболее активен гидроксил при С-2, наименее — при С-3. В кислой среде самым реакционноспособным является гидроксил при С-6 как стерически более доступный.
Метилцеллюлоза. Этот простой эфир может быть записан в виде [СбH7(OH)3-х(OCHз)х]n, где x — степень замещения, т. е. число метильных групп, приходящихся на одно звено. Наибольшее применение находят эфиры со степенью замещения 1,5-2 и молекулярной массой до 250-300 тыс., которые могут быть изображены следующей усредненной структурой (для степени замещения 1,5):
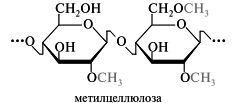
Метилцеллюлоза — бесцветное аморфное вещество, растворимое в холодной воде, глицерине и нерастворимое в большинстве органических растворителей. При температуре выше 55 °С водный раствор превращается в гель, который при охлаждении разрушается. Растворы метилцеллюлозы обладают поверхностно-активными свойствами. При высыхании растворов образуются прочные пленки. Метилцеллюлоза находит широкое применение как загуститель, эмульгатор и стабилизатор различных материалов, включая фармацевтические составы. Ее используют при изготовлении суспензий, эмульсий и гидрофобных основ мазей и линиментов.
Карбоксиметилцеллюлоза. От метилцеллюлозы этот простой эфир, сокращенно обозначаемый КМЦ, отличается наличием карбоксильной группы в метильном заместителе: [С6Н7(OН)3-х(OСН2СOOН)х]n, где x = 0,1-1,5. Получается он действием хлороуксусной кислоты или ее натриевой соли на щелочную целлюлозу, например:
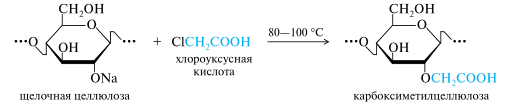
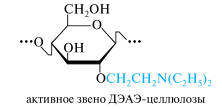
КМЦ не растворяется в воде, а ее натриевая соль (по карбоксильной группе) хорошо растворима с образованием прозрачных вязких растворов. Натрий-КМЦ применяется в аналогичных целях, что и метилцеллюлоза. КМЦ с низкой степенью замещения (x = 0,1-0,2) нашла применение в качестве катионита благодаря способности обменивать протон карбоксильной группы на другие катионы. Как ионит, обменивающий анионы, используется другой простой эфир — диэтиламиноэтилцеллюлоза (сокращенно — ДЭАЭ-целлюлоза).
Сложные эфиры целлюлозы.
Среди сложных эфиров целлюлозы наиболее значимыми являются ацетаты [С6Н7(ОН)3-х(OAc)х]n и нитраты [С6Н7(ОН)3-х(ONО2)х]n.
Ацетаты целлюлозы были одним из первых синтетических материалов, используемых для получения искусственных волокон, например ацетатного шелка. Для этого пригодны высокозамещенные полимеры — триацетат (реальная степень замещения 2,8—2,9) и продукт его частичного гидролиза (x = 2,4—2,5), называемый вторичным ацетатом. Триацетат целлюлозы получают действием избытка ацилирующего агента (обычно уксусного ангидрида в присутствии кислотного катализатора):

Ацетаты целлюлозы применяются в производстве текстильных материалов, кино- и фотопленок, лаков, сигаретных фильтров, различных мембран. Они находят применение и в изготовлении готовых лекарственных форм.
Нитраты целлюлозы получают действием избытка смеси концентрированных азотной и серной кислот на хлопковую целлюлозу. Степень замещения х в общей формуле зависит в основном от соотношения кислот и остаточного количества воды в нитрующей смеси.
Продукт частичного замещения (х = 1,8-2,1), известный как коллоксилин, используется в производстве пластмасс, целлулоида, нитроэмалей и нитролаков. Почти полностью замещенная целлюлоза (х = 2,8), называемая пироксилином, относится к взрывчатым веществам и применяется при изготовлении бездымного пороха.
-
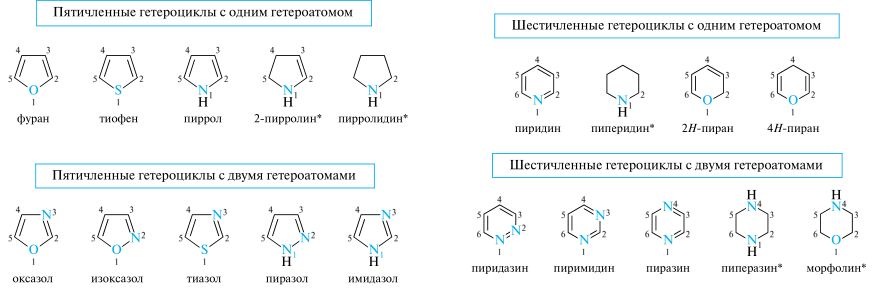
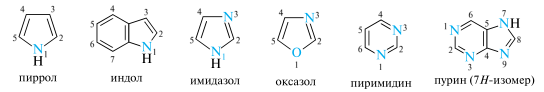
Гетероциклы: классификация; основы систематической номенклатуры; электронное строение ароматических пяти–, шестичленных и конденсированных гетероциклов. Представители: пиррол, индол, имидазол, оксазол, пиримидин, пурин.
Для их классификации используют следующие признаки:
-
По размеру цикла гетероциклические соединения чаще всего трех-, четырех-, пяти-, шести- и семичленные.
-
По типу элемента, входящего в состав цикла, это соединения с атомами азота, кислорода или серы.
-
По числу гетероатомов, входящих в цикл, наиболее распространены гетероциклы с одним и двумя гетероатомами, но известны соединения и с четырьмя атомами в одном цикле.
-
По природе и взаимному расположению нескольких гетероатомов возможны разнообразные комбинации (N и S, N и О и т. д.), причем гетероатомы могут занимать различные положения относительно друг друга.
-
По степени насыщенности гетероциклы могут быть ароматическими, ненасыщенными и насыщенными:
Химия ароматических гетероциклов изучена наиболее подробно. Полностью или частично насыщенные гетероциклы в силу особенностей их химических свойств рассматриваются, как правило, не как гетероциклические соединения, а как циклические аналоги тех или иных алифатических соединений (простые эфиры, сульфиды, вторичные амины).
-
По числу циклов различают моноциклические, полициклические (главным образом, конденсированные) системы. Число циклов и их типы могут быть самыми различными.
Главную сложность в номенклатуре гетероциклических соединений представляет огромное разнообразие гетероциклических структурных типов. Для многих гетероциклов в номенклатуре ИЮПАК разрешается применять тривиальные и полутривиальные названия.
Правила ИЮПАК не регламентируют положение гетероатома при написании формул гетероциклов, но традиционно гетероатом (или гетероатомы) располагают в нижней части цикла. Нумерация атомов в моноциклических соединениях всегда начинается от гетероатома. Если гетероцикл содержит различные гетероатомы (чаще всего это — азот, кислород и сера), то соблюдают следующий порядок падения старшинства атомов: О > S > N. Затем нумерацию продолжают так, чтобы другой гетероатом получил наименьший локант. При наличии в молекуле неравноценных атомов азота (=N— и —NH—) нумерация начинается от более насыщенного.
В систематической номенклатуре моноциклических соединений, содержащих один или несколько гетероатомов в цикле, используется метод Ганча-Видмана. Согласно этому методу, название гетероцикла образуют путем сочетания соответствующего префикса: окса- для атома кислорода, тиа- для атома серы, аза- для атома азота — с корнями, отражающими размер цикла (число атомов в цикле) и степень его насыщенности. Для удобства произношения буква «а» в префиксах часто опускается, поскольку корень начинается обычно с гласной буквы.
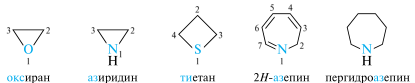
В приведенном выше названии азепина символ «Н» («обозначенный водород») применяется для уточнения положения двойных связей в системах с максимальным числом некумулированных двойных связей. Локант «обозначенного водорода» показывает, что «лишний» атом водорода находится в положении 2. Наличие нескольких одинаковый гетероатомов обозначается префиксами ди-, три- и т. д. Локанты гетероатомов указываются перед префиксом через дефис.
Названия одновалентный радикалов гетероциклических соединений обыгано получают путем добавления суффикса -ил к тривиалыному или систематическому названию исходного соединения.
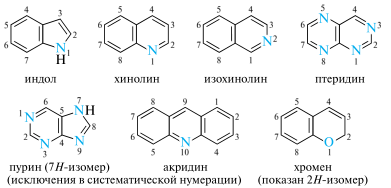
Номенклатура конденсированных гетероциклических систем. Тривиальные названия.
В номенклатуре ИЮПАК разрешено использование тривиальных названий многих конденсированных гетероциклических систем.
Систематическая номенклатура.
В простейших случаях, когда в бициклической системе гетероцикл конденсируется с бензольным кольцом (что встречается довольно часто), к названию гетероцикла добавляется префикс бензо- (или бенз-, если далее следует гласная буква). Когда возможны различные способы сочленения колец, цифрами перед объединенным названием указывают положение гетероатомов по отношению к бензольному кольцу. Локанты гетероатомов должны быть при этом наименьшими.
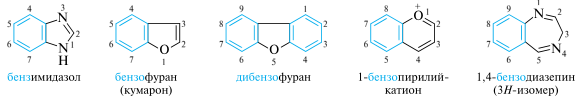
В общем случае для составления названия конденсированных систем необходимо указывать компоненты системы и места сочленения в каждом компоненте. Предварительно определяют, какой компонент считать основным. За основной компонент всегда принимается гетероцикл или конденсированная гетероциклическая система, имеющая тривиальное название.
Нумерация конденсированных систем. Поскольку существуют определенные правила нумерации конденсированных систем, то важно прежде всего правильно сориентировать молекулу. В полициклических системах отдельные циклы должны изображаться с двумя вертикальными сторонами. Любую полициклическую систему ориентируют так, чтобы соблюдались следующие условия:
• наибольшее число колец находилось в горизонтальном ряду;
• остальные кольца должны находиться выше или правее горизонтального ряда (в верхнем правом секторе);
• при наличии гетероцикла система должна быть ориентирована так, чтобы гетероатом (или гетероатомы) получили наименьшие локанты.
Нумерацию начинают с правого (или верхнего) цикла от первого атома, не участвующего в сочленении с другими циклами, и ведут ее по часовой стрелке по периметру молекулы. Узловые атомы углерода самостоятельно не нумеруются, а получают номер предыдущего атома с добавлением прямых латинских букв а, Ь, с и т. д. Однако если имеются узловые гетероатомы, то они нумеруются очередными цифрами.
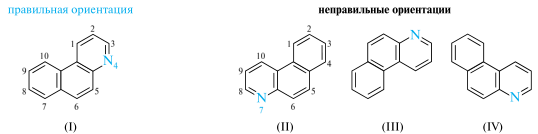
Выбор основного компонента. В случае возможности образования ряда названий конденсированной системы основной компонент (ниже в примерах выделен цветом) выбирают в следующем порядке.
-
Компонент, содержащий азот.
-
Компонент, содержащий иные, чем азот, гетероатомы в порядке старшинства гетероатомов.
-
Компонент, содержащий наибольшее число циклов.
-
Компонент, содержащий наибольший из циклов.
-
Компонент, содержащий наибольшее число различных гетероатомов.
Шестичленные гетероциклы с одним гетероатомом. Группа пиридина.
Пиридин является наиболее ярко выраженным представителем ароматических гетероциклов. По строению он аналогичен бензолу, только вместо одного звена —СН= содержит в кольце звено —N=. Согласно методу валентных схем, он представляет собой резонансный гибрид нескольких предельных структур, основной вклад в который вносят структуры, подобные бензолу по Кекуле.
![]()

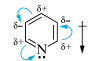
Все атомы углерода и атом азота находятся в состоянии sp2-гибридизации, и все σ-связи (С—С и С—N) лежат в одной плоскости. У атома азота из трех его гибридных орбиталей две образуют σ-связи с атомами углерода, а третья содержит неподеленную пару электронов. На негибридной р-орбитали, расположенной перпендикулярно плоскости σ-скелета, находится один электрон, благодаря которому атом азота участвует в образовании единого электронного облака с р-орбиталями пяти атомов углерода. Атом азота с такой электронной конфигурацией называют пиридиновым.
Таким образом, молекула пиридина отвечает критериям ароматичности, сформулированным для ароматических углеводородов, а именно имеет плоский σ-скелет, сопряженную замкнутую электронную систему, охватывающую все атомы цикла и содержащую шесть π-электронов, удовлетворяя формуле Хюккеля (4п + 2 при п = 1). В этом отношении пиридин изоэлектронен бензолу.
В то же время имеет ряд отличий от бензола. Во-первых, его молекула не представляет собой правильный шестиугольник, так как связь С—N короче связей С—С и, как следствие, валентные углы отличаются. Во-вторых, пиридин обладает значительным дипольным моментом.
Пиридин и другие гетероциклы, содержащие атом азота пиридинового типа (хинолины, диазины), называют π-дефицитными, или π-недостаточными, системами. Их отнесение к π-дефицитным сделано на основе электроноакцепторных свойств гетероатома, что приводит к дефициту электронов на атомах углерода. Важной особенностью π-электронного распределения в пиридине является чередование частичных зарядов в кольце: атомы С-2 и С-6 (называемые также α-положениями), а также С-4 (γ-положение) имеют частичный положительный заряд, т. е. они наиболее электронодефицитны, тогда как атомы С-3 и С-5 (β-положения) заряжены слегка отрицательно.
Пятичленные гетероциклы с одним гетероатомом.
К ним относится пиррол, фуран и тиофен — представляют собой плоские пятиугольники с четырьмя атомами углерода и соответствующим гетероатомом — азотом, кислородом или серой — в состоянии sp2-гибридизации.

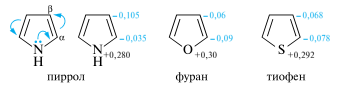
Пиррол, как и пиридин, содержит sр2-гибридизованный атом азота, но в иной конфигурации. На негибридной р-орбитали находится пара электронов, а гибридные орбитали содержат по одному электрону. Две гибридные орбитали образуют связи с атомами углерода, а третья участвует в образовании σ-связи с атомом водорода. Атом азота с рассмотренной конфигурацией называют пирольным. Пять негибридных орбиталей, перекрываясь, образуют единое шестиэлектронное облако, и пиррол, таким образом, удовлетворяет структурным критериям ароматичности.
В фуране и тиофене неподеленная пара электронов соответственно атомов кислорода и серы, находящаяся на негибридной р-орбитали, как и у пиррольного атома азота, включается в сопряжение с р-электронами атомов углерода с образованием ароматического секстета.
По своему электронному строению пиррол, фуран и тиофен изоэлектронны циклопентадиенид-иону, но в отличие от него молекулы гетероциклов не представляют собой правильные пятиугольники. Пиррол, фуран и тиофен относятся к π-избыточным гетероциклам, так как в них число электронов, образующих ароматическую систему, превышает общее число атомов в цикле (соотношение равно 6:5).
Конденсированные системы.
Хинолин и изохинолин представляют собой изомерные конденсированные системы пиридина и бензола, различающиеся способом сочленения колец. Этим гетероциклам родственна конденсированная система пиридина и двух бензольных колец, называемая акридином. Ряд синтетических производных всех трех гетероциклов применяется как лекарственные средства и красители. К природным производным хинолина и изохинолина относятся некоторые алкалоиды.
Хинолин и изохинолин, сочетающие в себе два ароматических цикла, также являются ароматическими системами: они удовлетворяют правилу Хюккеля (десять π-электронов в едином сопряжении) и остальным структурным критериям ароматичности. Будучи изоэлектронными нафталину, оба гетероцикла сочетают в себе химические свойства пиридина и нафталина. Эти свойства хинолина и изохинолина во многом сходны и поэтому рассматриваются в основном на примере хинолина как более распространенного гетероцикла.
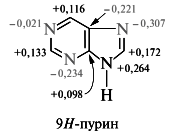
Молекула пурина представляет собой конденсированную систему пиримидина и имидазола. По всем критериям пурин относится к ароматическим соединениям. Его сопряженная система включает 10 р-электронов — по одному от атомов углерода и трех атомов азота пиридинового типа (N-1, N-3 и N-7 или N-9, в зависимости от таутомерной формы) и два электрона атома азота пиррольного типа. Молекула пурина в целом представляет собой высоко π-недостаточную систему, хотя имидазольное кольцо обладает небольшой π-избыточностью:

Представители.
Пиррол - наибольшее распространение в растительном и животном мире имеют производные пиррола, являющиеся структурными фрагментами гема и хлорофиллов, пигментов желчи, ряда антибиотиков и алкалоидов. Пиррол умеренно токсичен, его пары вызывают стойкое и упорное повышение температуры тела.
Индол служит исходным сырьём для синтеза гетероауксина, триптофана, используется в парфюмерной и фармацевтической промышленности. Многие алкалоиды содержат ядро индола.
Имидазол — структурный фрагмент витамина В12, некоторый алкалоидов, белковой аминокислоты гистидина и ее метаболита — биогенного амина гистамина, а также некоторый лекарственный средств. Вместе с шестичленным гетероциклом пиримидином он образует конденсированную гетероциклическую систему пурина.
Оксазол используется в фотографии, как флуоресцентный отбеливатель, антиоксидант. Многие оксазолы входят в состав ЛС, обладающих анальгезирующим, жаропонижающим, антибиотическим действием.
Пиримидин. Ядро пиримидина входит в состав нуклеиновых кислот, витаминов (B1), антибиотиков (амицетин, блеомицин), ЛС (барбитураты, пиримидиновые сульфамиды), сильных ядов, коэнзимов и др.
Пурин. Производные, содержащие систему пурина, широко распространены в природе и играют большую роль во многих биологических. биол. процессах. Важнейшие производные пурина - аденин, гуанин (пуриновые основания), гипоксантин, кофеин (пуриновые алкалоиды), мочевая кислота.
Ядро пурина входит в состав некоторых антибиотиков и нуклеотидов, являющихся структурными фрагментами нуклеиновых кислот. Пурин и ряд его производных обладают противоопухолевой, противовирусной и противоаллергической активностью.
-
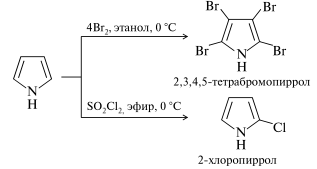
Пятичленные гетероциклы с одним гетероатомом: электронное строение, ацидофобность; кислотно–основные свойства пиррола; реакции электрофильного замещения, ориентация замещения, особенности нитрования, сульфирования, бромирования ацидофобных гетероциклов. Представители: пиррол, тиофен, фуран, пирролидин, тетрагидрофуран.
Поскольку пиррол, фуран и тиофен имеют сходное электронное строение, в их химическом поведении имеется много общего.
Реакции электрофильного замещения.
Как π-избыточные соединения, эти гетероциклы легко вступают в реакции с электрофильными реагентами. В незамещенных гетероциклах электрофильная атака осуществляется преимущественно по атому C-2 (α-положение), так как в промежуточно образующемся катионе (σ-комплексе) резонансная стабилизация эффективнее, чем в катионе при атаке β-положения.
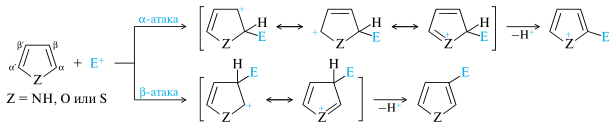
π-Избыточность пятичленных гетероциклов накладывает определенные ограничения на условия проведения реакций с электрофильными реагентами, которые обычно осуществляются в кислой среде. В результате они подвергаются полимеризации, а в водных средах происходит разрыв гетероцикла. (!) Свойство соединений подвергаться глубоким превращениям под действием кислот называют ацидофобностью, а сами гетероциклы — ацидофобными. Тиофен устойчив к действию сильных кислот и не относится к ацидофобным гетероциклам.
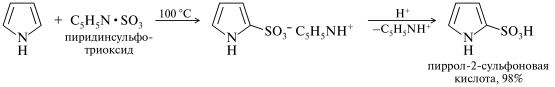
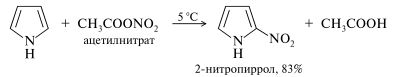
Многие реакции электрофильного замещения для пиррола и фурана требуют специальных условий, исключающих воздействие сильных кислот. Так, для сульфирования используется пиридинсульфотриоксид, часто обозначаемый С5Н5N•SO3. Бромирование осуществляют действием диоксандибромида С4н8О2•Вг2. В этом случае замещающийся протон связывается диоксаном, что предотвращает разрушающее действие сильных кислот. Для введения нитрогруппы в используют ацетилнитрат — смешанный ангидрид уксусной и азотной кислот.
Замещенные пятичленные гетероциклы также вступают в реакции электрофильного замещения, и влияние заместителей на легкость замещения принципиально не отличается от аналогичных реакций карбоциклических соединений, т. е. электронодонорные заместители облегчают реакцию, а электроноакцепторные — замедляют ее.

Сульфирование. Пиррол избирательно сульфируется пиридинсульфотриоксидом в α-положение, а если оба α-положения заняты, то атакуется β-атом углерода.
Нитрование. При низких температурах пиррол очень легко нитруется ацетилнитратом.
Галогенирование. Пиррол настолько легко подвергается галогенированию, что без соблюдения специальный условий образуются стабильные тетразамещенные продукты.
Кислотные и основные свойства
Пиррол является слабой NH-кислотой и образует соли только со щелочными металлами или с такими сильными основаниями, как гидриды или амиды щелочных металлов, а также при сплавлении с твердым гидроксидом калия (но не натрия). Образующиеся соли легко гидролизуются водой.
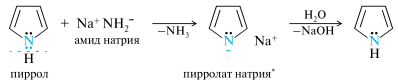
Основность пиррола чрезвычайно низка, и значение рКBH+ характеризует основность π-системы гетероцикла, а не атома азота.
Представители.
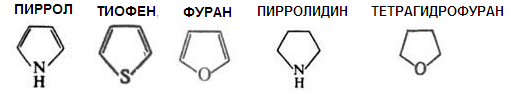
Тиофен. Соединения ряда тиофена — это реагенты для разделения элементов, оптические отбеливатели, физиологически активные соединения. Многие производные — ЛС (антигельминтный препарат комбантрин, модифицированные антибиотики цефалотин, цефалоридин), мономеры для получения электропроводящих полимеров.
Фуран применяют для получения ТГФ, тиофена, пиррола, селенофена и малеинового ангидрида, а также в качестве растворителя и экстрагента масел и жиров. Производные фурана используют как ЛС (фурадонин, фуросемид) и средства защиты растений.
Пирролидин обнаружен в табаке и моркови, пирролидиновая структура входит в состав некоторых алкалоидов (никотина) и аминокислот пролина и гидроксипролина. Пирролидиновая структура входит в состав ЛС (пирацетама).
Тетрагидрофуран — это растворитель многих соединений; сырье для получения синтетических смол. Это структурный фрагмент некоторых антибиотиков (нактинов, с помощью которых осуществляется транспорт ионов К+ через клеточные мембраны.
-
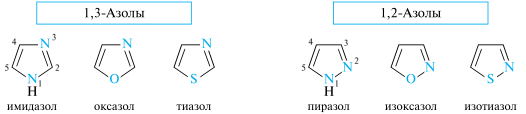
Пятичленные гетероциклы с двумя гетероатомами: электронное строение; кислотно–основные свойства, образование ассоциатов; реакции электрофильного замещения в пиразоле и имидазоле. Представители: пиразол, имидазол, тиазол, оксазол.
Группу пятичленныгх гетероциклов, которые формально образованы из пиррола, фурана и тиофена путем замены звена —CH= хотя бы одним пиридиновым атомом азота, называют азолами. Частный случай представляют циклы с двумя атомами азота — диазолы. Азолы, содержащие два гетероатома, в зависимости от их взаимного расположения подразделяются на 1,2-азолы и 1,3-азолы. Наиболее значимыми из них являются имидазол, пиразол и тиазол.

Ароматичность.
Азолы можно рассматривать как аза-аналоги пиррола, фурана и тиофена, в который звено — CH= (атом C-2 или C-3) заменено фрагментом — N=, т. е. пиридиновым атомом азота.
Азолы относятся к 6π-электронным ароматическим соединениям. Так, в пиразоле и имидазоле один из атомов азота (N-1) принадлежит к пиррольному типу, а другой — к пиридиновому. Пиррольный атом азота вносит в сопряженную систему два р-электрона, а пиридиновый — один р-электрон (пары электронов гетероатомов, участвующие в сопряжении, показаны цветом). В оксазоле и тиазоле атомы азота принадлежат к пиридиновому типу, а атомы кислорода и серы имеют конфигурацию, подобную пиррольному атому азота. Все четыре гетероцикла изоэлектронны и в сопряжении принимают участие по шесть электронов, т. е. они соответствуют правилу Хюккеля.
Кислотные и основные свойства.
Азолы обладают основностью благодаря пиридиновому атому азота. Имидазол сильнее пиридина.
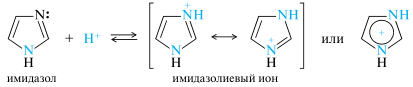
Остальные азолы значительно менее основны имидизола, вследствие сильного электроноакцепторного индуктивного влияния гетероатома в положении 1; особенно это заметно у 1,2-азолов.
Кислотные свойства присущи только диазолам — имидазолу и пиразолу, благодаря их NH-кислотному центру. Оба гетероцикла заметно превышают по кислотности пиррол. Причина этого заключается в лучшей делокализации отрицательного заряда в сопряженном основании с участием обоих атомов азота, как показано на примере имидазолат-иона:
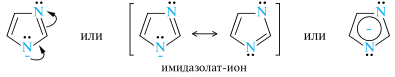
Имидазол и пиразол проявляют амфотерный характер. В кристаллическом состоянии и в неполярных растворителях они образуют межмолекулярные ассоциаты. Ассоциаты имидазола содержат до 20 молекул, а пиразол существует в виде димеров и тримеров:
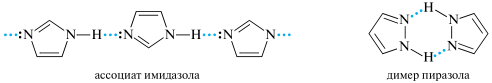
Неожиданно высокие температуры кипения диазолов по сравнению с оксазолом и тиазолом свидетельствуют о прочных межмолекулярных водородных связях. Диазолы, замещенные по атому N-1 (но не С-производные), не способны образовывать водородные связи и имеют значительно более низкие температуры кипения.
Реакции электрофильного замещения.
Реакционная способность азолов по отношению к электрофильным реагентам определяется π-балансом системы. Для этих гетероциклов общая π-избыточность или π-дефицитность зависит от того, какой из гетероатомов — пиррольного или пиридинового типа — оказывает большее влияние. Например, имидазол, пиразол и тиазол, для которых ниже показаны заряды на атомах цикла, относятся к слабо π-избыточным системам. В то же время оксазолу присуща незначительная π-дефицитность, вызванная электроотрицательностью атома кислорода.
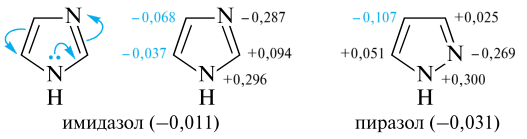
Реакционную способность молекулы будет определять общая (невысокая) π-избыточность. Из-за присутствия в цикле электроноакцепторного атома азота пиридинового типа азолы вступают в реакции электрофильного замещения намного труднее, чем их аналоги с одним гетероатомом (пиррол, фуран и тиофен), но легче, чем пиридин. Замещение в 1,3-азолах идет преимущественно по атому С-5, в 1,2-азолах — по атому С-4.
Имидазол.
Алкилирование и ацилирование по атому азота. При нагревании с алкилирующими агентами (алкилгалогенидами или алкилсульфатами) 1-алкилимидазолы получаются с невысоким выходом, так как побочно образуются имидазолиевые соли.
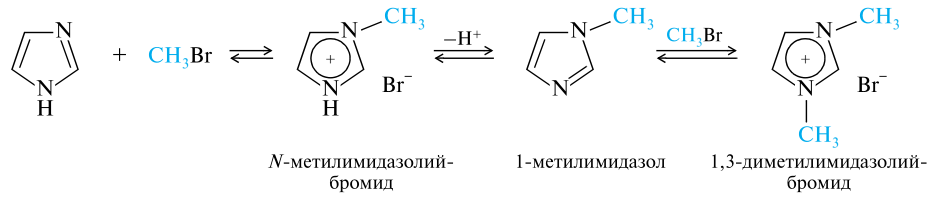
Действие на имидазол галогенангидридов или ангидридов кислот приводит к высокореакционноспособным N-ацильным производным.
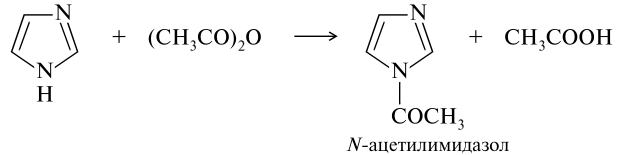
Восстановлением N-ацилимидазолов с высоким выходом могут быть получены альдегиды, а реакцией с магнийорганическими соединениями — кетоны:
Замещение по атомам углерода.
Нитрование и сульфирование.
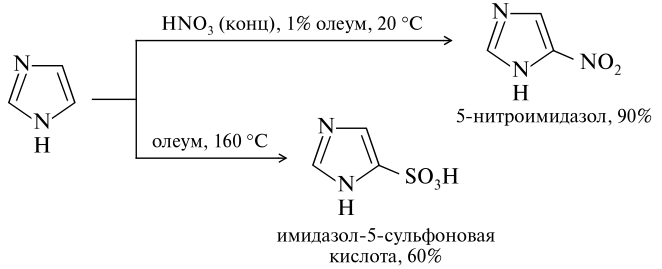
Со слабыми электрофилами в кислой среде реакции не идут вовсе. До сих пор неизвестны примеры реакций алкилирования и ацилирования имидазола по Фриделю-Крафтсу.
В щелочной среде имидазолы со свободной NH-группой и хотя бы одним незамещенным кольцевым атомом углерода вступают в реакцию азосочетания:

С диазотированной сульфаниловой кислотой, например, образуются продукты, окрашенные в цвета от желтого до красного, обнаружить которые можно в количестве микрограммов. Это — давно известный тест Паули на имидазолы (качественная реакция).
Галогенирование имидазола в нейтральной среде, когда молекула не ионизирована, очень легко.
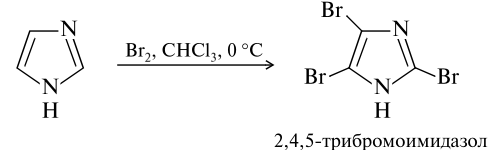
Пиразол.
Имеет много общего с имидазолом. Это касается как алкилирования и ацилирования по пиридиновому атому азота, так и электрофильного замещения. Отличие в реакциях электрофильного замещения заключается в направлении электрофильной атаки: в пиразоле она идет, как правило, по атому C-4, где π-электронная плотность максимальна. Если атом C-4 замещен, то электрофильная атака часто становится невозможной.
Подобно имидазолу, пиразол не алкилируется и не ацилируется по Фриделю-Крафтсу, но в отличие от имидазола он не вступает и в реакцию азосочетания.
Представители.
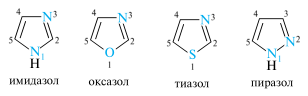
Пиразол и его производные в природе не обнаружены, но они используются в производстве лекарственных средств (анальгин, амидопирин, антипирин) и пестицидов.
Тиазол. Важнейшее соединение ряда тиазол — тиамин (Vit В1). Многие производные — лекарственные препараты (норсульфазол, фталазол). Тиазолидиновое кольцо — структурный фрагмент пенициллина и разнообразных полусинтетических пенициллинов.
