
- •Рабочая тетрадь
- •«Химия» для практических работ и самостоятельной работы студента
- •15.02.08 Технология машиностроения
- •1.3. Цели и задачи учебной дисциплины – требования к результатам освоения дисциплины:
- •Основные законы химии:
- •Основные теории химии:
- •Важнейшие вещества и материалы:
- •1. Аудиторная
- •2. Внеаудиторная.
- •Внеаудиторная самостоятельная работа студента:
- •Примерный порядок составления опорного конспекта
- •Практическое занятие № 1: «Химические элементы»
- •Практическое занятие № 2: «Химические формулы. Валентность»
- •Практическое занятие № 3: «Химические реакции»
- •Практическое занятие № 4: «Неорганические кислоты и их применение в машиностроении»
- •Практическое занятие № 5: «Соли и их применение в машиностроении»
- •Практическое занятие № 6: «Применение воды и растворов в машиностроении»
- •Практическое занятие № 7: «Реакции ионного обмена»
- •Молекулярные, полные ионные и сокращённые ионные уравнения реакций
- •Практическое занятие № 8: «Основания и их применение в машиностроении»
- •Практическое занятие № 9: «Оксиды»
- •Практическое занятие № 10: «Химия и специальность 15.02.08 Технология машиностроения»
- •Практическое занятие № 12: «Определение свойств химического элемента по его положению в Периодической системе»
- •Практическое занятие № 14: «Составление уравнений окислительно-восстановительных реакций»
- •Практическое занятие № 15: «Изомерия органических соединений»
- •Практическое занятие № 16: «Природные источники углеводородов. Экскурсия на азс»
- •Авиационные бензины
- •Дизельное топливо
- •Влияние на здоровье человека
- •Нормативные документы:
- •Расчёты:
- •Классификация углеводов
- •Патология углеводного обмена
- •Классификация липидов
- •Биологическое значение жиров для организма
- •Патология обмена жиров (липидов)
- •Особые механические свойства
- •Классификация
- •Оценка письменных работ обучающихся
- •Заключение
Практическое занятие № 2: «Химические формулы. Валентность»
Ответьте письменно на вопросы и задания. В конце работы сделайте вывод.
Что называется химической формулой? Что показывает химическая формула? Приведите пример.
Что обозначает индекс в химических формулах?
Напишите химические формулы веществ, если известно, что в состав их входят: а) атом железа и три атома хлора; б) два атома алюминия и три атома кислорода; в) атом кальция, атом углерода и три атома кислорода.
Вычислите относительные молекулярные массы данных веществ.
Вычислите массовые доли элементов в процентах по формулам:
1) CuSO4 – cульфат меди; 2) Fe2O3 – оксид железа; 3) НNO3 – азотная кислота.
Что означают записи: 4Н, 2Н2, НgО, 3Н2SO4?
Определите валентность элементов по формулам: НgО, К2S, В2О3, ZnO, МnО2, NiО, Сu2O, SnO2, Ni2O3, SO3, Аs2O5, Сl2O7 .
Cоставьте формулы оксидов: меди (I), железа (III), железа (II), углерода (IV), серы (VI), олова (IV), марганца (VII).
Вычислите относительные молекулярные массы: а) оксида железа (III), б) оксида фосфора (V), в) оксида марганца (VII).
Практическое занятие № 3: «Химические реакции»
Ответьте письменно на вопросы и задания. В конце работы сделайте вывод.
Придерживаясь последовательности /ранее изученной/, и учитывая валентность элементов, составьте уравнения реакций по следующим схемам:
2Аl + 3Cl2 →2AlCl3
Li + O2 →
Zn + Cl2 →
Н2 + O2 →
Напишите по два уравнения реакций каждого из известных вам типов и объясните их сущность с точки зрения атомно-молекулярного учения.
Даны металлы: кальций Ca, алюминий Аl, литий Li. Составьте уравнения химических реакций этих металлов с кислородом, хлором, серой, если известно, что сера в соединениях с металлами и водородом двухвалентна.
Перепишите приведённые ниже схемы уравнений реакций, вместо знаков вопроса напишите формулы соответствующих веществ, расставьте коэффициенты и поясните, к какому типу относится каждая из указанных реакций:
4.1. Zn + ? → ZnO
4.2. Аl(ОН)3 → Аl2О3 + ?
4.3 Мg + HCl → МgСl2 + ?
Fe + ? → FеCl3
Аu2O3 → Аu + ?
Аl +CuCl2 → Cu + ?
5. Кем, когда и как был открыт закон сохранения массы? Приведите формулировку закона и объясните его с точки зрения атомно-молекулярного учения.
03.11.2015
Практическое занятие № 4: «Неорганические кислоты и их применение в машиностроении»
Ответьте письменно на вопросы и задания. В конце работы сделайте вывод.
Какие вещества называются кислотами?
сложные вещества, которые состоят из атомов водорода, способных замещаться на атомы металлов и кислотных остатков.
Составьте структурные формулы следующих кислот: а) угольной; б) бромоводородной;
в) сернистой; г) хлорной НСlО4.
В соответствующих графах таблицы запишите химические формулы известных вам кислот, подчеркните кислотные остатки и отметьте их валентность:
|
К И С Л О Т Ы | ||||
|
кислород-содержащие |
бескислородные |
одноосновные |
двухосновные |
трёхосновные |
|
Серная Ортофосфорная
Угольная Кремниевая
|
Соляная
Иодоводородная
Сероводородная
|
соляная |
серная
|
ортофосфорная
|
В соответствующих графах запишите по три уравнения реакций, в которых участвуют и образуются кислоты:
|
Р Е А К Ц И И | |||
|
разложения |
соединения |
замещения |
обмена |
|
H2CO3 => CO2 + H2 O |
CO2 + H2 O= H2CO3 |
Cu+Hg(No3) = Hg+Cu(NO3) |
Cu(OH)2↓+H2SO4=CuSO4+2H2O |
|
H2SO4= SO3+H2O |
SO3+H2O= H2SO4 |
Zn+CuSO4 = Cu+ZnSO4 |
Cu(OH)2↓+2H+=Cu2++2H2O |
|
H2SO3=H2O+SO2 |
H2O+SO2= H2SO3 |
Fe+CuSO4 = Cu FeSO4 |
2Fe(OН)3 + 3Н2SO4 = =Fе2(SO4)3 + 6H2O |
5. Составьте конспект ответа о применении кислот в машиностроении.
По разнообразию применения серная кислота занимает первое место среди кислот. Большее ее количество расходуется для получения фосфорных и азотных удобрений. Много идет для очистки нефтепродуктов от вредных примесей. В машиностроении серной кислотой очищают поверхности металлов от оксидов перед хромированием, никелированием. Она применяется в производстве взрывчатых веществ, искусственных волокон, красителей, пластмасс. Её используют для заливки аккумуляторов, для производства других кислот и т. д. Поэтому серную кислоту называют хлебом химической промышленности.
2.
а)![]() —
угольная кислота
—
угольная кислота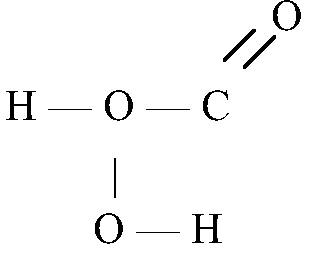 б)
б)![]() —
бромоводородная кислота
—
бромоводородная кислота![]()
в)![]() —
сернистая кислота
—
сернистая кислота![]() г)
г)![]() —
хлорная кислота
—
хлорная кислота![]()
Вывод: на этой практической работе я глубже узнал что такое кислоты и их обширное применения в машиностроении.
