
- •Содержание
- •Хронический лимфолейкоз………………………………………………………...78
- •Список сокращений
- •Лимфоциты и иммунокомпетентная система (морфология и физиология)
- •Лимфоциты в костном мозге
- •Лимфоциты и тимус
- •Лимфоциты в периферических лимфоидных органах
- •Костный мозг как периферический лимфоидный орган
- •Лимфоидная ткань слизистых (malt) и кожи
- •Иммунный ответ
- •Оценка больного с лимфаденопатией (увеличением лимфатических узлов)
- •Методика объективного исследования л/у
- •Инфекционный мононуклеоз
- •Гематологические заболевания, сопровождающиеся увеличением лимфоузлов злокачественные лимфомы
- •Болезнь Ходжкина (лимфогранулематоз, лимфома Ходжкина)
- •Хронический лимфолейкоз
- •Саркоидоз
- •Гистиоцитозы
- •Хронический лимфолейкоз
- •Злокачественные лимфомы
- •Задача № 1
- •I. В каких клетках костного мозга может быть обнаружена – Ph1 - хромосома?
- •I. Какие из нижеследующих проявлений болезни относятся к т. Н. ''общим симптомам'' лгм?
- •I. Какие исследования используются для диагностики им?
Лимфоциты и тимус
Незрелые предшественники Т-лимфоцитов из костного мозга с током крови поступают в тимус. Становление репертуара Т-лимфоцитов происходит в тимусе. В тимусе формируется набор специфичностей Т-лимфоцитов, участвующих в эффекторных реакциях в периферических лимфоидных тканях.
Тимус (вилочковая железа) является лимфоидно-эпителиальным органом. Основным структурным элементом тимуса является тимическая долька (рис. 3). Процессы внутритимической дифференцировки и селекции происходят в различных отделах дольки. В тимусе представлен широкий спектр лимфоидных и эпителиальных клеток: субкапсулярные тимические бласты, кортикальные тимоциты, медуллярные тимоциты, тельца Гассаля, дендритные клетки и т.д.
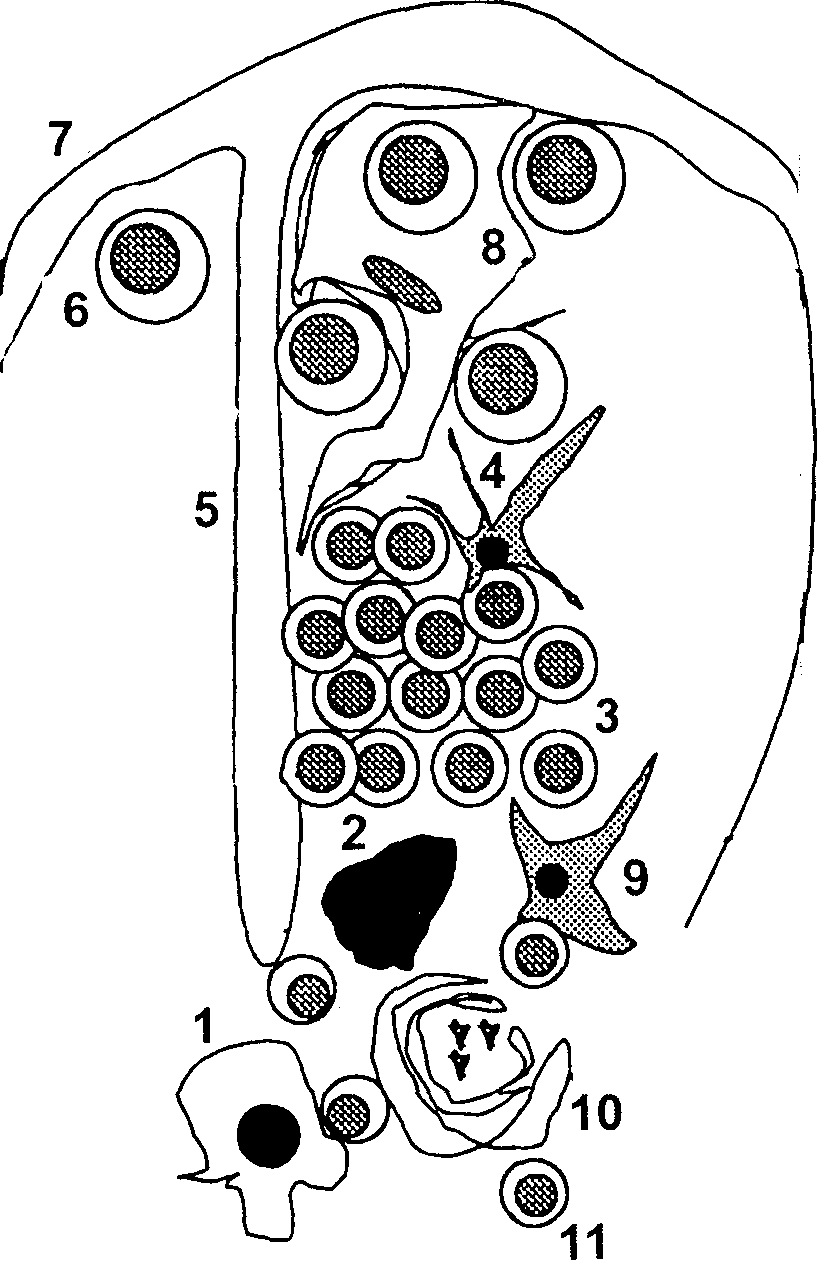
Рис. 3. Структура тимической дольки. 1 – медуллярные эпителиальные клетки; 2 – макрофаг; 3 – агрегаты кортикальных тимоцитов; 4 – кортикальная дендритная клетка; 5 – септа; 6 – лимфобласт; 7 – капсула; 8 – клетка-нянька; 9 – интердигитирующая клетка; 10 – тельце Гассаля; 11 – медуллярный тимоцит.
Тимоцитарная пролиферация предшествует экспрессии TCRαβ. При поступлении в тимус протимоциты становятся коммитированными по Т-клеточной линии и начинают экспрессировать CD3 в цитоплазме (cCD3) и TdT. Эти незрелые тимоциты являются крупными бластами и клетками среднего размера с высокими уровнями экспрессии TdT и самой большой пролиферативной активностью среди всех тимоцитов. На следующем этапе дифференцировки обычные (common) или кортикальные тимоциты являются cCD3+ TdT-. Они имеют средний уровень пролиферативной активности и отличаются по появлению цитоплазматической экспрессии TCRβ. В кортикальных тимоцитах только начинается перестройка α-генов и TCRαβ еще не экспрессирован. Клетки имеют на мембране CD4 и CD8, CD1+, CD2+. На поздних стадиях тимического развития зрелые (медуллярные) тимоциты экспрессируют либо CD4 либо CD8, мембранные CD3+ (mCD3+), CD2+, TCRαβ+; TdT и CD1 утрачиваются.
Таким образом, тимус является центральным органом иммунной системы, ответственным за образование пула наивных Т-лимфоцитов. Позитивно отобранные клетки в итоге покидают тимус и патрулируют тело в качестве длительно живущих покоящихся лимфоцитов. Их реактивация может произойти, как правило, только под влиянием чужеродных пептидов, представленных собственными молекулами HLA.
Лимфоциты в периферических лимфоидных органах
В периферических или вторичных лимфоидных органах происходит генерация эффекторных молекул (антител) и эффекторных клеток (Т- и В-лимфоцитов) в ходе первичного или вторичного контакта лимфоцитов с антигеном. Характерной особенностью периферических лимфоидных органов является четкое анатомическое разобщение Т- и В-клеточных зон. При этом В-клеточные зоны, в основном, выглядят как компактные шаровидные образования, носящие название фолликулов. Сказанное справедливо для лимфатических узлов, селезенки и лимфоидной ткани слизистых (MALT).
Рециркуляция лимфоцитов. Наивные лимфоциты поступают в периферические лимфоидные органы с током крови и возвращаются в циркуляторное русло уже в виде зрелых или эффекторных клеток для последующего распределения по лимфатической системе и селективного возвращения в место первичного контакта с антигеном (homing). Из селезенки лимфоциты возвращаются непосредственно в кровоток, из лимфатических узлов и лимфоидной системы слизистых – опосредованно через эфферентные лимфоидные сосуды и грудной проток. Поступление зрелых лимфоидных клеток в лимфатические узлы осуществляется также через афферентную лимфу от тех областей, которые дренирует данный лимфоузел. Лимфоидная система слизистых не окружена капсулой, и ее клетки могут непосредственно контактировать с антигеном и перемещаться в более компактные лимфоидные образования для генерации иммунного ответа.
Существуют некоторые общие правила миграции зрелых и наивных лимфоцитов в организме, которые зависят от структуры вторичных лимфоидных органов:
• Наивные клетки мигрируют в лимфатические узлы, в то время как клетки памяти находят свой «дом» предпочтительно в экстранодальных участках.
• Клетки памяти обычно возвращаются в тот участок тела, где они подверглись первичному контакту с антигеном.
• При воспалении поступление лимфоцитов в соответствующие органы и ткани усиливается, но снижается селективность хоминга.
Лимфатический узел является основным органом, формирующим иммунологический ответ при проникновении чужеродных веществ в организм через кожные и эпителиальные покровы, служит вторичным барьером на пути распространения инфекции после иммунной системы кожи и слизистых оболочек.
Структура
лимфатического узла (рис. 4) является
типичным примером разобщения Т- и
В-клеточных лимфоидных зон. Этот принцип
во многом характерен и для селезенки,
и л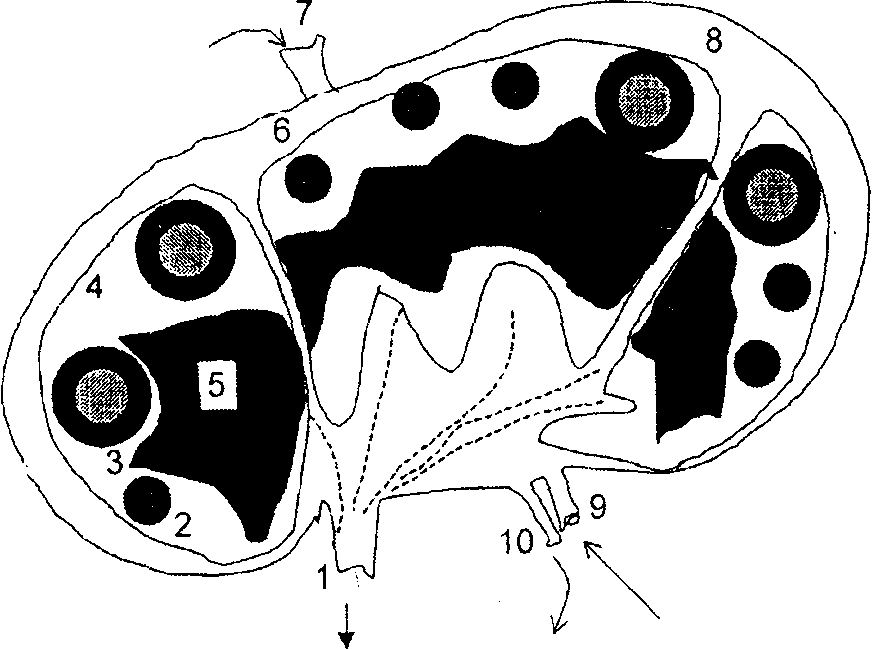 имфоидной
системы слизистых.
имфоидной
системы слизистых.
Рис. 4. Схематическое изображение лимфатического узла. 1 – эфферентный лимфатический сосуд; 2 – первичный фолликул; 3 – вторичный фолликул; 4 – корковая зона; 5 – паракортикальная зона; 6 – капсула; 7 – афферентный лимфатический сосуд; 8 – субкапсулярный синус; 9 – артерия; 10 – вена.
В-клетки лимфатического узла сгруппированы в компактные шаровидные образования (фолликулы), расположенные, в «покоящемся» лимфатическом узле, в основном, субкапсулярно. Совокупность этих В-клеточных образований расположена в так называемой кортикальной зоне. Т-клеточная (паракортикальная) зона находится под кортикальной зоной, то есть более удалена от капсулы лимфатического узла. Лимфоидная ткань лимфатического узла пронизана системой синусов, в которые лимфоциты прибывают с афферентной лимфой (субкапсулярный синус) и покидают узел (медуллярные синусы), поступая в эфферентные лимфатические сосуды. В лимфатическом узле представлены различные популяции фагоцитирующих (макрофаги, гистиоциты) и нефагоцитирующих (дендритные клетки) антиген-презентирующих клеток. Они весьма разнообразны и имеют тропность к Т-зонам (интердигитирующие клетки) или фолликулам лимфатического узла (фолликулярные дендритические клетки). При развитии иммунного ответа архитектоника лимфатического узла претерпевает существенные изменения.
Большинство лимфоцитов поступает в лимфатические узлы из крови через специализированный сосудистый эндотелий посткапиллярных венул (ВЭВ). Происходит это, главным образом, на границе кортикальной и паракортикальной областей. Другой путь поступления лимфоцитов в лимфатические узлы – через афферентные лимфатические сосуды.
Т-лимфоциты лимфатических узлов. Наивные, CD4+ Т-клетки, поступающие из тимуса, проникают в лимфатические узлы из крови через ВЭВ. В процессе иммунного ответа наивные Т-клетки (хелперные, цитотоксические) дают начало эффекторным клеткам и клеткам памяти. Активированные хелперные клетки могут дифференцироваться в ТН1-клетки, которые секретируют, главным образом, TNF и INFγ, или в ТН2-клетки, которые продуцируют, главным образом, IL-4, IL-5, 1L-6 и IL-10. ТН1-клетки за счет продукции INFγ и TNFβ являются хорошими индукторами повышения микробицидной активности макрофагов (повышенный клеточный иммунитет), эти клетки известны как клетки гиперчувствительности замедленного типа. ТН2-клетки экспрессируют CD40-лигaнд (CD40L), то есть структуру, с которой связывается CD40-рецептор, присутствующий на мембране В-лимфоцитов. Связывание CD40L и действие цитокинов, секретируемых ТН2-клетками, ведет к В-клеточной пролиферации, переключению классов и развитию В-клеток памяти. Секреция IL-10 и IL-4 ТН2-клетками противодействует влиянию INFγ на макрофаги. Эти отрицательные регуляторные воздействия могут быть важными в контроле аутологичного повреждения.
Т-лимфоциты функционально гетерогенны. Их активация приводит к Т-клеточно-опосредованным иммунным реакциям. В ходе этих реакций эффекторные Т-лимфоциты вырабатывают цитокины или осуществляют цитотоксическое действие. Эфферентные лимфоциты являются ответственными за становление иммунологической памяти и распределение иммунного ответа в другие лимфоидные органы. Т-клетки эфферентной лимфы являются преимущественно CD4+ в сравнении с CD8+, и это предполагает преимущественную рециркуляцию CD4+ клеток в ткань лимфатического узла.
Следующие типы иммунологических реакций опосредуются Т-клетками:
- гиперчувствительность замедленного типа (ТН1),
- отторжение аллотрансплантата (Тк),
- реакция трансплантат против хозяина (Тк, TН1),
- убийство инфицированных вирусами клеток-мишеней (Тк), - противоопухолевый иммунитет (Тк, ТН1).
В-лимфоциты лимфатических узлов. Первичные фолликулы и зона мантии вторичных фолликулов состоят из малых лимфоцитов, большинство из которых не имеет признаков активации. Чаще всего эти клетки имеют изотип IgM+lgD или IgM. Первичная активация В-клеток происходит в Т-клеточных областях периферических лимфоидных органов: паракортикальной зоне лимфатических узлов и лимфоидной ткани слизистых, периартериолярных лимфоидных муфтах селезенки. Последствия связывания иммуноглобулиновых рецепторов В-лимфоцитов с антигеном во многом зависят от свойств самого антигена. Некоторые антигены (так называемые тимуснезависимые) способны вызывать пролиферацию и дифференцировку В-клеток без помощи Т-лимфоцитов. Тимуснезависимые антигены первого типа являются поликлональными активаторами, а тимуснезависимые антигены второго типа – это, как правило, полисахариды с множеством регулярно повторяющихся одинаковых антигенных детерминант, способных перекрестно связывать мембранные IgM В-клеток и вызывать их активацию.
Активация В-клеток под действием тимусзависимых антигенов (чаще это белки, нуждающиеся в переработке – процессинге и комплексировании с молекулами HLA для эффективного распознавания Т-лимфоцитами) происходит при участии Т-хелперных клеток и дендритических клеток в паракортикальной зоне. В-лимфоциты взаимодействуют с CD4+ Т-хелперными клетками, активированными антигенными производными, представленными в комплексе с молекулами HLA-II на интердигитирующих клетках. Взаимодействие Т- и В-лимфоцитов осуществляется двумя способами – контактным (клетка-клетка) и с помощью цитокинов. В контактных взаимодействиях принимают участие со стороны В-клеток молекулы CD40, LFA-1, LFA-3 и комплементарные им структуры Т-лимфоцитов – лиганд CD40 (появляется на активированных Т-клетках), IСАМ-1 и CD2. Основными цитокинами, синтезируемыми Т-хелперными лимфоцитами и поддерживающими активацию и пролиферацию антигенспецифичных В-клеток, являются IL-4, а также IL-5 и INFγ.
В ходе иммунного ответа на тимусзависимые и независимые антигены активированные В-лимфоциты могут далее дифференцироваться в плазматические клетки, синтезирующие антитела IgM-класса, или дать начало реакциям зародышевых центров.
В ходе первичного иммунного ответа на сложные антигены (например, эритроциты барана) существует ряд фаз:
1. Активация и деление лимфоцитов через 1-2 дня после иммунизации. Частота Т-клеточных митозов становится максимальной примерно на 3-й день, а В-клеточных – на один день позже.
2. Антителообразующие клетки, преимущественно lgM-класса, появляются на 3-4-й день и вскоре становятся основным компонентом мякотных тяжей.
3. На 4-5-й день, т.е. уже после появления сывороточных антител, обнаруживаются зародышевые центры. Они не принимают участия в первичном (IgM) ответе.
4. 5-7-й день – нарастание сывороточных титров IgG.
5. 9-15-й – день нарастание титров IgA, то есть формирование зародышевых центров с переключением классов Ig и образованием клеток памяти – это вторая фаза (первая - это продукция IgM без формирования зародышевых центров) в ходе реализации иммунного ответа на первичный контакт с антигеном.
Внутрифолликулярная дифференцировка В-клеток. Активированные в паракортикальной зоне CD5-CD23+ В-клетки утрачивают IgD и поступают в фолликул, структура которого из-за их быстрой пролиферации видоизменяется. В центре мономорфной шарообразной структуры из малых лимфоцитов появляется более светлая (при световой микроскопии) область. Она окружена мантийной зоной из малых лимфоцитов, которая имеет неравномерную толщину (истончена у одного из полюсов). Мантия окружает внутреннее содержимое вторичного фолликула – зародышевый или светлый центр. В условиях микроокружения зародышевого центра происходит многоступенчатый процесс антигензависимого созревания и дифференцировки В-клеток, который ведет к созданию плазматических клеток и В-клеток памяти. Многогранны взаимодействия между В-клетками, антигеном, Т-клетками, макрофагами и фолликулярными дендритическими клетами (ФДК) в пределах светлого центра фолликула. В базальной (она иначе называется темной) зоне зародышевого центра активированные В-лимфоциты утрачивают CD23 и превращаются в крупные бластные формы (центробласты), которые активно пролиферируют. Для центробластов характерна экспрессия CD77, CD38, отсутствие IgD, практически полное отсутствие IgM, сниженные уровни CD44 и L-селектинов. Большинство этих клеток гибнет апоптозом, поскольку ген антиапоптоза bcl-2 в центробластах не функционирует. Разрушенные погибшие клетки поглощаются макрофагами зародышевых центров, носящими название макрофагов инородных тел (tingible-body macrophages). Выжившие клетки уменьшаются в размере, их ядро сморщивается, становится как бы расщепленным (центроциты). На центроцитах вновь появляются мембранные Ig. Эти лимфоидные элементы уже прошли этап изотипического переключения и экспрессируют IgG, IgA или IgE. В результате соматических гипермутаций центроциты приобретают высокий аффинитет к антигену. Они не экспрессируют CD23. На части клеток зародышевых центров присутствуют антигены CD10, а также активационные антигены CD25, CD71 и т.д.
Направленность дифференцировки В-лимфоцитов в клетки памяти или в плазмоциты регулируется в апикальной светлой зоне зародышевых центров. Связывание молекулы В-лимфоцитов CD40 с соответствующим лигандом, присутствующим на активированных Т-клетках, ведет к формированию В-клеток памяти. В последнее время описано существование IgМ+ В-клеток памяти. Плазмоцитарная дифференцировка В-лимфоцитов происходит после их взаимодействия с растворимым фрагментом CD23 или с антигеном CD23, присутствующим на ФДК. В этих взаимодействиях участвует рецептор CD21 HIL-1.
Лимфоциты селезенки. Селезенка размещена в левом верхнем квадранте живота. Она связана с некоторыми другими органами и имеет почечную, панкреатическую и диафрагмальную поверхности. У взрослого человека она весит приблизительно 150 г вместе с небольшими придатками, которые находятся в желудочно-селезеночной связке, большом сальнике, а также в некоторых других местах. Структура селезенки представлена на рисунке 5. Она включает в себя капсулу, состоящую из плотной соединительной ткани, которая формирует сеть перегородок в ткани селезенки. Паренхима органа (селезеночная пульпа) представлена красной пульпой, состоящей из селе-
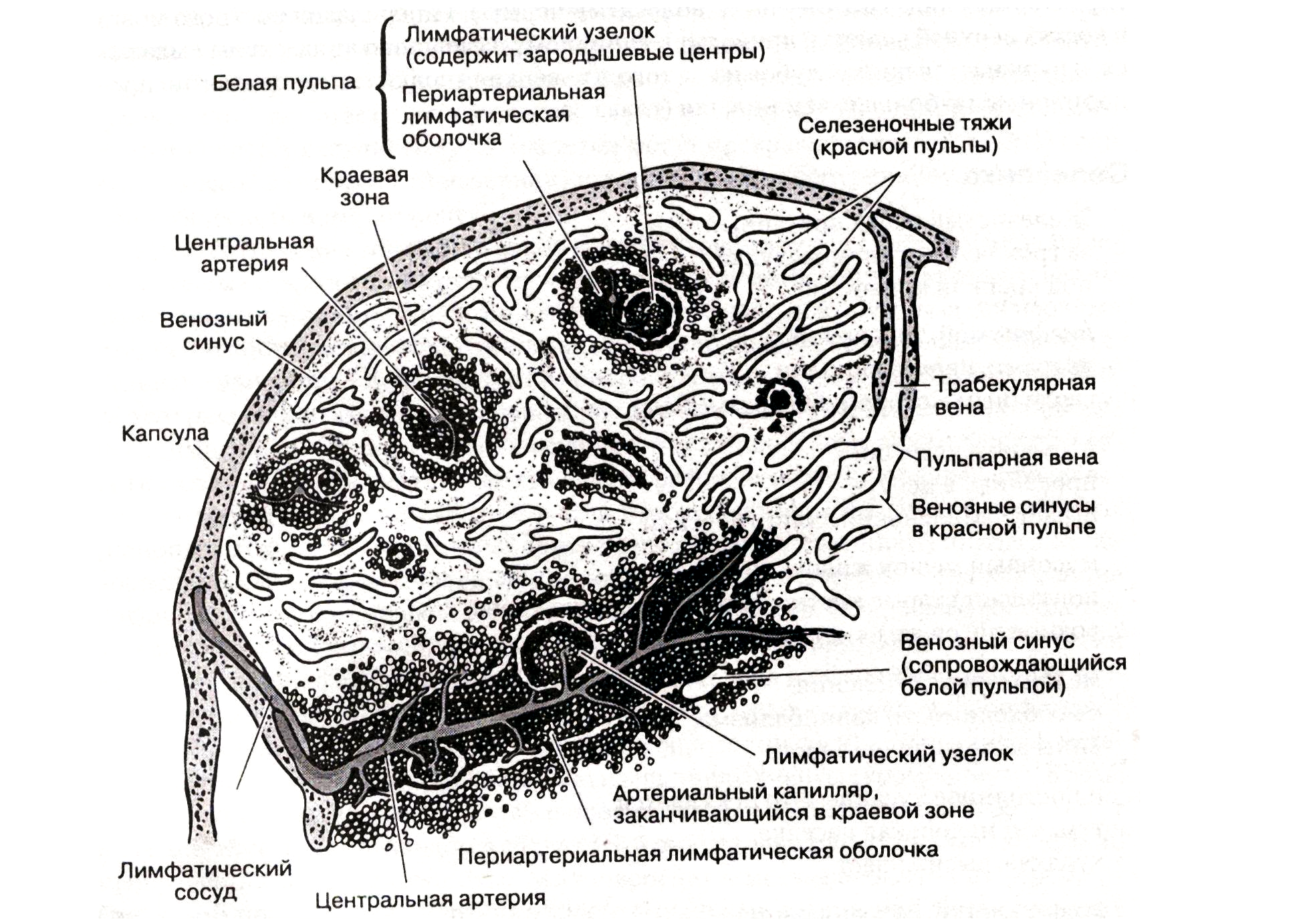
Рис. 5. Структура селезенки
зеночных синусов, и тонкими пластинками ткани — селезеночными тяжами, находящимися между синусами. Кластеры лимфоцитов селезенки бывают двух типов. Одни состоят преимущественно из Т-лимфоцитов (тимусного происхождения) и вспомогательных клеток и формируют цилиндрическую оболочку, окружающую центральную артерию. Это так называемая периартериальная лимфатическая оболочка (ПАЛО). В-лимфоциты внутри ПАЛО формируют узелки. ПАЛО центральной артерии постепенно суживается, переходя в белую пульпу вместе с капиллярами, соединяющимися непосредственно с венозными синусами. Кровь может изливаться прямо в красную пульпу, куда клетки свободно просачиваются и попадают, в конечном счете, в венозный синус.
Т-клетки селезенки. В селезенке присутствуют только периферические (наивные и зрелые) Т-лимфоциты, прошедшие селекцию в тимусе. Под влиянием антигенного стимула эти клетки активируются, подобно тому, как это происходит в лимфатических узлах.
В белой пульпе селезенки (периартериолярных лимфоидных муфтах) CD4 Т-клетки преобладают над CD8 Т-клетками, а в красной пульпе наблюдается обратное соотношение между этими популяциями. TCR γδ Т-клетки предпочтительно оседают в синусоидах селезенки, в то время как лимфоциты, несущие TCR αβ, главным образом, заселяют ПАЛО.
В-клетки селезенки. В селезенке происходят процессы активации В-клеток в ходе первичных и вторичных иммунных ответов. В-клетки, специфичные в отношении аутологичных антигенов, не поступают в фолликулы, они задерживаются в наружной зоне ПАЛО и гибнут.
Движение всех В-клеток в наружной зоне ПАЛО приостанавливается. Это универсальное явление происходит после связывания иммуноглобулинового рецептора во время иммунного ответа на различные антигены. Биологический смысл процесса состоит в том, что накопление активированных, пролиферирующих В-клеток в наружной зоне ПАЛО в течение первых нескольких дней иммунного ответа необходимо для встречи этих клеток с редкими типами антиген-специфичных Т-лимфоцитов. При отсутствии Т-клеточной помощи, которая необходима для реализации иммунологических ответов на тимусзависимые антигены, активированные В-клетки погибают. При наличии Т-клеточной помощи наивные В-клетки поступают преимущественно в фолликулы, где подвергаются дифференцировке в зародышевых центрах в ходе первичных иммунных ответов. При вторичных иммунных ответах В-клеток памяти на тимусзависимые антигены наблюдается выраженная В-клеточная пролиферация и дифференцировка в плазматические клетки в пределах наружной зоны ПАЛО, фолликулярная В-клеточная пролиферация является несколько более слабой, чем при первичных ответах.
В тимуснезависимых иммунных ответах В-клетки способны дифференцироваться в плазмоциты без Т-клеточной помощи. При ответе на Т1-1 антигены (ЛПС) происходит выраженная антигенспецифическая В-клеточная пролиферация и плазмоклеточная дифференцировка в наружной зоне ПАЛО и в красной пульпе; фолликулярная В-клеточная пролиферация умеренная. Считается, что именно поликлональные активаторы типа Т1-1, а также аутологичные антигены ведут к индукции CD5 на В-лимфоцитах. CD5+ В-клетки обычно не проходят через светлый центр и не подвергаются изотипическому переключению. В TI-2 ответах большинство пролиферирующих В-клеток в наружной зоне ПАЛО дифференцируется в плазматические клетки.
Краевая (маргинальная) зона селезеночной пульпы представляет собой переходную область между красной и белой пульпой. Здесь начинается процесс фильтрации и сортировки клеток.
Кровь поступает в орган по селезеночной артерии, проходящей через ворота. Селезеночная артерия разветвляется на трабекулярные артерии, которые в свою очередь делятся на центральные артерии, расположенные в центре цилиндрических ПАЛО. Как отмечалось ранее, центральные артерии прямо или косвенно переходят в венозные синусы. После попадания в селезеночные синусы кровь течет по пульпарным венам, которые переходят в трабекулярные вены. Из ворот селезенки кровь выносится по селезеночной вене. Ток лимфы в селезенке совпадает с направлением венозного потока и противоположен току артериальной крови.
В маргинальной зоне селезенки реализуются В-клеточные иммунные ответы на тимуснезависимые антигены, циркулирующие в периферической крови. В-клетки маргинальной зоны имеют специфические морфологические и иммунологические черты. На мембране В-лимфоцитов маргинальной зоны селезенки экспрессированы IgM, но отсутствуют IgD. Эти клетки не являются рециркулирующими, специализированы к иммунному ответу на тимуснезависимые углеводные антигены.
Барьерные клетки, описанные Вейсом как «сильно активизированные, быстро мобилизующиеся блуждающие фибробластные клетки», являются клетками стромы. Хотя функция барьерных клеток неизвестна, их центральное расположение предполагает полифункциональность, включая образование оболочки вокруг кровеносного сосуда, формирование барьеров между кровью и тканью, концентрацию регуляторных факторов, изоляцию иммунокомпетентной ткани после запуска иммунного ответа, отгораживание гемопоэтических колоний, концентрацию гемопоэтических факторов и защиту от паразитов. Подобные клетки представлены в других гемопоэтических и иммунных тканях, где они могут функционировать так же, как в селезенке.
Селезенка выполняет ряд важных функций:
тестирует кровь и иммунологически взаимодействует с ней, что позволяет распознавать, выбраковывать и удалять дефектные, старые и изношенные клетки;
повторное использование железа, концентрирование тромбоцитов, удаление эритроцитов, регуляция объема крови, эмбриональный (и иногда патологический у взрослых) гемопоэз, иммунные функции — все это элементы комплексной функции селезенки;
На ранних стадиях воспалительного ответа селезенка функционирует и как первичный бактериальный фильтр, функцию которого выполняют эндотелиальные клетки венозных синусов (ЭКВС), они имеют уникальные антигенные характеристики и способность двигаться, что позволяет им тестировать аномальные, старые клетки или клетки, содержащие бактерии (например, полиморфно-ядерные лейкоциты), паразитов или простейших (например, эритроциты), по мере перемещения клеток между пальцеобразными межэндотелиальными расщелинами;
продукцию специфических антител с помощью макрофагов (эта функция важна, поскольку несколько полисахаридов на поверхности и грамотрицательных, и грамположительных бактерий являются мощными системными токсинами). Если их не изолировать в макрофагах, эти бактериальные антигены до развития гуморального иммунного ответа могут запускать альтернативный путь активации комплемента, что приводит к вазодилатации, увеличению проницаемости капилляров и, в конечном счете — к шоку и смерти.
функция лимфатического «суперузла», в котором в присутствии Т-клеток образуется большое количество В-клеточных клонов (приблизительно 80 % клеток селезенки – В-клетки и около 15 % — Т-клетки). Кроме того, главным образом в селезенке происходит Т-независимое развитие В-клеток, имеющее важное значение для ответа организма на углеводные антигены, экспрессированные на капсулах бактерий Streptococcus pneumonias, Hemophilus influenzae и Neisseriae meningitides;
служит резервуаром для тромбоцитов, наработанных в костном мозге, а также задерживает эритроциты, но этот процесс менее пассивен и более динамичен. Стареющие, покрытые антителами или поврежденные эритроциты фильтруются в селезенке, где они либо удаляются, либо частично восстанавливаются, или «ремоделируются», ЭКВС и селезеночными макрофагами. Ремоделированные эритроциты могут затем повторно рециркулировать, тогда, как аномальные клетки распознаются селезенкой и быстро удаляются для последующей переработки.
