- •Методичні розробки
- •Частина 1
- •Ужгород – 2002
- •Передмова
- •Техніка експерименту в хімічній лабораторії
- •Загальні правила роботи в хімічній лабораторії
- •Предмет
- •Атомно-молекулярна теорія
- •Основні
- •Поняття
- •Прості та складні речовини
- •Хімічна символіка
- •Фізичні величини
- •Закон збереження маси
- •Закон еквівалентів
- •Закон сталості складу речовини
- •Закон кратних відношень
- •Газові закони
- •Закон Авогадро
- •Рівняння Менделєєва-Клапейрона
- •Хімічна термодинаміка
- •Термодинамічна система
- •Внутрішня енергія системи
- •Перший закон термодинаміки
- •Ентальпія системи
- •Тепловий ефект реакції
- •Закони термохімії
- •Термохімічні рівняння реакцій
- •Стандартний стан речовини
- •Термохімічні розрахунки
- •Поняття про ентропію
- •Другий закон термодинаміки
- •Хімічна кінетика
- •Поняття про швидкість хімічної реакції
- •Швидкість гомогенних реакцій
- •Швидкість гетерогенних реакцій
- •Залежність швидкості хімічної реакції від температури
- •Енергія активації хімічної реакції
- •Фотохімічні реакції
- •Ланцюгові реакції
- •З розгалуженими ланцюгами
- •Оборотні та необоротні реакції
- •Хімічна рівновага
- •Зміщення хімічної рівноваги
- •Фазові рівноваги
- •Каталіз
- •Розчини
- •Дисперсні системи
- •Розчини
- •Теорії розчинів
- •Розчинність речовин
- •Розчини
- •Розчини
- •Розчини твердих речовин
- •Способи вираження концентрації розчинів
- •Розчини неелетролітів
- •Тиск пари розчинів
- •Температура кипіння і температура замерзання розчинів
- •Розчини електролітів
- •Теорія електролітичної дисоціації
- •Ступінь електролітичної дисоціації
- •Ізотонічний коефіцієнт
- •Константа електролітичної дисоціації
- •Закон розведення
- •Властивості розчинів сильних електролітів
- •Добуток розчинності
- •Іонний добуток води
- •Водневий показник
- •Буферні розчини
- •Індикатори
- •Реакції у розчинах електролітів
- •Гідроліз солей
- •Ступінь гідролізу солі
- •Колоїдні розчини
- •Будова колоїдних часток
- •Окисно-відновні процеси електрохімічні процеси корозія
- •Ступінь окиснення елементу
- •Поняття про окисно-відновні реакції
- •Окисно-відновні властивості речовин
- •Класифікація окисно-відновних реакцій
- •Методи складання рівнянь окисно-відновних реакцій
- •У кислому середовищі:
- •У нейтральному середовищі:
- •В лужному середовищі:
- •Окисно–відновний потенціал
- •Еквівалент окисника і відновника
- •Електродний потенціал
- •Електричного шару
- •Гальванічний елемент
- •Стандартний електродний потенціал
- •Водневий електрод
- •Ряд стандартних електродних потенціалів металів
- •Електроди першого роду
- •Електроди другого роду
- •Окисно-відновні електроди
- •Іонселективні електроди
- •Електроліз
- •Корозія
- •Електрохімічна корозія
- •Захист металів від корозії
- •Загальні властивості полімерів
- •Полімери як високомолекулярні речовини
- •Структура полімерів
- •Реакція полімеризації
- •Механізми полімеризації
- •Властивості полімерів
- •Каучуки
- •Структура каучуків
- •Синтетичні каучуки
- •Вулканізація каучуків
- •Реакція поліконденсації
- •Пластмаси
- •Література для самостійної роботи студентів
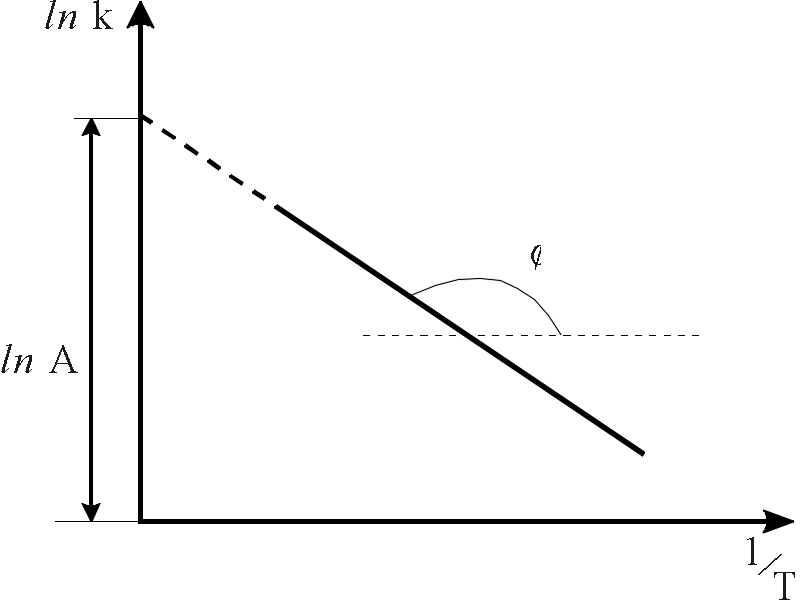
φ
Рис.3. Графічна
залежність
lnk
= –
Еа/RT
+ lnA
Залежність швидкості хімічної реакції від температури
![]() = v
= v![]()
![]() ,
деv
,
деv![]() і v
і v![]() – швидкості реакції при температурах
t2
і t1,
– температурний коефіцієнт швидкості.
=
– швидкості реакції при температурах
t2
і t1,
– температурний коефіцієнт швидкості.
= ![]() ,
коли різниця температурt2–t1 = 10,
тобто коефіцієнт
показує, у скільки разів збільшиться
швидкість реакції при підвищенні
температури на 10 градусів. При концентраціях
реагуючих речовин 1 моль/л швидкість
реакції чисельно рівна константі
швидкості k,
тоді k
,
коли різниця температурt2–t1 = 10,
тобто коефіцієнт
показує, у скільки разів збільшиться
швидкість реакції при підвищенні
температури на 10 градусів. При концентраціях
реагуючих речовин 1 моль/л швидкість
реакції чисельно рівна константі
швидкості k,
тоді k![]() = k
= k![]() ·
·![]() .
.
Функціональну
залежність константи швидкості
хімічної реакції k
від температури встановив шведський
вчений Ареніус (1889 р.); рівняння
Ареніуса:
k = А·е![]() ,
де А
– передекспоненціальний множник; Еа–
енергія активації, Т
–
температура.
,
де А
– передекспоненціальний множник; Еа–
енергія активації, Т
–
температура.
Графічно виразити залежність можна так:
ln k = –Еа/RT
+
lnA,
тобто tg = –![]() (рис.3).
(рис.3).
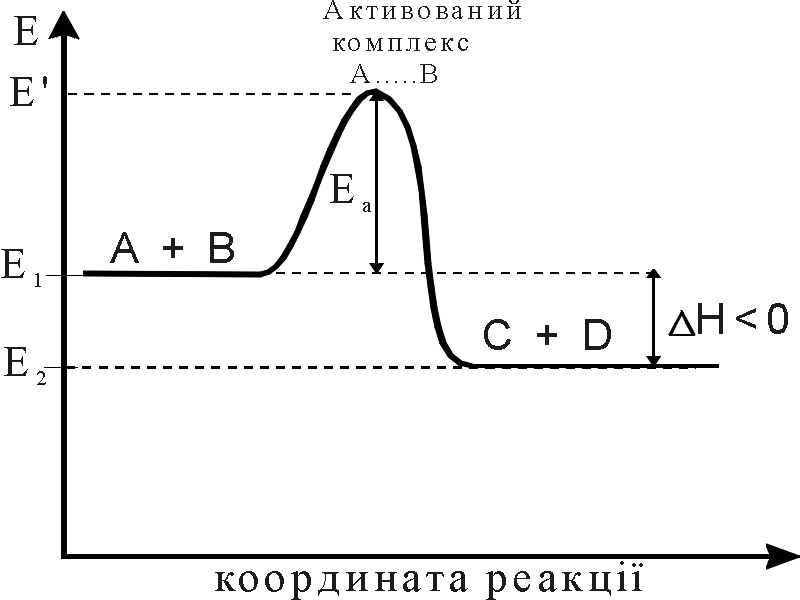
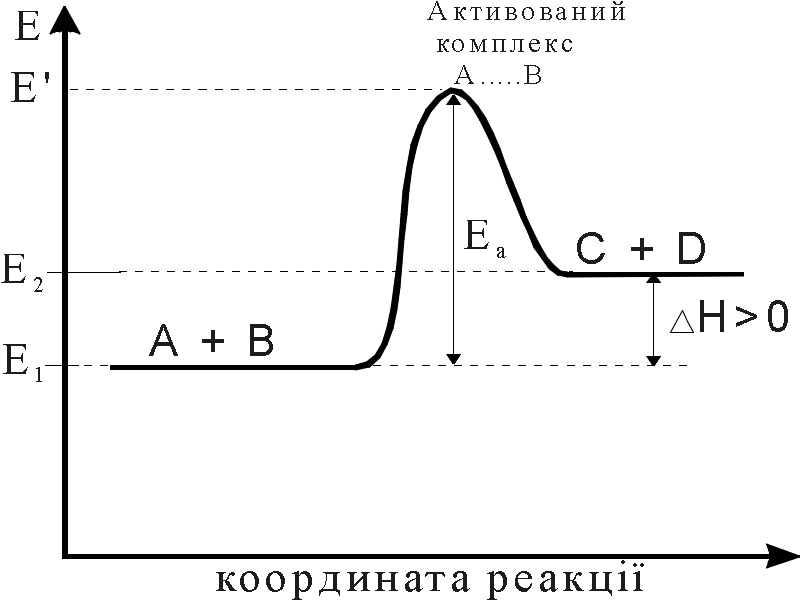
Енергія активації хімічної реакції
|
Рис.4. Енергетична діаграма для екзотермічної реакції
|
Рис.5. Енергетична діаграма для ендотермічної реакції
|
Для того, щоб молекули вступили у взаємодію, необхідно не тільки щоб вони мали надлишок енергії, рівний Еа, але і певну взаємну орієнтацію. Вплив просторової орієнтації молекул на швидкість реакції (або на константу швидкості) можна врахувати з допомогою так званого стеричного (імовірнісного) фактора Р: А = Р·z, А – множник в рівнянні Ареніуса; z – загальне число молекул реагуючих речовин, що стикаються.
Фотохімічні реакції
Радіаційно-хімічні реакції проходять під дією іонізуючого випромінювання (-випромінювання, потік нейтронів). Ці реакції вивчає радіаційна хімія. Механохімія вивчає хімічні перетворення, що ініціюються або прискорюються механічними діями (ультразвукова обробка, надвисокі тиски, ударні хвилі твердих тіл і рідин).