
- •4. Загальна класифікація матеріалів електронної техніки.
- •5. Тверді розчини. Системи з необмеженою розчинністю в твердому стані.
- •7. Механізм і кінетика росту кристалів з рідкої і твердої фаз.
- •9. Обмежені тверді розчини. Діаграми стану двокомпонентних систем з обмеженими твердими розчинами евтектичного типy.
- •10. Обмежені тверді розчини. Діаграми стану двокомпонентних систем з обмеженими твердими розчинами перитектичного типy.
- •11. Фізико-хімічні принципи легування матеріалів з різним типом хімічного зв’язку. Методи легування кристалів.
- •12. Методи вирівнювання складу кристалів ( активні і пасивні
- •13. Особливості легування склоподібних напівпровідників
- •14.Хімічний склад металевих сплавів високого опору, фізичні і хімічні властивості та використання в електроніці.
- •15.Технологічний процес одержання, характерні фізичні властивості та застосування кремнію.
- •16. Методи вирощування кристалів. Рекристалізація і перекристалізація.
- •17. Методи вирощування кристалів. Нормально напрямлена кристалізація розплаву. Метод Чалмерса,
- •18. Метод вирощування кристалів Чохральського
- •19.Провідникові матеріали на основі окислів металів, технологія, фізичні властивості і застосування.
- •20. Методи вирощування кристалів. Нормально напрямлена кристалізація розплаву. Методи Бріджмена, Бріджмена-Стокбаргера.
- •21. Трьохкомпонентні і багатокомпонентні системи. Зображення складу трьохкомпонентних систем. Трикутник Гіббса. Загальний метод зображення діаграми стану багатокомпонентних систем.
- •22. Тугоплавкі провідникові метали. Порошкова технологія та особливості виготовлення електротехнічних елементів на основі тугоплавких металів і їх застосування.
- •23. Піроелектричний ефект, матеріали піроелектрики і їх застосування в електроніці.
- •24. Технологічний процес одержання, характерні фізичні властивості та застосування германію.
- •25. Технологія алюмінію, фізичні властивості, промислові марки та застосування в електроніці
- •26. Фізико-хімічні основи процесів очистки та розділення сировинних компонент. Сорбційні методи очистки.
- •27. Вплив зовнішніх факторів на властивості матеріалів. Пластична деформація і термічна обробка металів і напівпровідників.
- •28. Класифікація провідникових матеріалів по типу і величині провідності, хімічному складу, температурі плавлення.
- •29. Аморфні матеріали: метали, напівпровідники, діелектрики. Халькогенідні склоподібні напівпровідники. Аморфний гідрогенізований кремній
- •32. Матеріали для твердотілих лазерів. Вимоги до активатора і матеріалу пасивного діелектрика. Будова робочого тіла yag лазерів
- •33. Двокомпонентні системи конденсованого типу. Діаграми стану з утворенням хімічної сполуки.
- •35. Одержання кристалів з рідких та твердих розчинів. Методи одержання кристалів з газової фази.
- •36. Фізико-хімічні основи процесів очистки та розділення сировинних компонент. Методи, які базуються на перегонці через газову фазу.
- •38. Ректифікація.
- •39. Нанокристалічні і наноструктуровані матеріали. Властивості і використання.
- •40. Електрети. Технологія властивості і застосування.
- •41. Полімерні електроізоляційні матеріали.
- •42. П’єзоелектричні кристали: характерні властивості, матеріали і застосування.
Предмет і завдання матеріалознавства. Основні задачі і проблеми електротехнічного матеріалознавства.
Матеріалознавство – це наука, що вивчає в загальному зв’язку склад, будову, структуру і властивості матеріалів, а також закономірності їх зміни під тепловими, хімічними, механічними та іншими впливами.
До основних задач матеріалознавства належать:
1)розвиток теорії зв’язку складу, структури і властивостей матеріалів;
2)вивчення зв’язку хімічного складу і структури і матеріалів з їх властивостями та умовами одержання;
3)розробка методів раціональної зміни складу і будови матеріалів для створення технологій і забезпечення їх практичного застосування з оптимальними економічнми показниками.
М. операється на досягненнях фізики і хімії твердого тіла, кристалофізики та кристалохімії, фізичної хімії, квантової механіки, термодинаміки та інших фундаментальних і прикладних наук.
М. визначає 2 задачі:
1) кристало-хімічні задачі:Полягає у встановлені залежності вл. від хімічного складу та кристалічної структури величин.Мета: встановлення правил або побудова теорій, які дозволили б синтезувати матер. з наперед заданими вл.
2)технологічні задачі:
Полягає у встановленні оптимальних процесів та умов їх проведення, що дозв цілеспрямовано міняти комплекс вл деякої величини фізкованого складу і кристалічної структури.
Мета дисципліни — пізнання властивостей матеріалів в залежності від складу і виду обробки, методів їх зміцнення для найефективнішого використання в техніці, а також створення матеріалів з наперед заданими властивостями: з високою міцністю чи пластичністю, з доброю електропровідністю, великим електричним опором або спеціальними магнітними властивостями, а також, поєднання різних властивостей в одному матеріалі (композиційні матеріали).
Головним завданням цієї дисципліни є набуття знань та навичок по оцінці властивостей матеріалів, раціональному і доцільному вибору їх для конкретних умов роботи, вміння застосовувати ефективні технологічні методи обробки та зміцнення, які б привели в результаті до здешевлення виробів, зменшення витрат матеріалів з одночасним збільшенням терміну експлуатації
Двокомпонентні системи конденсованого типу. Правило фаз Гіббса.
Компоненти системи – складові систем, концентрація яких визначає склад фаз даної рівноважної системи.Число компонент або співпадає з числом складових системи (хімічні реакції відсутні), або менше. Число компонент системи рівне різниці між числом її складових і числом рівнянь зв’язку між ними.
правило фаз Гіббса встановлює
числом фаз
![]() і компонент
і компонент![]() в системі через ступені вільності
в системі через ступені вільності![]() :
:
![]() . Цифра
“2” вказує на число зовнішніх факторів,
що впливають на систему (
. Цифра
“2” вказує на число зовнішніх факторів,
що впливають на систему (![]() і
і![]() ).
).
Під числом ступенів вільності (варіантністю) розуміють число параметрів стану, які можуть довільно змінюватись, не порушуючи фазової рівноваги при цьому.
В будь-якій системі число фаз
не може перевищувати число компонентів
більше, ніж на два:
![]() .
.
Якщо досліджують перетворення в системах без зміни тиску, то правило фаз Гіббса застосовується у вигляді:
![]() . Нонваріантна
(або інваріантна)
рівновага відповідає умові:
. Нонваріантна
(або інваріантна)
рівновага відповідає умові:
![]() .
При цьому в рівновазі знаходиться
максимальне число фаз. Довільна зміна
одного з параметрів системи приводить
до зміни числа фаз в системі.
.
При цьому в рівновазі знаходиться
максимальне число фаз. Довільна зміна
одного з параметрів системи приводить
до зміни числа фаз в системі.
Моноваріантна
рівновага:
![]() .
Можна довільно міняти один параметр
без зміни числа фаз.
.
Можна довільно міняти один параметр
без зміни числа фаз.
Біваріантнарівновага :![]() .
При такому числі фаз довільно можна
міняти параметри системи, не порушуючи
рівноваги.
.
При такому числі фаз довільно можна
міняти параметри системи, не порушуючи
рівноваги.
Напівпровідникові сполуки типу А2В6 та тверді розчини на їх основі: основні властивості та застосування в електроніці.


Багато з них є електролюмініфори. Викор для виготовлення світло діодів.
4. Загальна класифікація матеріалів електронної техніки.

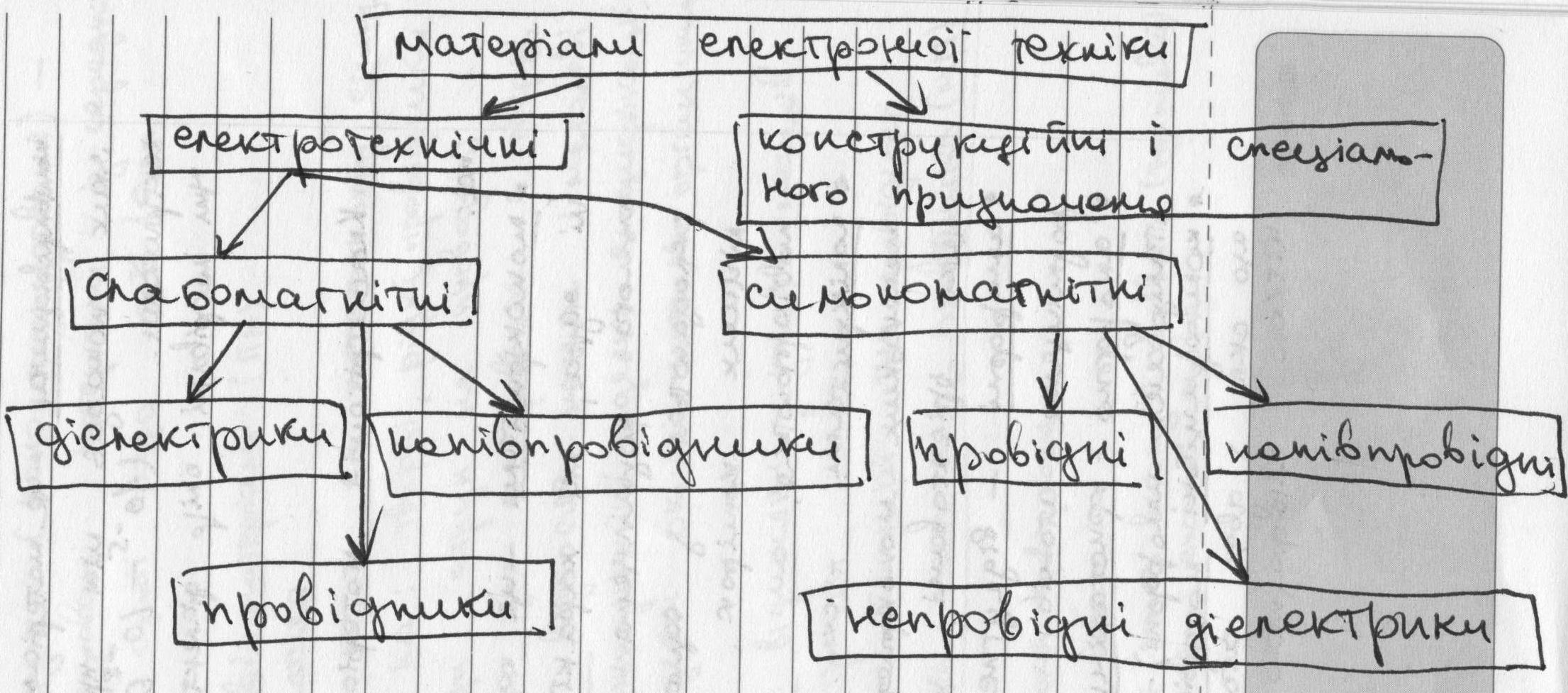
5. Тверді розчини. Системи з необмеженою розчинністю в твердому стані.
Твердими розчинами називають фази змінного складу, в яких атоми одного компонента розміщуються в просторовій гратці іншого, не змінюючи її типу. Це відноситься до кристалічних речовин, але тверді розчини можуть бути і в аморфній фазі.
Тверді розчини заміщення– розміщення проходить шляхом заміщення одних атомів іншими в вузлах кристалічної гратки.
Тверді розчини впровадження – розміщення проходить шляхом впровадження чужих атомів в міжвузля гратки.
Можливе утворення ще і твердих розчинів вилучення, які утворюються на базі хімічних сполук. Їх утворення супроводжується появою порожніх місць в вузлах кристалічної гратки.
Тверді розчини однофазні.
Твердий розчин на основі розчинника
![]() позначається буквою
позначається буквою![]() або
або![]() ,
а на базі
,
а на базі![]() – буквою
– буквою![]() або
або![]() .
.
Тверді розчини заміщення можуть бути обмеженими і необмеженими. В необмежених твердих розчинах можливий плавний перехід від одного компонента до іншого. Тверді розчини з необмеженою або значною розчинністю можуть упорядковуватись. Статистично рівномірно розкидані в кристалічній гратці розчинені атоми при певних умовах займають позиції в відповідному порядку. Такі тверді розчини називаються впорядкованими або надструктурами.
У випадку необмеженої розчинності в рідкому і твердому станах згідно правила фаз повинна мати місце моноваріантна реакція, за винятком кристалізації чистих компонент. Це значить,що на діаграмі мають бути відсутні горизонтальні ділянки.

Рис.4. Діаграма стану систем з необмеженою розчинністю.
В деяких випадках криві
солідуса і ліквідуса дотикаються в
одній екстремальній
точці (рис.4, б і в). Застосування правила
Гіббса для цих точок неможливе тому, що
число ступенів вільності
![]() =1.
В цьому випадку використовують доповнення
Ван-дер-Ваальса, згідно якому будь-яка
двофазна система незалежно від числа
компонент при ідентичності
складів рівноважних фаз поводить себе
як однокомпонентна.
=1.
В цьому випадку використовують доповнення
Ван-дер-Ваальса, згідно якому будь-яка
двофазна система незалежно від числа
компонент при ідентичності
складів рівноважних фаз поводить себе
як однокомпонентна.
6. Основні положення загальної теорії утворення фаз. Гомогенне і гетерогенне зародкоутворення.
Утворення зародків нової фази
Рушійною силою будь-якого фазового перетворення, в тому числі і кристалізації, є намагання системи зменшити свою вільну енергію. Кристалізація (конденсація) відбувається тільки в системах з перенасиченням (переохолодженням), тобто в тих системах, що знаходяться в метастабільному стані. Створення пересичення чи переохолодження для кристалізації вихідної фази необхідно для надання системі додаткової енергії, яка необхідна для утворення поверхні зародків нової фази.
При даній температурі газову
фазу називають перенасиченою,
якщо її тиск
![]() перевищує тиск
перевищує тиск![]() насичених парів рідкої або твердої
фази. Величинами, які характеризують
ступінь перенасичення пари, є:
насичених парів рідкої або твердої
фази. Величинами, які характеризують
ступінь перенасичення пари, є:
![]() –абсолютне перенасичення;
–абсолютне перенасичення;
![]() –відносне перенасичення;
–відносне перенасичення;
![]() –коефіцієнт перенасичення.
–коефіцієнт перенасичення.
Різниця вільних енергій атома
або молекули в двох фазах (або різниця
хімічних потенціалів двох фаз
![]() ):
):
![]() . (2.1)
. (2.1)
Розплави характеризуються переохолодженням:
![]() ,(2.2)
,(2.2)
де
![]() – температура плавлення речовини;
– температура плавлення речовини;
![]() – температура переохолодженого
розплаву.
– температура переохолодженого
розплаву.
Механізм утворення нової фази може бути гомогенним, коли в вихідній фазі відсутні тверді частинки або поверхні, що стимулюють утворення на них центрів, або гетерогенним, коли вони присутні.
