
- •4. Качественный химический анализ. Основные понятия. Предмет и средства. Чувствительность, специфичность, селективность.
- •Типы аналитических реакций:
- •1. Микрокристаллоскопический
- •2. Капельный
- •5. Классификация катионов и анионов на группы. Аналитические группы катионов. Обзор реакций.
- •6. Количественный анализ. Предмет и методы.
- •7. Весовой анализ. Принципы и методы объемного анализа. Растворы в объемном анализе.
- •8. Метод нейтрализации. Кислотно-основные индикаторы. Смешанные индикаторы. Кривые титрования. Титрование в неводных средах.
- •9. Комплексометрия. Реакции, применяемые в комплексометрии. Кривые титрования. Этилендиаминтетрауксусная кислота, как реагент в комплексометрии.
- •10. Редоксметрия. Перманганатометрическое титрование. Иодометрическое титрование. Электроды в редоксметрии.
- •11. Физико-химические и физические методы анализа. Общая характеристика методов.
- •12. Методы адсорбционного фотометрического анализа.
- •13. Хроматографический анализ. Классификация методов.
- •Классификация методов хроматографии
- •14. Жидкостная адсорбционная, ионообменная хроматография. Хроматография в тонком слое. Гель-хроматография.
- •15. Спектральные методы исследования органических соединений (уф-, ик- и ямр-спектроскопия).
- •16. Электронная спектроскопия органических соединений (уф-спектроскопия).
- •17. Законы поглощения света веществом. Коэффициент молярной экстинции.
- •18. Спектры поглощения органических соединений.
- •19. Возможности электронной спектроскопии в установлении строения органических соединений.
- •20.Спектры испускания (флуоресценция, фосфоресценция.)
- •21. Действие ик-излучения на молекулы органических соединений. Возможности ик-спектроскопии при изучении органических соединений.
- •22. Спектроскопия ядерного магнитного резонанса. Ядерный магнитный резонанс (ямр) и условия его возникновения.
- •23. Масс-спектрометрия органических соединений. Происхождение масс-спектров (ионизация молекул органических соединений при бомбардировке электронами, лазерного излучения и др.).
- •24. Рентгеноструктурный анализ органических соединений. Преимущества и недостатки метода рентгеноструктурного анализа в исследовании органических соединений.
- •2) Что такое активность? Как связана активноть иона и его равновесная концентрация? Что такое ионная ила ратвора, коэффициент активности?
- •3.Что такое мольная доля?
- •4.Как формулируется закон действия масс? Что такое термодинамичекая канстанта равноввессия? Какие факторы влияют на ее величину?
- •6)Что такое условная константа равновесия? Какие факторы влияют на ее величину?
- •8) В чем суть условия материального баланса? Сформулируйте принцип решения уравнения материального баланса.
- •9. Что такое константа диссоциации и степень диссоциации.
- •11. Как влияет введение одно- и разноименных ионов на степень диссоциации слабого электролита?
- •2. Что такое окислитель, восстановитель, окисление и восстановление?
- •3. Что называется электродным потенциалом?
- •4. Как влияет ионная сила на величину электродного потенциала?
- •5. Как влияет рН среды на величину потенциала? Выведите формулу зависимости потенциала от рН для полуреакции, протекающей с участием ионов водорода или гидроксида.
- •6. Как определить направление реакции окисления-восстановления и полноту ее протекания?
- •8. Приведите примеры использования окислительно-восстановительных реакций для растворения малорастворимых соединений.
- •9. Назовите основные окислители и восстановители, используемые для разделения и обнаружения ионов. Напишите соответствующие полуреакции.
- •12. Почему избыток хлорид-ионов мешает обнаружению ионов марганца по реакции образования перманганата?
- •13. Почему не удается обнаружить ион марганца (II) действием окислителя на концентрированные растворы солей марганца (II) ?
- •14. Напишите реакции взаимодействия бромид- и иодид-ионов с хлорной водой и объясните, в какой последовательности они протекают.
- •15. В каких условиях нитрат-ион можно восстановить до: а) аммиака; б) нитрит-иона?
- •1.Какие системы называются гетерогенными? Приведите примеры.
- •2. Выведите формулу константы растворимости.
- •3. Как выражают константу растворимости для идеальных и реальных систем? От чего зависит величина константы растворимости для этих систем?
- •4. Как связаны термодинамическая, реальная и условная константы растворимости?
- •5. Как влияет одноименный ион на растворимость осадка?
- •6. Почему при выделении осадка следует избегать большого избытка осадителя?
- •7. Как влияют электролиты на растворимость осадка?
- •8. Что называется растворимостью и молярной растворимостью?
- •9. Выведите формулу для расчета растворимости соединения АmВn.
- •10. В каких случаях по величинам констант растворимости можно сравнивать растворимость малорастворимых соединений?
- •11. Сформулируйте условия образования и растворения осадка.
- •12. Как влияет температура на растворимость осадка?
- •13. Каковы причины растворимости малорастворимых соединений: а) в кислотах; б) в щелочах?
- •16. Как перевести сульфаты катионов II группы в карбонаты?
- •1. Дайте определение следующим понятиям: разделение, концентрирование, абсолютное и
- •2. Приведите примеры классификаций методов разделения и концентрирования. На чем они основаны?
- •3. Осаждение и соосаждение как методы разделения и концентрирования.
- •4. Перечислите факторы, от которых зависит коэффициент распределения.
- •5. Какие из перечисленных параметров (концентрация, рН раствора, маскирующие вещества, температура) влияют на значение коэффициента распределения?
- •8. В чём сущность методов экстракции? Какие задачи решаются с помощью этих методов?
- •10. Какие процессы определяют скорость экстракции?
- •11. Классификация экстракционных систем.
- •12. Назвать органические растворители, наиболее часто используемые в методах экстракции.
- •13. Назвать основные типы соединений, в виде которых экстрагируются ионы металлов. Привести примеры.
- •14. Каковы достоинства и недостатки методов экстракции?
- •15. В чем сущность методов хроматографии?
- •16. Как классифицируются методы хроматографии по агрегатному состоянию фаз; механизму процесса разделения; технике выполнения и по цели проведения?
- •18. Каковы области применения, достоинства и недостатки методов адсорбционной хроматографии?
- •19. В чём сущность метода ионообменной хроматографии?
- •20. Назвать основные типы ионитов. Что называется обменной ёмкостью ионита?
- •21. Каковы области применения, достоинства и недостатки метода ионообменной хроматографии.
- •22. Пояснить сущность метода осадочной хроматографии. Назвать варианты этого метода анализа.
- •23. На чём основан качественный анализ методами осадочной и распределительной хроматографии на бумаге?
- •24. Как количественно оценивают способность различных веществ к разделению на бумаге?
- •28. В чем сущность тонкослойной хроматографии?
- •29. Каковы преимущества тонкослойной хроматографии перед другими хроматографическими методами?
- •1.Что такое комплексное соединение
- •2. Какие факторы влияют на устойчивость комплексных соединений
- •3.Какие принципы могут быть положены в основу классификации комплексных соединений?
- •4. Назовите основные типы комплексных соединений. Приведите примеры.
- •5. Дайте определение следующим понятиям: комплексообразователь, лиганды, координационное число, дентатность лиганда, заряд комплексного иона.
- •6. Что называется внутрикомплексным соединением? Приведите примеры
- •7. Какие равновесия имеют место в растворах комплексных соединений? Как можно охарактеризовать эти равновесия?
- •8.Что такое ступенчатые и общие константы устойчивости комплексных соединений?
- •9.Дайте теоретическое обоснование возможности использования комплексных соединений для избирательного растворения и осаждения малорастворимых соединений.
- •10.Какие свойства комплексных соединений имеют наиболее важное значение для обнаружения и разделения ионов?
- •11. Приведите примеры использования реакций комплексообразования для растворения:
- •13. Приведите примеры использования реакций комплексообразования для маскирования мешающих ионов.
- •14. Приведите примеры использования реакций комплексообразования для идентификации ионов.
16. Как перевести сульфаты катионов II группы в карбонаты?
Растворимость сульфатов бария, стронция и кальция в воде незначительна. количества сульфата бария достаточно, чтобы при добавлении концентрированного раствора Na2CO3 из насыщенного раствора сульфата бария выпал осадок.
BaCO3. При этом понижается концентрация Ва++, находящегося в растворе. Вследствие нарушения состояния динамического равновесия, устанавливающегося в насыщенном растворе между осадком и раствором соли, растворяется новая часть осадка BaSO4, которая под влиянием Na2CO3 снова переходит в BaCO3.
Вследствие указанных процессов при кипячении нерастворимых в воде сульфатов с концентрированным раствором Na2CO3 происходит обменное разложение между растворенной частью сульфатов и Na2CO3 по схеме:
Na2CO3 v
BaSO4 ^=± Ba++ + SO~ < > BaCO3 + 2Na+ + SO4" осадок раствор осадок раствор
Сопоставляя величины произведений растворимости сульфата и карбоната бария, мы видим, что BaSO4 является наименее растворимым соединением. Поэтому перевод BaSO4 в BaCO3 требует многократной обработки осадка BaSO4 концентрированным раствором Na2CO3.
превращение BaSO4 в BaCO3 будет наблюдаться в том случае, если концентрация CO3" превысит концентрацию SO4" более чем в 50 раз, именно вследствие этого применяют концентрированный раствор Na2CO3.
Реакция обратима и, следовательно, не дойдет до конца при однократной обработке осадка сульфата бария. По мере протекания реакции концентрация CO3"" уменьшается, а концентрация SO4"" увеличивается, и в конце концов соотношение этих концентраций достигает 50; тогда устанавливается равновесие, т. е. превращение BaSO4 в BaCO3 приостанавливается.
Методы разделения и концентрирования
1. Дайте определение следующим понятиям: разделение, концентрирование, абсолютное и
Относительное концентрирование, коэффициент концентрирования.
Разделение смесей - процесс выделения чистых веществизсмесей. Разделяемые продукты имеют различные химические и физические свойства.
Разделение смеси физическими или химическими методами возможно тогда, когда вещества (компоненты), их составляющие, обладают резко различными свойствами.
КОНЦЕНТРИРОВАНИЕ-частный случай разделения компонентов исследуемой смеси, в результате к-рого повышается отношение концентрации (кол-ва) микрокомпонентов к концентрации (кол-ву) макрокомпонента.
При индивидуальном концентрировании из образца выделяется один или последовательно неск. микрокомпонентов, а при групповом - неск.микрокомпонентоводновременно.
Коэф.
концентрирования показывает, во сколько
раз изменилось отношение абс. кол-в
микрокомпонентаиматрицыпри концентрировании:
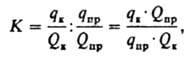 где
Qк
и Qпр
-
абс. кол-ва матрицысоотв. в концентрате ипробе.
где
Qк
и Qпр
-
абс. кол-ва матрицысоотв. в концентрате ипробе.
Матрица - Макромолекулярная основа для синтеза комплементарной копии макромолекулы.
2. Приведите примеры классификаций методов разделения и концентрирования. На чем они основаны?
Необходимость разделения и концентрирования может быть обусловлена следующими факторами: 1) проба содержит компоненты, мешающие определению; 2) концентрация определяемого компонента ниже предела обнаружения метода; 3) определяемые компоненты неравномерно распределены в пробе; 4) отсутствуют стандартные образцы для градуировки приборов; 5) проба высокотоксична, радиоактивна или дорога. Разделение – это операция (процесс), в результате которой компоненты, составляющие исходную смесь, отделяются один от другого. Концентрирование – операция (процесс), в результате которой повышается отношение концентрации или количества микрокомпонентов к концентрации или количеству макрокомпонента. При разделении концентрации компонентов могут быть близки друг к другу, но могут и отличаться. Концентрирование проводят в условиях, когда концентрации компонентов резко отличаются.
Групповое и индивидуальное выделение и концентрирование Групповое – за один прием отделяется несколько компонентов. Индивидуальное – из образца выделяют один компонент или последовательно несколько компонентов. При использовании многоэлементных методов определения (атомно-эмиссионный, рентгенофлуоресцентный, искровая масс-спектрометрия, нейтронно-активационный) предпочтительнее групповое разделение и концентрирование. При определении методами фотометрии, флуориметрии, атомно-абсорбционным, напротив, целесообразнее индивидуальное выделение компонента. Разделение и концентрирование имеют много общего как в теоретическом аспекте, так и в технике исполнения.
