
- •10. Теория переходного состояния
- •21. Ступенчатая диссоциация электронов
- •28. Комплексные соединения. Основные положения теории Вернера. Тип химической связи в комплексных соединениях.
- •29. Диссоциация комплексных соединений в водных растворах (типы диссоциации, ступени диссоциации). Привести примеры.
- •33. Электрохимические процессы. Механизм возникновения тока в гальваническом элементе. Устройство и принцип работы медно-цинкового гальванического элемента (Якоби-Даниэля).
- •34. Стандартный электродный потенциал. Уравнения Нернста. Эдс гальванического элемента.
- •37. Электрохимическая коррозия: классификация, условия протекания.
- •38. Атмосферная коррозия
- •Виды атмосферной коррозии
- •Особенности протекания атмосферной коррозии металлов
- •Уравнение атмосферной коррозии:
- •Свойства лакокрасочных материалов
- •Свойства лакокрасочных покрытий
- •Виды лакокрасочных материалов (лкм)
- •Состав лакокрасочных материалов
- •Классификация лакокрасочных материалов
- •42. Электролиз. Схема электролизной установки. Причины электролиза. Анод. Катод. Их заряды при электролизе.
- •54. Химическая связь.
- •Методы умягчения воды
- •70. Двенадцать принципов зелёной химии
- •Основные промышленные группы полимеров, синтезируемых поликонденсацией
1. Явления, при которых из одних веществ образуются другие, новые вещества, называются химическими. Изучением таких явлений занимается химия. Химия — это наука о превращениях веществ. Она изучает состав и строение веществ, зависимость свойств веществ от их состава и строения, условия и пути превращения одних веществ в другие.
Значение химии.
В современной жизни, особенно в производственной деятельности человека, химия играет исключительно важную роль. Нет почти ни одной отрасли производства, не связанной с применением химии. Природа дает нам лишь исходное сырье — дерево, руду, нефть и др. Подвергая природные материалы химической переработке, получают разнообразные вещества, необходимые для сельского хозяйства, для изготовления промышленных изделий и для домашнего обихода — удобрения, металлы, пластические массы, краски, лекарственные вещества, мыло, соду и т. д. Для химической переработки природного сырья необходимо знать общие законы превращения веществ, а эти знания дает химия.
2. Моль — количество вещества, содержащее столько молекул, атомов, ионов, электронов или других структурных единиц, сколько содержится атомов в 12 г изотопа углерода 12С.
В настоящее время число структурных единиц, содержащихся в одном моле вещества (число Авогадро), определено с большой точностью. При практических расчетах его принимают равным "6,02-*1023.
Масса 1 моля данного вещества называется его мольной массой. Мольная масса обычно выражается в г/моль. Поскольку в одном моле любого вещества содержится одинаковое число структурных единиц, то мольная масса вещества (М, г/моль) пропорциональна массе соответствующей структурной единицы, т, е. относительной молекулярной (или атомной) массе данного вещества (Л/о™, а. е. м.):
В настоящее время эквивалентом элемента называют такое его количество, которое соединяется с 1 молем атомов водорода или замещает то же количество атомов водорода в химических реакциях.
Масса 1 эквивалента элемента называется его эквивалентной массой.
Расчет эквивалента и эквивалентной массы кислот:
![]()
![]()
![]() -
кол-во атомов водорода
-
кол-во атомов водорода
Расчет эквивалента и эквивалентной массы оснований:
![]()
![]()
![]() - кол-во гидроксильных
групп
- кол-во гидроксильных
групп
Масса 1 эквивалента элемента называется его эквивалентной массой.
Наряду с понятием об эквивалентной массе иногда удобно пользоваться понятием об эквивалентном объеме, т. е. объеме, который занимает при данных условиях 1 эквивалент рассматриваемого вещества. Например, при нормальных условиях эквивалентный объем водорода равен 11,2 л/моль, эквивалентный объем кислорода — 5,6 л/моль.
3.закон эквивалентов:
Вещества взаимодействуют друг с другом в количествах, пропорциональных их эквивалентам.
При решении некоторых задач удобнее пользоваться другой формулировкой закона эквивалентов:
Массы (объемы) реагирующих друг с другом веществ пропорциональны их эквивалентным массам (объемам).
Количественные законы химии
В химических реакциях одно или несколько веществ изменяют свой химический состав, образуя одно или несколько новых веществ. Вещества, подвергающиеся превращению, называются реагентами, а вновь образующиеся вещества называются продуктами. Эти определения позволяют записать любую химическую реакцию схематическим образом:
Реагенты = Продукты
Состав химических соединений и изменения их состава, происходящие в результате химических реакций, подчиняются четырем важнейшим законам. Они называются количественными законами химии.
Закон сохранения материи (Лавуазье, 1774 г.) *. Согласно этому закону, в химических реакциях не может происходить возникновения или исчезновения материи. Например, если 4 г водорода сгорают в кислороде с образованием 36 г воды, то следует заключить, что в этой реакции принимают участие 32 г кислорода.
Химическое уравнение: 2H2 (газ) + O2 (газ) = 2H2O (газ) Соединяющиеся массы: 4 г + 32 г = 36 г
Закон постоянства состава, или постоянных отношений (Пруст, 1797 г.). Согласно этому закону, каждое чистое соединение всегда состоит из одних и тех же элементов, связанных между собой в одинаковом весовом отношении. На этом законе основано приведенное выше определение соединения.
Закон кратных отношений (Дальтон, 1803 г.). Этот закон гласит, что если какие-либо два элемента, А и В, могут связываться между собой, образуя несколько разных соединений, то весовые (массовые) количества элемента А, которые связываются с постоянным весовым количеством элемента В, пропорциональны небольшим целым числам. Например, поскольку Ar(H) = 1 и Ar(О) = 16, то весовое отношение Н:О для воды (H2O) равно 2: 16, а весовое отношение Н:О для перекиси (пероксида) водорода (H2O2) равно 2:32, или 1:16. Следовательно, весовое отношение водорода, связанного с постоянным весовым количеством кислорода (скажем, 16 г) в воде и в пероксиде водорода, равно 2:1.
4. Раздел химии, посвященный количественному изучению тепловых эффектов реакций, получил название термохимии.
гомогенные реакции, гетерогенные реакции. Все химические реакции можно разбить на две группы: необратимые и обратимые реакции. Необратимые реакции протекают до конца — до полного израсходования одного из реагирующих веществ. Обратимые реакции протекают не до конца: при обратимой реакции ни одно из реагирующих веществ не расходуется полностью.
Энтальпия. образованного в-ва или тепловой эффект хим. р-ции – изменение энтальпии в р-ции образования в-ва из простых в-в. Энтальпия, отнесеннаяОднако чаще в химии приходится иметь дело с процессами, протекающими при постоянном давлении. При этом удобно пользоваться величиной энтальпии Н, определяемой соотношением:
Н = U + РV
При постоянном давлении и при условии, что в ходе процесса совершается только работа расширения (А = Р∆V)
∆Н = ∆U + Р∆V
∆U= ∆Н - Р∆V
Cравнивая последнее уравнение с уравнением внутренней энергии
∆U = Q-A
видим, что при указанных условиях
∆Н = Qр
Qр — теплота, поглощенная системой при постоянном давлении.
Последнее уравнение дает возможность определять изменение энтальпии при различных процессах.
Наконец, в случае химической реакции изменение энтальпии равно взятому с обратным знаком тепловому эффекту реакции, проведенной при постоянной температуре и постоянном давлении.
Термодинамическая система – часть пространства, выделенная из внешней среды существующей или воображаемой границе раздела, занимающ. определенный объем, в которой возможен тепло и массообмен между её составными частями.
Параметры: pV=νRT
Функции состояния: ∆Н-изменение энтальпии, S-энтропия, ∆G-энергия Гиббса
Первый закон термодинамики утверждает, что сумма изменения внутренней энергии(∆U) и совершенной системой (или над нею) работы (A) равна сообщенной (или выделенной ею) теплоте(Q): Q=∆U+A
5. Закон Гесса: Тепловой эффект реакции зависит только от начального и конечного состояния веществ и не зависит от промежуточных стадий процесса.
следствие закона Гесса: тепловой эффект химической реакции равен сумме теплот образования получающихся веществ за вычетом суммы теплот образования исходных веществ.
закон Лавуазье-Лапласа (1783г.), согласно которому: тепловые эффекты химической реакции, протекающих в прямом и обратном направлении, равны по величине и противоположны по знаку.
6. Направление, в котором произвольно протекают хим. реакции характеризуется совместным действием двух факторов: 1) тенденция перехода сис-мы в состояние с наим. внутренней энергией – энтальпийный фактор 2) тенденция к достижению наиб. упорядоченного состояния – энтропийный фактор.
Энтропия(S) – параметр, характеризующий меру беспорядка хим. сис-мы.
S=klgW, где к — коэффициент Больцмана, W – термодинамическая вероятность данного состояния системы.
Энтропия увеличивается при переходе вещества из тв. в жид., из жид. в газ, при расширении газов, при растворении кристаллов. Все процессы, в результате которых упорядоченная система возрастает, сопровождается уменьшением энтропии.
2-й закон термодинамики: В изолированной системе возможен только один самопроизвольный процесс, в котором изменение энтропии увеличивается
7. Энергия Гиббса связана с энтальпией, энтропией и температурой соотношением:
G=H-TS
Для изотермических реакций, протекающих при постоянном давлении, такой функцией является энергия Гиббса G , называемая также изобарно-изотермическим потенциалом, изобарным потенциалом или свободной энергией при постоянном давлении.
Уравнение Гиббса: ∆G=∆Н-T∆S
Возможность протекания хим. р-ции:
нормальные условия
если ∆G<0 – хим. реакция протекает
если ∆G>0 – не протекает
повышение или понижение температуры
∆G<0 – протекает при заданной температуре
∆G>0 – не протекает
∆G=0 – момент начала х.р.
8. Раздел химии, изучающий скорости химических реакций, называется химической кинетикой.
При рассмотрении вопроса о скорости реакции необходимо различать реакции, протекающие в гомогенной системе (гомогенные реакции), и реакции, протекающие в гетерогенной системе (гетерогенные реакции).
Скоростью гомогенной реакции называется количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени на единице объема системы.
Факторы, влияющие на скорость хим. реакции:
1)природа реагир. в-ва
2)температура
3)концентрация
4)наличие катализатора
5)внешние воздействия
6)для тв. в-в площадь пов-ти соприкосновения реагир. в-в
законе действия масс:
При постоянной температуре скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, причем каждая концентрация входит в произведение в степени, равной коэффициенту, стоящему перед формулой данного вещества в уравнении реакции.
правило
Вант-Гоффа:![]()
Скорость хим. реакции увеличивается в 2-5 раз при увеличении температуры на 10 градусов.
9. 1.Протекание хим. реакции возможно в результате столкновения между реагирующими частицами.
2.Каждое столкновение может приводить к реакции только в том случае, если его энергия превосходит некую мин. энергию, которая явл. достаточной для разрыва хим. связей – энергия активации.
энергия активации – минимум энергии, который необходим для реагирования всех молекул одного моля в-ва.
Избыточная энергия, которой должны обладать молекулы для того, чтобы их столкновение могло привести к образованию нового вещества, называется энергией активации данной реакции. Энергию активации выражают в кДж/моль.
Уравнение Аррениуса. K = K0e(-Ea/RT), K – константа скорости реакции, K0 – предэкспотенциальный множитель, e – это e. Ea – энергия активации.
Если при изменении температуры, концентрация реагентов остаётся постоянной то:
V = V0exp[-Ea/(RT)]
Ea/(2,3RT)=lgk/(1/T)
Энергия активации. Энергия необходимая для перехода вещества в состояние активированного комплекса.
10. Теория переходного состояния
Теория переходного состояния рассматривает реагирующие молекулы как единую систему. Она подробно исследует изменения геометрического расположения атомов в этой системе по мере того, как в ней происходит превращение реагентов в продукты. Геометрическое положение атомов в такой молекулярной системе называется конфигурацией. По мере того, как конфигурация реагентов превращается в конфигурацию продуктов, происходит постепенное возрастание потенциальной энергии системы до тех пор, пока она не достигнет максимума. В момент достижения максимума энергии молекулы имеют критическую конфигурацию, которая называется переходным состоянием или активированным комплексом. Достичь этой критической конфигурации способны лишь те молекулы, которые обладают достаточной полной энергией. По мере того, как конфигурация этого переходного состояния превращается в конфигурацию продуктов, происходит уменьшение потенциальной энергии (рис. 9.12). Координата реакции на этих двух диаграммах представляет изменения в геометрическом расположении атомов реагирующих молекул, рассматриваемых как единая система, по мере того, как эта система испытывает превращение, начинающееся с конфигурации реагентов, переходящее в критическую конфигурацию и завершающееся конфигурацией продуктов. Если в реакции образуются интермедиаты, то возникновению каждого интермедиата соответствует минимум на графике зависимости потенциальной энергии от координаты реакции (рис. 9.13).
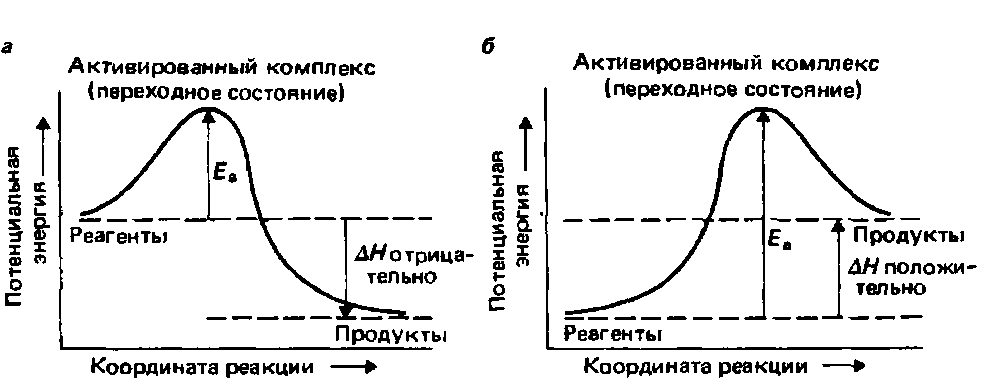
Рис. 9.12. Энергетический профиль реакции - график зависимости потенциальной энергии от координаты реакции, а - для экзотермической реакции; б - для эндотермической реакции.
Теория переходного состояния может использоваться для прогнозирования постоянных А и Еа в уравнении Аррениуса. Использование этой теории и современной вычислительной техники позволяет устанавливать точную картину протекания химических реакций на молекулярном уровне.
11.В случае гетерогенных реакций в выражение константы равновесия, так же как и в выражение закона действия масс входят концентрации только тех веществ, которые находятся в газовой или жидкой фазе. Например, для реакции
СО2 + С==2СО
константа равновесия
имеет вид:![]()
Величина константы равновесия зависит от природы реагирующих веществ и от температуры. От присутствия катализаторов она не зависит.
Количественной характеристикой химического равновесия служит величина, называемая константой химического равновесия.
Способы нарушения хим. равновесия:
1)изменение концентрации реаг. в-в
2)измен. температуры
3)измен. Давления (использ. для газообразных в-в)
принципа Ле Шателье:
Если на систему, находящуюся в равновесии, оказать какое-либо воздействие, то в результате протекающих в ней процессов равновесие сместится в таком направлении, что оказанное воздействие уменьшится.
12. Катализ.
Явление изменения скорости реакции под действием таких веществ называется катализом.
Вещества, не расходующиеся в результате протекания реакции, но влияющие на ее скорость, называются катализаторами.
В большинстве случаев действие катализатора объясняется тем, что он снижает энергию активации реакции. В присутствии катализатора реакция проходит через другие промежуточные стадии, чем без него, причем эти стадии энергетически более доступны. Иначе говоря, в присутствии катализатора возникают другие активированные комплексы, причем для их образования требуется меньше энергии, чем для образования активированных комплексов, возникающих без катализатора. Таким образом, энергия активации реакции понижается; некоторые молекулы, энергия которых была недостаточна для активных столкновений, теперь оказываются активными. Соотношения между энергиями активации реакции в присутствии катализатора и без него показаны на рис. 66. Из рис, 66 ясно, что катализатор снижает энергию активации прямой и обратной реакции на одну и ту же величину. Отсюда следует, что катализатор в одно и то же число раз ускоряет и прямую, и обратную реакции.
Св-ва катализаторов:
катализатор изм. скорость тех реакций, которые идут.
катализаторы обладают селективностью, т.е. ускорять только одно из числа всех возможных реакций.
катализаторы исп. в пром-ти и обладают высокой каталитической активностью, механ. прочностью и термостойкостью.
Вещества, не расходующиеся в результате протекания реакции, но влияющие на ее скорость, называются катализаторами.
Ингибитор – в-во, замедляющее хим. р-цию.
Механизм действия ингибитор: Действие обусловлено снижением скорости р-ции за счет увеличения энергии активации. Образование с ионами металлов труднорастворимых комплексных соединений образ. защитную пленку на поверхности металла.
Механизм действия катализатора: Все каталитические р-ции – самопроизвольные процессы. Катализаторы не смещают хим. равновесие, т. к. в равной степени ускоряют и прямую, и обратную р-цию.
13. СОСТАВ КОНТАКТНЫХ МАСС
В основном контактные массы — это сложные системы, состоящие из ряда компонентов, каждый из которых несет свою функциональную нагрузку. Однако в целом активность катализатора не есть аддитивная величина двух или нескольких соединений, а может принимать экстремальные значения, соответствующие определенным свойствам системы в целом. Причем последняя окончательно формируется под действием реакционной среды. Исследования, проведенные рядом ученых в области катализа, показали, что под действием реакционной среды устанавливается химический состав, характеризуемый определенной активностью, которая подчас не находится в прямой зависимости от исходного состояния контактной массы.
14. Практическое поведение промышленных катализаторов связано с основными их технологическими характеристиками:
активностью, производительностью, температурой зажигания, селективностью (избирательным действием), износоустойчивостью, отравляемостью и т.п. Основной характеристикой катализаторов служит их активность, т.е. мера ускоряющего действия катализатора по отношению к данной реакции.
Чем активнее катализатор, тем при относительно меньшей температуре можно вести процесс, что дает значительные преимущества, как экономические, так и технологические. От активности твердых катализаторов зависит их температура зажигания, т.е. та минимальная температура реагирующих
веществ, при которой катализатор «работает», т.е. увеличивает скорость реакции в достаточной для практики мере.
15. Дисперсные системы. Состав. Классификация по размеру частиц. ДС яв-ся гетерогенными. Они состоят из сплошной и непрерывной фазы – дисперсионной среды. И находящихся в этой среде раздробленных частиц того или иного размера и формы – дисперсной фазы. Поскольку дисперсная фаза нах-ся в виде отдельных небольших частиц, то дисперсные системы в отличие от гетерогенных со сплошными фазами наз-ют микрогетерогенными, а коллоиднодисперсные системы наз-ют также ультромикрогетерогенными, чтобы подчеркнуть, что в этих системах граница раздела фаз не может быть обнаружена в световом микроскопе. Обязательным условием получения дисперсных систем яв-ся взаимная нерастворимость диспергируемого вещ-ва и дисперсионной среды. Количественной характеристикой дисперсности вещ-ва яв-ся степень дисперсности – величина обратная размеру дисперсных частиц. D=1/L D – степень раздробленности, L – размер дисперсных частиц. Если все частицы дисперсной фазы имеют одинаковые размеры, то такие системы наз-ют монодисперсными. Частицы дисперсной фазы неодинакового размера образуют полидисперсные системы.
16. Раствор – термодинамичноустойчивая гомогенная система, состоящая из двух или нескольких компонентов.
Особенности растворов:
1)это гомогенные системы
2)при образовании раствора либо выделяется либо поглощается теплота
3)объем полученного раствора не равен сумме объемов исходных в-в
4)в-ва в р-ре сохр. свои индивид. св-ва
Классификация р-ов:
1)твердые в-ва
2)жидкие р-ры
3)газообр. р-ры(газовые смеси)
концентрация р-ов:
1)Массовая
доля р-енного в-ва:
![]()
Она показывает сколько граммов растворенного в-ва содержится в 100г р-ра.
2)молярная
концентрация:
![]()
Она показывает сколько молей растворенного в-ва содержится в 1л р-ра.
3)эквивалентная
концентрация:![]()
Она показывает сколько эквивалентов растворенного в-ва содержится в 1л р-ра.
4)Моляльная
конц.:
![]()
Она показывает число молей растворенного в-ва, которое приходится на 1кг растворителя.
5)мольная
доля:
![]()
эквивалентная концентрация:
Она показывает сколько эквивалентов растворенного в-ва содержится в 1л р-ра.
Закон эквивалентов для р-ров: объемы р-ров реагирующих в-в обратно пропорциональны их нормальностям.
![]()
![]() эквивалентная
концентрация реагир. в-в.
эквивалентная
концентрация реагир. в-в.
![]() объемы
реаг. в-в.
объемы
реаг. в-в.
17.При приготовлении раствора происходит(когда растворитель жидкость а раств. в-во твердое:
1. Разрушение кристаллической решетки
2. Образование вокруг частиц растворенного в-ва сольватных (гидратных) оболочек
Сольватация – это процесс взаимодействия частиц растворенного в-ва с молекулами раствора.
Eсольв < 0 – экзотермическая реакция
Тр = Нр = Нх.р. + Н сольв
А)
Нх.р.>Нсольв.
![]() Нр>0-эндотермическая
реакция
Нр>0-эндотермическая
реакция
Б) Нх.р.<Нсольв. Нр<0- экзотермическая реакция
Ж![]() Ж
Нх.р=0
Ж
Нх.р=0
Г Ж Нх.р=0
18. Рассчитываемые величины
Росм=См*R*Т
Тзам=Кк*См
Ткип=Кэ*См
Экспериментальные
Росм=i*См*R*Т
Тзам=i*Кк*См
Ткип=i*Кэ*См
Экспериментальная величина
i = ---------------------------------------- изотонический коэффициент
Расчитываемая величина
BaCl2 i=3
NaCl i=2
Осмос- односторонняя диффузия молекул растворителя через полупроницаемую перегородку(мембрану) в раствор
Осмотическое давление- это давление, которое нужно приложить к концентрированному раствору, чтобы воспрепятствовать переносу растворителя через мембрану.
Каллигативные св-ва - это св-ва которые определяются только концентрацией растворенного в-ва и не зависят от химического состава раствора
Закон Рауля. Температура кипения раствора выше температуры кипения растворителя.
Tкип=KэCm
Температура кристализации раствора ниже температуры кристализации чистого растворителя.
Tзам=KкCm
19.Произведение растворимости- это произведение концентрации ионов, которые образуют при диссоциации малорастворимых в-в в степенях равных стехиометрических коэффициентов
Условие образования осадка – это превышения произведения концентрации ионов в растворе в степенях равных стехеометрическим коэффициентам над произведением растворимости.
Произведение растворимости: в насыщенном растворе электролита произведение концентраций его ионов ест величина постоянная при данной температуре. Эта величина количественно хар-ет способность электролита растворяться. Ее наз-ют произведением растворимости электролита, обозначают буквами ПР и представляет собой константу равновесия гетерогенной системы, состоящей из твердой фазы малорастворимой соли и ее насыщенного раствора. Произведением растворимости наз-ся произведение активности ионов в насыщенном растворе малорастворимого соединения. ПР, вычисленное без учета коэффициентов активности яв-ся постоянной величиной только для малорастворимых электролитов.
20. Электролитическая диссоциация- явление распада молекул на ионы
Основные положения:
1. Молекулы электролита при растворении в воде большей или меньшей степени диссациируют в воде.
Каждое в-во дает два типа ионов
-
катионы
![]()
-анионы
![]()
2. Ионы в растворе электролита движутся беспорядочно под действием постоянного электрического тока. Положительно заряженные ионы при электролизе движутся к отрицательно заряженному катоду, отрицательно заряж. частицы движутся к положит. аноду и называются анионами.
3.Процесс диссоциации является обратимым т.е. наряду с диссоциацией молекул на ионы происходит процесс образования молекул из ионов - ассоциация
Изотонический коэффициент: ИК показывает во сколько раз осмотическое давление данного раствора больше нормального: π=iсвRT. Коэффициент i определяется для каждого раствора экспериментальным путем, например, по понижению давления пара или по понижению температуры замерзания, или по повышению температуры кипения. Поскольку и осмотическое давление, и изменение температур замерзания и кипения пропорциональны числу находящихся в растворе частиц растворенного вещества, то коэффициент i можно выразить отношениями: i = π//π=ΔT/k/ΔTk=ΔT/3/ΔT3.
