
- •10. Теория переходного состояния
- •21. Ступенчатая диссоциация электронов
- •28. Комплексные соединения. Основные положения теории Вернера. Тип химической связи в комплексных соединениях.
- •29. Диссоциация комплексных соединений в водных растворах (типы диссоциации, ступени диссоциации). Привести примеры.
- •33. Электрохимические процессы. Механизм возникновения тока в гальваническом элементе. Устройство и принцип работы медно-цинкового гальванического элемента (Якоби-Даниэля).
- •34. Стандартный электродный потенциал. Уравнения Нернста. Эдс гальванического элемента.
- •37. Электрохимическая коррозия: классификация, условия протекания.
- •38. Атмосферная коррозия
- •Виды атмосферной коррозии
- •Особенности протекания атмосферной коррозии металлов
- •Уравнение атмосферной коррозии:
- •Свойства лакокрасочных материалов
- •Свойства лакокрасочных покрытий
- •Виды лакокрасочных материалов (лкм)
- •Состав лакокрасочных материалов
- •Классификация лакокрасочных материалов
- •42. Электролиз. Схема электролизной установки. Причины электролиза. Анод. Катод. Их заряды при электролизе.
- •54. Химическая связь.
- •Методы умягчения воды
- •70. Двенадцать принципов зелёной химии
- •Основные промышленные группы полимеров, синтезируемых поликонденсацией
21. Ступенчатая диссоциация электронов
Электролиты с многозарядными катионами и анионами дисоциир. ступенчато кроме нормальных солей. Константы дисоции. Каждой ступени значительно отличаются от константы дис . предыдущей ступени
Кислоты
1
![]()

2
![]()

Kдис1![]() Kдис2
Kдис2
Диссоциация снований:
![]()
![]()
Кислых солей:
![]()
![]()
Основные соли:

Реакции ионного обмена в растворах электролитов:
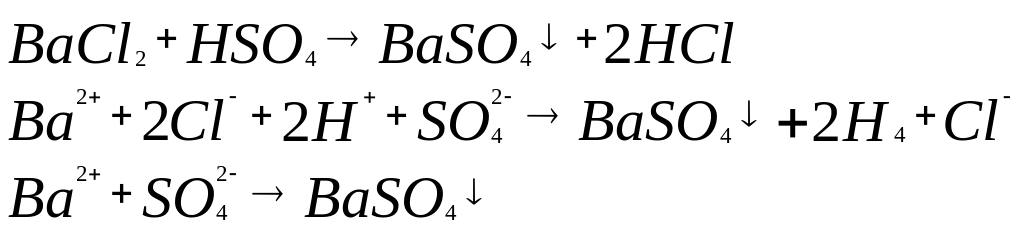
22. Сильные электролиты- это электролиты которые практически полностью дисациируют в водных растворах т.е.в растворах практически нет молекул только ионы
Гидроксиды щелочных и щелочно- земельных металлов
Сильные кислоты HNO3,H2SO4,HCl
Большинство солей
Закон действующих масс не применим для сильных электролитов.
Активность а=См*f
![]()
f- коэффициент активности зависит от:
Концентрации р-ра
Состава р-ра
Заряда и природы иона
В сильноразбавленных р-рах с концентрацией См<<0.5 коэффициент f мало зависит от природы иона, а зависит от заряда иона Z и ионной силы р-ра
I- ионная сила р-ра
![]()
Для соотв. р-ров электролита
![]()
23. Слабые электролиты –это э-ты которые диссоциируют в р-рах не полностью, а частично т.е. наряду с ионами в растворе присутствует молекулы электолитов(некоторые кислоты Н2S,Н2SO3,H2CO3,HCN,NH4OH
NH4OH![]()
![]() --закон
действующих масс
--закон
действующих масс
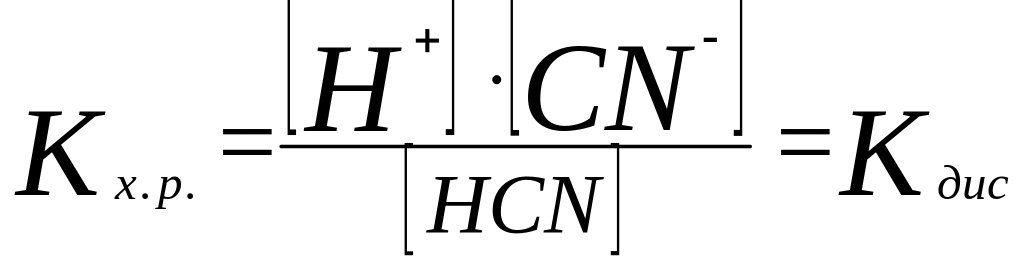 -константа
химического равновесия применимая к
процессу
диссоциации
-константа
химического равновесия применимая к
процессу
диссоциации
![]() (степень диссоциации)-
это число которое показывает какая
часть электролита подверглась дисоц.
т.е. отношение числа молекул растворившихся
на ионы к общему числу молекул электролита
в растворе.
(степень диссоциации)-
это число которое показывает какая
часть электролита подверглась дисоц.
т.е. отношение числа молекул растворившихся
на ионы к общему числу молекул электролита
в растворе.
Степень диссоциации зависит:
Природа электролита
Концентрации электролита(чем больше концентрация р-ра тем меньше степень дисац.
Закон разбавления
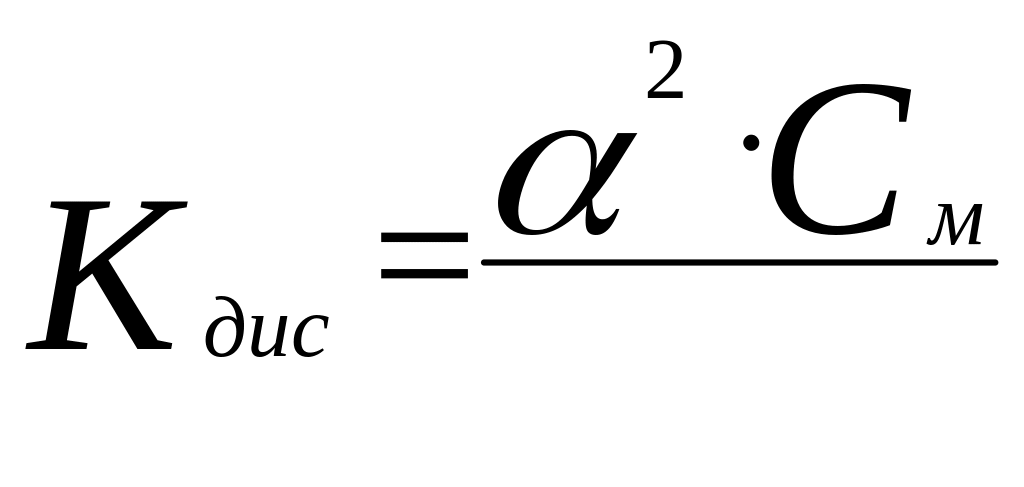
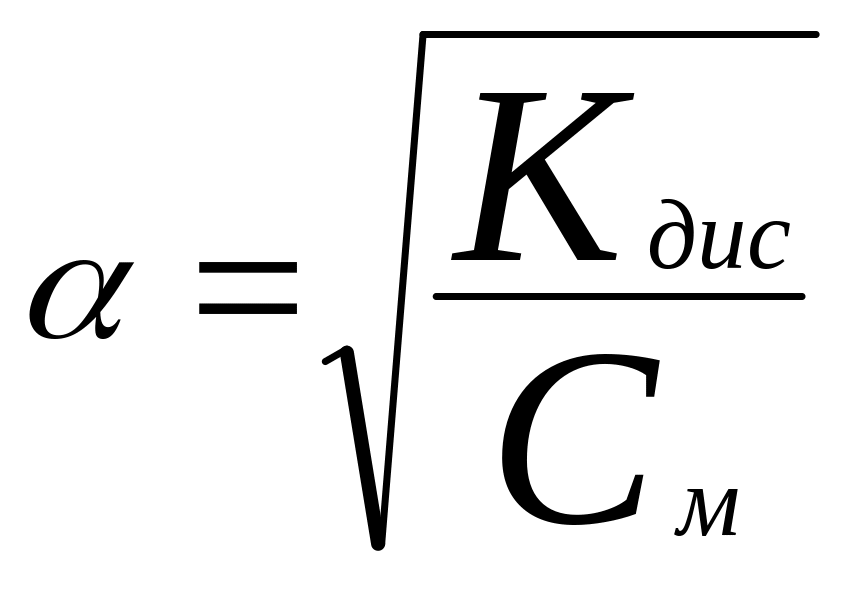
24.
Чистая вода очень плохо проводит
электрический ток, но все же обладает
измеримой электропроводностью, которая
объясняется небольшой диссоциацией
воды на ионы водорода и гидроксида
![]()
Для
воды и разбавленных водных растворов
при неизменной температуре произведение
концентрации ионов водорода и гидроксила
есть величина постоянная - ионное
произведение воды
![]()
Водородный
показатель
– десятичный логарифм концентрации
ионов водорода, взятый с обратным
знаком![]() ,
гидроксильный показатель
,
гидроксильный показатель
рОН=
- lg![]()
25-26. Гидролиз солей- это нарушение ионного равновесия воды ионами соли которые приводят к образованию слабых электролитов т.е. малодиссоциирующих в-в и изменению РН среды.
Гидролиз солей обр-ных слабой кислотой и сильным основанием:
Данный гидролиз идет по аниону, р-ция р-ра щелочная
КОН - сильное основание
НСN – слабая кислота
КСN+НОН=КОН+НСN
![]()
![]()
Слабый электролит, среда щелочная РН>7
Гидролиз солей обр-ных сильной кислотой и слабым основанием:
Гидролиз идет по катиону реакция рас-ра кислая
NH4OH- слабое основание
HCl- сильная кислота
NH4Cl+HOH=NH4OH+HCl
![]()
![]()
Слабый электролит, среда кислая РН<7
Гидролиз солей обр-ных слабой кислотой и слабым основанием:
Данный гидролиз идет по катиону и аниону, р-ция р-ра может быть нейтральная щелочная кислая
NH4OH- слабое основание
HCN- слабая кислота
NC4CN+HOH=NH4+HCN
![]()
![]()
РН среды зависит от силы слабого электр. и показат. среды слаб. электр явл констант диссоциации
27.Константа гидролиза зависит от:
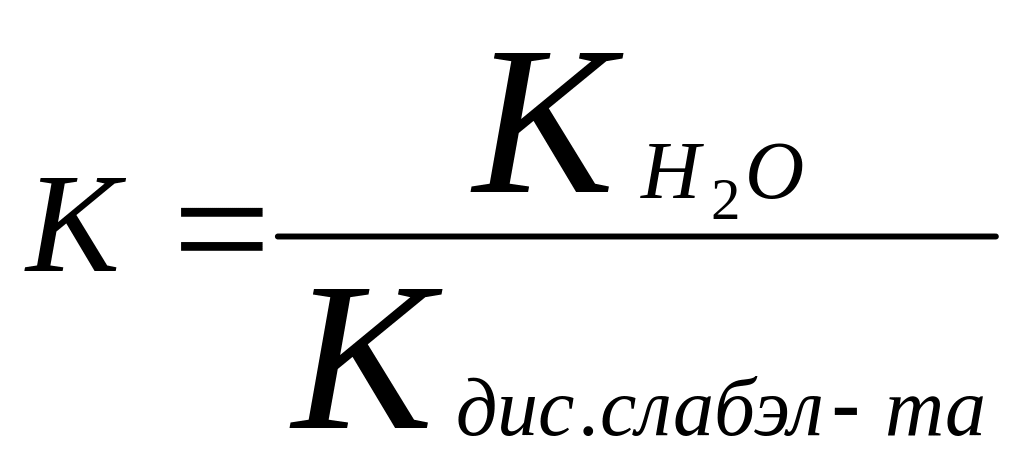
соль - сильная кислота + сильное основание
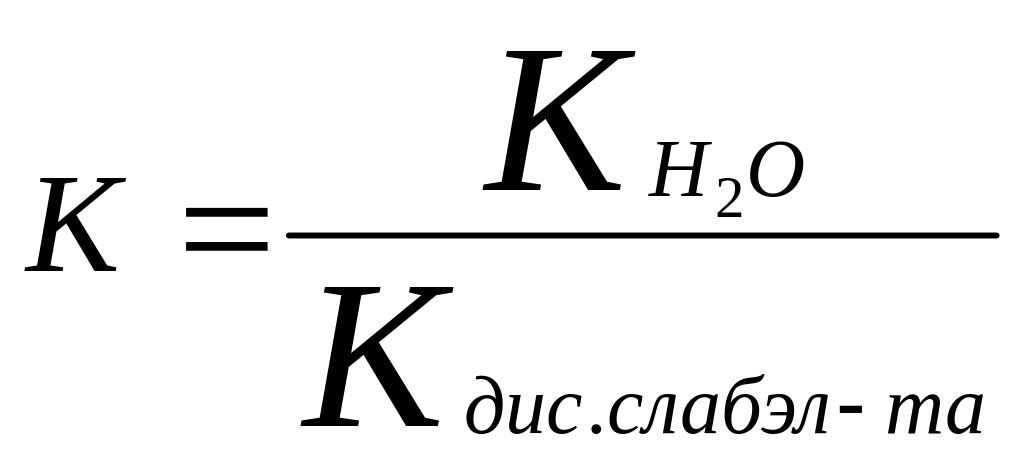
2. соль - слабое основание + сильное основание
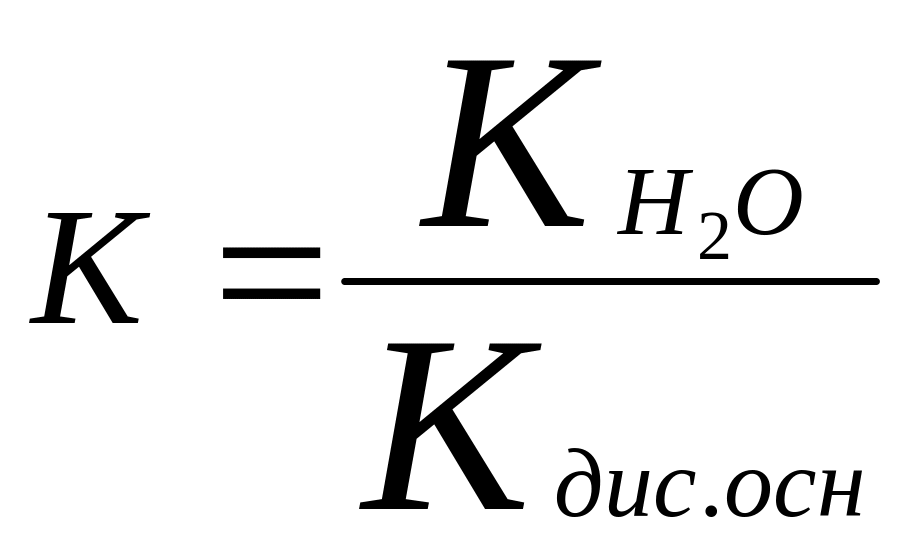
3. соль- слабая кислота+ слабое основание
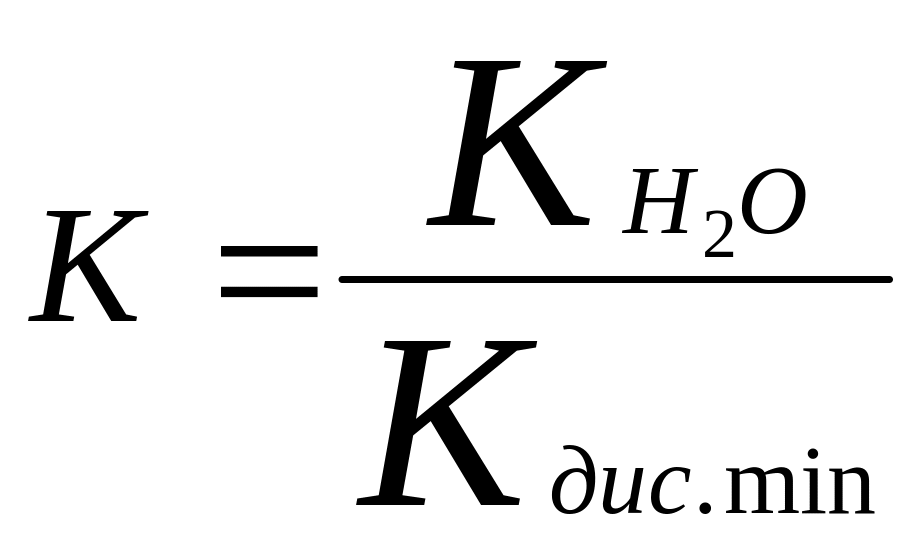
Степень гидролиза- это отношения числа малекул подвергнутые гидролизу к общему числу малекул
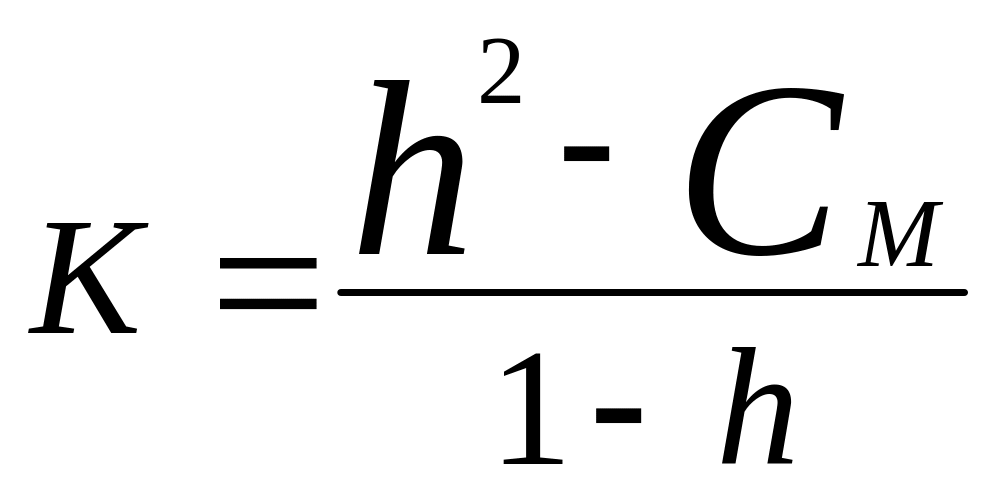 ,
1-h
min ~1
,
1-h
min ~1
К=![]()
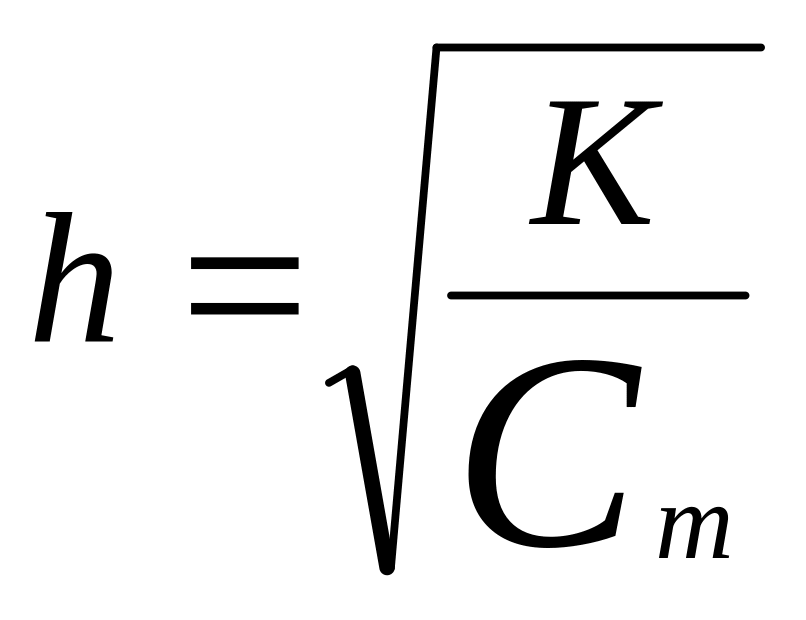
Степень гидролиза зависит:
от температуры с увелечением t гидролиз усиливается
от концентрации растворов с уменьшением См степень гидролиза выше
от силы слабого электролита
