
- •10. Теория переходного состояния
- •21. Ступенчатая диссоциация электронов
- •28. Комплексные соединения. Основные положения теории Вернера. Тип химической связи в комплексных соединениях.
- •29. Диссоциация комплексных соединений в водных растворах (типы диссоциации, ступени диссоциации). Привести примеры.
- •33. Электрохимические процессы. Механизм возникновения тока в гальваническом элементе. Устройство и принцип работы медно-цинкового гальванического элемента (Якоби-Даниэля).
- •34. Стандартный электродный потенциал. Уравнения Нернста. Эдс гальванического элемента.
- •37. Электрохимическая коррозия: классификация, условия протекания.
- •38. Атмосферная коррозия
- •Виды атмосферной коррозии
- •Особенности протекания атмосферной коррозии металлов
- •Уравнение атмосферной коррозии:
- •Свойства лакокрасочных материалов
- •Свойства лакокрасочных покрытий
- •Виды лакокрасочных материалов (лкм)
- •Состав лакокрасочных материалов
- •Классификация лакокрасочных материалов
- •42. Электролиз. Схема электролизной установки. Причины электролиза. Анод. Катод. Их заряды при электролизе.
- •54. Химическая связь.
- •Методы умягчения воды
- •70. Двенадцать принципов зелёной химии
- •Основные промышленные группы полимеров, синтезируемых поликонденсацией
28. Комплексные соединения. Основные положения теории Вернера. Тип химической связи в комплексных соединениях.
Комплексные соединения – это соединения высшего порядка, которые сопровождаются возникновением новых ионов, достаточно устойчивых в водных соединениях.
Основные положения теории Вернера:
Большая часть хим. элементов может выступать в качестве комплексообразователя, проявляя два типа валентности: основную (соотв. Степени окисления), побочную ( координац. числу ).
Комплексообразователь стремится к насыщению и главной и побочной валентности.
Главная насыщается только ионами, а побочная анионами и нейтр. молекулами.
КС характеризуются определенной геометрической формой
В КС обязательно присутствует донорно-акцепторная связь.
Донорно-акцепторная связь – это реакция
![]() :А
+ В → А : В
:А
+ В → А : В
донор акц. д/а связь
осуществляемая за счет неподельной пары электронов одной частицы и свободной орбитали другой частицы.
![]()
д/а связь ион. связь
Строение комплексных соединений: комплексообразователь, лиганды, координационное число и т.д. на конкретном примере.
Строение КС.
![]() -противоион
(ион внешней сферы), 4-кол-во. Лиганд,
-противоион
(ион внешней сферы), 4-кол-во. Лиганд,![]() -лиганды.
-лиганды.
![]() -компл.
обр-ль.
-компл.
обр-ль.
В центре молекулы КС находится центральный атом – комплексообразователь. Вокруг компл-образов. Координируются лиганды. Анионы или нейтр. малекулы связаны с компл-образ. д/а связью. Размер леганд значительно меньше чем размер компл-образ. Лиганды выступают в качестве доноров электронов. Общее кол-во. леганд назыв. координационным числом компл-образов.
Его величина зависит: От заряда и радиуса компл-образ. Чем эти величины больше, тем больше леганд может разместится возле компл-образ. от заряда и радиуса лиганд и чем менше эти показатели тем больше лиганд может принять компл-образ. Компл-образ. и лиганды образуют комплексный ион устойчивый в водных растворах.
29. Диссоциация комплексных соединений в водных растворах (типы диссоциации, ступени диссоциации). Привести примеры.
Диссоциация КС протекает в 2 ступени:
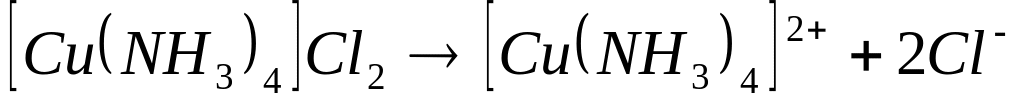 ;
;
 - катион
- катион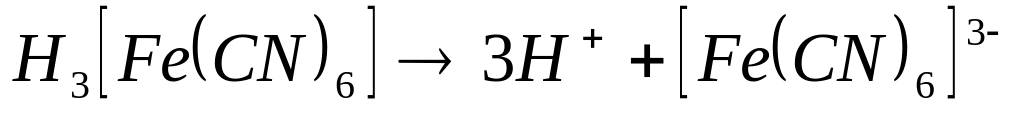 ;
;
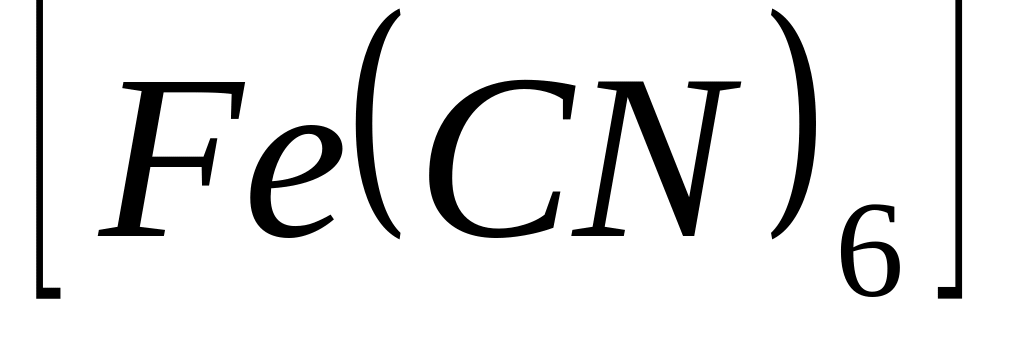 -
катион
-
катион
На 1-ой ступени в водных растворах происходит полная 100% диссоциация комплексных соединений по ионам. Данный ионный процесс не обратим.
На 2-ой ступени диссоциирует комплексный ион по типу слабых электролитов т.е. данный процесс обратим.
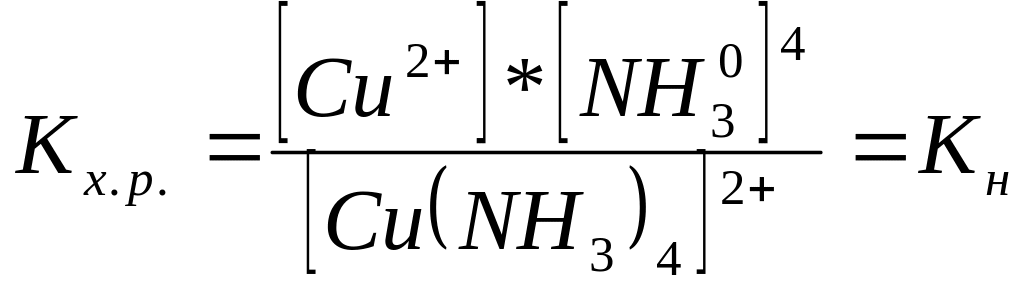 ;
;
![]() ,
,
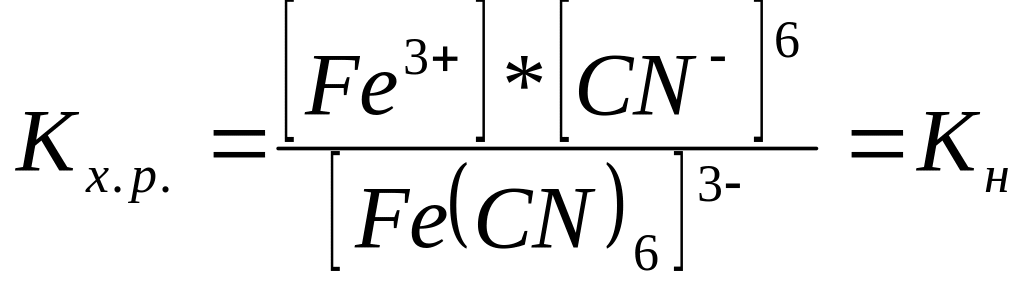 ;
;
Диссоциация комплексных соединений в водных растворах. Константа нестойкости комплексного иона.
Диссоциация КС протекает в 2 ступени:
; - катион
; - катион
На 1-ой ступени в водных растворах происходит полная 100% диссоциация комплексных соединений по ионам. Данный ионный процесс не обратим.
На 2-ой ступени диссоциирует комплексный ион по типу слабых электролитов т.е. данный процесс обратим.
;
,
![]() -константа
нестойкости компл. иона.
-константа
нестойкости компл. иона.
; -это мера стабильности комплексного иона в водных растворах. Чем больше константа нестойкости тем менее устойчив комплексный ион.
Константы нестойкости для различных комплексных ионов весьма различны и могут служить мерой устойчивости комплекса.
Номенклатура комплексных соединений. Названия комплексных соединений. Особенности химических реакций комплексных соединений.
Название комплексного аниона начинают с указания состава внутренней сферы.
Во
внутренней сфере прежде всего называют
анионы, прибавляя к их латинскому
названию окончание «о». Например: Сl--
хлоро,
![]() —
циано
Далее
называют нейтральные лиганды.
Число
лигапдов указывают греческими
числительными: 1—моно
(часто
не приводится), 2
— ди, 3 — три, 4
— тетра,
5
— пента,
6—гекса.
Затем
называют комплексообразователь,
используя корень его латинского
названия и окончание ат,
после
чего римскими цифрами указывают (в
скобках) степень окисленное
комплексообразователя. После обозначения
состава внутренней сферы называют
внешнесферные катионы. Если центральный
атом входит в состав катиона, то используют
русское название элемента и в скобках
указывают его степень окисленности.
Приведем примеры:
—
циано
Далее
называют нейтральные лиганды.
Число
лигапдов указывают греческими
числительными: 1—моно
(часто
не приводится), 2
— ди, 3 — три, 4
— тетра,
5
— пента,
6—гекса.
Затем
называют комплексообразователь,
используя корень его латинского
названия и окончание ат,
после
чего римскими цифрами указывают (в
скобках) степень окисленное
комплексообразователя. После обозначения
состава внутренней сферы называют
внешнесферные катионы. Если центральный
атом входит в состав катиона, то используют
русское название элемента и в скобках
указывают его степень окисленности.
Приведем примеры:
![]() - тетрацианодиаммииферрат(Ш)
калия
- тетрацианодиаммииферрат(Ш)
калия
![]() -
тетрахлородигидроксоплатинат(IV)
аммония
-
тетрахлородигидроксоплатинат(IV)
аммония
Двойные соли. Диссоциация двойных солей в водных растворах.
Некоторые комплексные соединения обладают очень высоким значением константы нестойкости, поэтому при растворении комплексный ион подвергается ионной диссоциации на все образующие их ионы – это и есть двойные соли.
![]()
30. Окислительно-восстановительные реакции - это химические реакции, протекающие с изменением степени окисления одного или нескольких элементов входящих в состав реагирующих веществ.
Окисление – процесс отдачи электронов
![]()
Восстановление – процесс присоединения электронов
![]()
Степень окисления – это заряд, который приобрел бы атом если бы все электронные пары химических соединений сместились бы в сторону атомов более электроотрицательных элементов. Это безразмерная величина и может быть равна 0.
Правило расставления степени окисления:
1-ое
правило: Степень окисления элемента в
простом веществе равна 0 (![]() )
)
2-ое
правило: Молекула химического соединения
электронейтральна. Это значит сумма
степеней окисления всех элементов=0 (![]() (+1)*2+6+4*(-2)=0
(+1)*2+6+4*(-2)=0
3-ое правило:
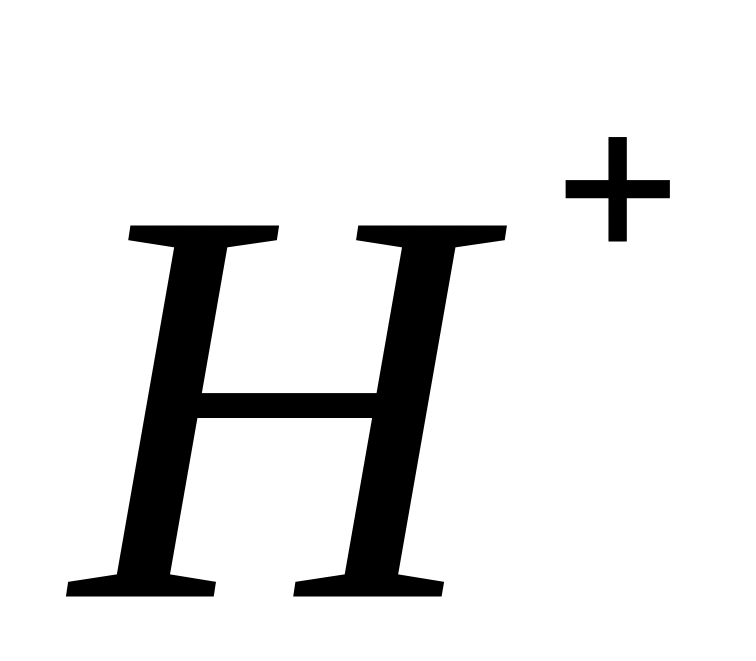 (исключение гидриды
металлов
(исключение гидриды
металлов
 )
)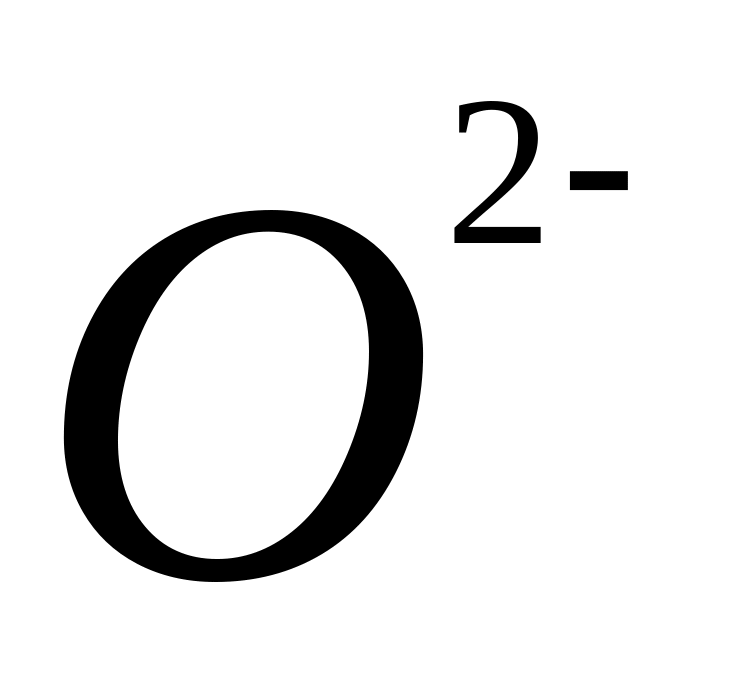 (исключение
пероксиды
(исключение
пероксиды
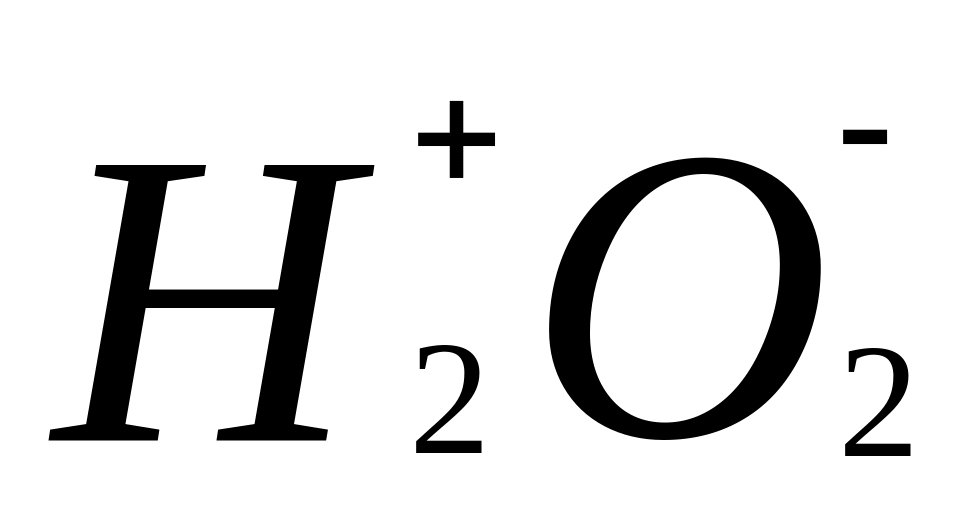 )
)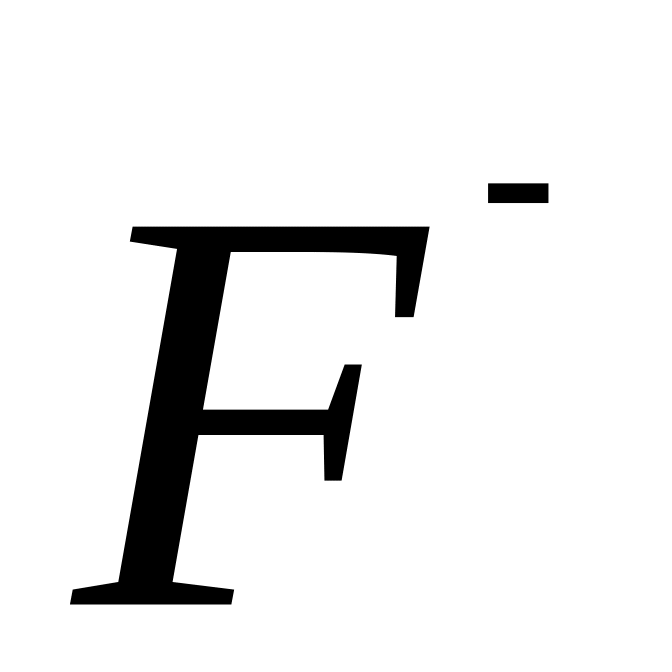 -всегда
-всегдащелочные металлы 1 группы С/О +1
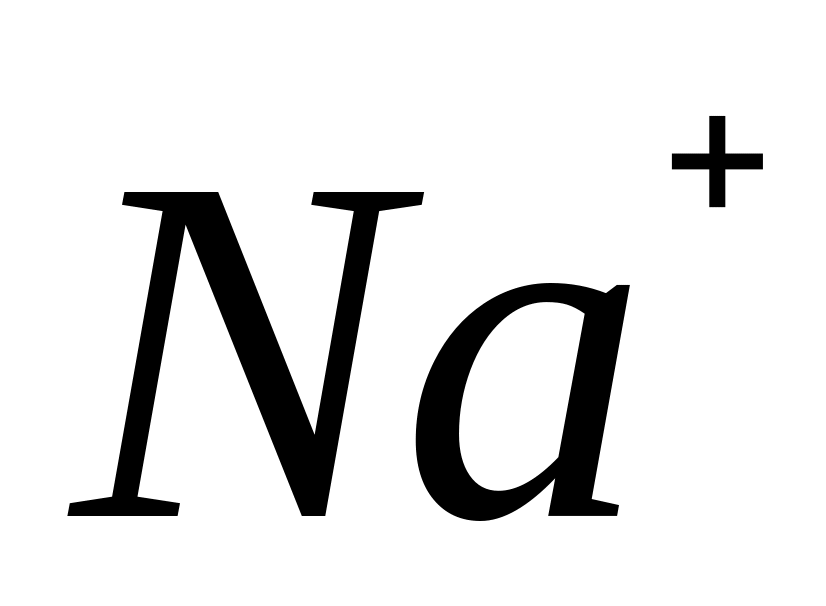
щелочные металлы 2 группы С/О +2

все металлы имеют положительную степень окисления
высшая положительная степень окисления равна номеру группы элемента (искл. F, Ne, He, Ag, O2 элементы подгруппы Co и Ni у них степень окисления больше номера группы)
большинство элементов период системы имеют несколько степеней окисления
![]()
31. Окисление – процесс отдачи электронов
Важнейшие окислители:
О2
типичные металлы в виде простых в-в F2,I2,Br2,Cl2 элементы6,7 главной подгруппы
электрический ток на аноде при электролизе
сложные в-ва содержащие элементы в высших степенях окисления
пироксиды металлов H2,O2,O3
кислородосодержащие кислоты содержащие элементы в высших С/О и их соли
вода (морская вода)
некоторые оксиды металлов PbO2
ионы благородных металлов
Восстановление – процесс присоединения электронов
Важнейшие восстановители:
Н2, в виде простого в-ва
электрический ток на катоде
все металлы в виде простых в-в
бескислородные кислоты и их соли
в случае когда в ходе реакции образуются простые в-ва
СО и СО2
Соединения, содержащие элементы в низших степенях окисления
соли сернистой и азотистой кислот
гидриды щелочных металлов
32.
Классификация ОВР:
Межмолекулярное окисление, восстановление. В этих реакциях ок-ль и в-ль – разные в-ва
Компропорционирование, окислитель и восстановитель это разные в-ва, которые являются производными одного и того же элемента
Диспропорционирование одно в-во и ок-ль и в-ль оно является производным элементом промежуточной С/О только этот элемент меняет С/О
Внутримолекулярное одно в-во и ок-ль и в-ль но в ходе реакции меняют степень окисления несколько элементов. К ним относятся реакции термического разложения.
