
- •4. Качественный химический анализ. Основные понятия. Предмет и средства. Чувствительность, специфичность, селективность.
- •Типы аналитических реакций:
- •1. Микрокристаллоскопический
- •2. Капельный
- •5. Классификация катионов и анионов на группы. Аналитические группы катионов. Обзор реакций.
- •6. Количественный анализ. Предмет и методы.
- •7. Весовой анализ. Принципы и методы объемного анализа. Растворы в объемном анализе.
- •8. Метод нейтрализации. Кислотно-основные индикаторы. Смешанные индикаторы. Кривые титрования. Титрование в неводных средах.
- •9. Комплексометрия. Реакции, применяемые в комплексометрии. Кривые титрования. Этилендиаминтетрауксусная кислота, как реагент в комплексометрии.
- •10. Редоксметрия. Перманганатометрическое титрование. Иодометрическое титрование. Электроды в редоксметрии.
- •11. Физико-химические и физические методы анализа. Общая характеристика методов.
- •12. Методы адсорбционного фотометрического анализа.
- •13. Хроматографический анализ. Классификация методов.
- •Классификация методов хроматографии
- •14. Жидкостная адсорбционная, ионообменная хроматография. Хроматография в тонком слое. Гель-хроматография.
- •15. Спектральные методы исследования органических соединений (уф-, ик- и ямр-спектроскопия).
- •16. Электронная спектроскопия органических соединений (уф-спектроскопия).
- •17. Законы поглощения света веществом. Коэффициент молярной экстинции.
- •18. Спектры поглощения органических соединений.
- •19. Возможности электронной спектроскопии в установлении строения органических соединений.
- •20.Спектры испускания (флуоресценция, фосфоресценция.)
- •21. Действие ик-излучения на молекулы органических соединений. Возможности ик-спектроскопии при изучении органических соединений.
- •22. Спектроскопия ядерного магнитного резонанса. Ядерный магнитный резонанс (ямр) и условия его возникновения.
- •23. Масс-спектрометрия органических соединений. Происхождение масс-спектров (ионизация молекул органических соединений при бомбардировке электронами, лазерного излучения и др.).
- •24. Рентгеноструктурный анализ органических соединений. Преимущества и недостатки метода рентгеноструктурного анализа в исследовании органических соединений.
- •2) Что такое активность? Как связана активноть иона и его равновесная концентрация? Что такое ионная ила ратвора, коэффициент активности?
- •3.Что такое мольная доля?
- •4.Как формулируется закон действия масс? Что такое термодинамичекая канстанта равноввессия? Какие факторы влияют на ее величину?
- •6)Что такое условная константа равновесия? Какие факторы влияют на ее величину?
- •8) В чем суть условия материального баланса? Сформулируйте принцип решения уравнения материального баланса.
- •9. Что такое константа диссоциации и степень диссоциации.
- •11. Как влияет введение одно- и разноименных ионов на степень диссоциации слабого электролита?
- •2. Что такое окислитель, восстановитель, окисление и восстановление?
- •3. Что называется электродным потенциалом?
- •4. Как влияет ионная сила на величину электродного потенциала?
- •5. Как влияет рН среды на величину потенциала? Выведите формулу зависимости потенциала от рН для полуреакции, протекающей с участием ионов водорода или гидроксида.
- •6. Как определить направление реакции окисления-восстановления и полноту ее протекания?
- •8. Приведите примеры использования окислительно-восстановительных реакций для растворения малорастворимых соединений.
- •9. Назовите основные окислители и восстановители, используемые для разделения и обнаружения ионов. Напишите соответствующие полуреакции.
- •12. Почему избыток хлорид-ионов мешает обнаружению ионов марганца по реакции образования перманганата?
- •13. Почему не удается обнаружить ион марганца (II) действием окислителя на концентрированные растворы солей марганца (II) ?
- •14. Напишите реакции взаимодействия бромид- и иодид-ионов с хлорной водой и объясните, в какой последовательности они протекают.
- •15. В каких условиях нитрат-ион можно восстановить до: а) аммиака; б) нитрит-иона?
- •1.Какие системы называются гетерогенными? Приведите примеры.
- •2. Выведите формулу константы растворимости.
- •3. Как выражают константу растворимости для идеальных и реальных систем? От чего зависит величина константы растворимости для этих систем?
- •4. Как связаны термодинамическая, реальная и условная константы растворимости?
- •5. Как влияет одноименный ион на растворимость осадка?
- •6. Почему при выделении осадка следует избегать большого избытка осадителя?
- •7. Как влияют электролиты на растворимость осадка?
- •8. Что называется растворимостью и молярной растворимостью?
- •9. Выведите формулу для расчета растворимости соединения АmВn.
- •10. В каких случаях по величинам констант растворимости можно сравнивать растворимость малорастворимых соединений?
- •11. Сформулируйте условия образования и растворения осадка.
- •12. Как влияет температура на растворимость осадка?
- •13. Каковы причины растворимости малорастворимых соединений: а) в кислотах; б) в щелочах?
- •16. Как перевести сульфаты катионов II группы в карбонаты?
- •1. Дайте определение следующим понятиям: разделение, концентрирование, абсолютное и
- •2. Приведите примеры классификаций методов разделения и концентрирования. На чем они основаны?
- •3. Осаждение и соосаждение как методы разделения и концентрирования.
- •4. Перечислите факторы, от которых зависит коэффициент распределения.
- •5. Какие из перечисленных параметров (концентрация, рН раствора, маскирующие вещества, температура) влияют на значение коэффициента распределения?
- •8. В чём сущность методов экстракции? Какие задачи решаются с помощью этих методов?
- •10. Какие процессы определяют скорость экстракции?
- •11. Классификация экстракционных систем.
- •12. Назвать органические растворители, наиболее часто используемые в методах экстракции.
- •13. Назвать основные типы соединений, в виде которых экстрагируются ионы металлов. Привести примеры.
- •14. Каковы достоинства и недостатки методов экстракции?
- •15. В чем сущность методов хроматографии?
- •16. Как классифицируются методы хроматографии по агрегатному состоянию фаз; механизму процесса разделения; технике выполнения и по цели проведения?
- •18. Каковы области применения, достоинства и недостатки методов адсорбционной хроматографии?
- •19. В чём сущность метода ионообменной хроматографии?
- •20. Назвать основные типы ионитов. Что называется обменной ёмкостью ионита?
- •21. Каковы области применения, достоинства и недостатки метода ионообменной хроматографии.
- •22. Пояснить сущность метода осадочной хроматографии. Назвать варианты этого метода анализа.
- •23. На чём основан качественный анализ методами осадочной и распределительной хроматографии на бумаге?
- •24. Как количественно оценивают способность различных веществ к разделению на бумаге?
- •28. В чем сущность тонкослойной хроматографии?
- •29. Каковы преимущества тонкослойной хроматографии перед другими хроматографическими методами?
- •1.Что такое комплексное соединение
- •2. Какие факторы влияют на устойчивость комплексных соединений
- •3.Какие принципы могут быть положены в основу классификации комплексных соединений?
- •4. Назовите основные типы комплексных соединений. Приведите примеры.
- •5. Дайте определение следующим понятиям: комплексообразователь, лиганды, координационное число, дентатность лиганда, заряд комплексного иона.
- •6. Что называется внутрикомплексным соединением? Приведите примеры
- •7. Какие равновесия имеют место в растворах комплексных соединений? Как можно охарактеризовать эти равновесия?
- •8.Что такое ступенчатые и общие константы устойчивости комплексных соединений?
- •9.Дайте теоретическое обоснование возможности использования комплексных соединений для избирательного растворения и осаждения малорастворимых соединений.
- •10.Какие свойства комплексных соединений имеют наиболее важное значение для обнаружения и разделения ионов?
- •11. Приведите примеры использования реакций комплексообразования для растворения:
- •13. Приведите примеры использования реакций комплексообразования для маскирования мешающих ионов.
- •14. Приведите примеры использования реакций комплексообразования для идентификации ионов.
Основные понятия
Задачи и методы аналитической химии.
Аналити́ческая хи́мия — раздел химии, изучающий химический состав и структуру веществ; имеет целью определение элементов или групп элементов, входящих в состав различных веществ. Предмет её как науки — совершенствование существующих и разработка новых методов анализа, их практическое применение, исследование теоретических основ аналитических методов.
В зависимости от задания, аналитическая химия подразделяется на качественный анализ, нацеленный на определение того, что или какие вещества, в какой форме находится в образце, и количественный анализ, нацеленный на определение сколько данного вещества (элементов, ионов, молекулярных форм и др.) находится в образце.
Методы:
v Химические методы(Происходящее химическое превращение называется - аналитической реакцией, а вещество, его вызывающее, - реагентом.)
v Физические методы(Они основаны на измерении какого-либо параметра системы, который является функцией состава. Например, спектральный анализ, люминесцентный анализ.)
v Физико-химические методы(Из данных методов можно выделить колориметрический метод, основанный на зависимости интенсивности окраски раствора от концентрации окрашенного вещества (ионов или молекул), а также хроматографический метод.)
Можно отметить еще один метод - биологический, который использует отклик организмов на изменения в окружающей среде.
Понятие о химических, физических, физико-химических (инструментальных) методах анализа. Ионная сила раствора. Активность, коэффициент активности.
v Химические методы-в данных методах определяемый ион или элемент переводят в какое-либо соединение, обладающее теми или иными характерными свойствами, на основании которых можно установить, что образовалось именно это соединение. Происходящее химическое превращение называется - аналитической реакцией, а вещество, его вызывающее, - реагентом.
v Физические методы-Они основаны на измерении какого-либо параметра системы, который является функцией состава. Например, спектральный анализ, люминесцентный анализ.
v Физико-химические методы-Из данных методов можно выделить колориметрический метод, основанный на зависимости интенсивности окраски раствора от концентрации окрашенного вещества (ионов или молекул), а также хроматографический метод.
Можно отметить еще один метод - биологический, который использует отклик организмов на изменения в окружающей среде.
Ионная
сила раствора —
мера интенсивности электрического
поля,
создаваемого ионами
в растворе.
![]() ,гдеcB —
молярные
концентрации
отдельных ионов (моль/дм^3), zB
заряды ионов
,гдеcB —
молярные
концентрации
отдельных ионов (моль/дм^3), zB
заряды ионов
Активность компонентов раствора — эффективная (кажущаяся) концентрация компонентов с учётом различных взаимодействий между ними в растворе, то есть с учётом отклонения поведения системы от модели идеального раствора.
Отношение
активности (![]() )
к общей концентрации вещества в растворе
называетсякоэффициентом
активности:
)
к общей концентрации вещества в растворе
называетсякоэффициентом
активности: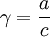
4. Качественный химический анализ. Основные понятия. Предмет и средства. Чувствительность, специфичность, селективность.
Качественный анализ имеет своей целью обнаружение определенных веществ или их компонентов в анализируемом объекте. Качественный анализ всегда предшествует количественному.
В настоящее время к. а. выполняют инструментальными методами: спектральными, хроматографическими, электрохимическими и др. К химическим реакциям в качественном анализе предъявляют следующие требования.
1. Реакция должна протекать практически мгновенно.
2. Реакция должна быть необратимой.
3. Реакция должна сопровождаться внешним эффектом (АС):
а) изменением окраски раствора;
б) образованием или растворением осадка;
в) выделением газообразных веществ;
г) окрашиванием пламени и др.
4. Реакция должна быть чувствительной и по возможности специфичной.
Аналитические реакции, проводимые между твердыми веществами, относят к реакциям «сухим путем», а в растворах - «мокрым путем».
Селективность реакций можно повысить, изменяя их условия (рН) или применяя маскирование. Маскирование заключается в уменьшении концентрации мешающих ионов в растворе меньше предела их обнаружения, например путем их связывания в бесцветные комплексы.
Типы аналитических реакций:
v Макроанализ
v Полумикроанализ
v Микроанализ
1. Микрокристаллоскопический
2. Капельный
v Ультрамикроанализ
Исследованию подвергают количества вещества меньше 1 мг. Почти все операции анализа проводят под микроскопом.
5. Классификация катионов и анионов на группы. Аналитические группы катионов. Обзор реакций.
В качественном химическом анализе преимущественно имеют дело с водными растворами электролитов, поэтому аналитическими реакциями открывают образующиеся при диссоциации катионы и анионы. В форме катионов существуют элементы различных групп периодической системы, поэтому и аналитические свойства катионов различны. Однако с помощью групповых реактивов из общей смеси катионов можно выделить отдельные группы катионов со сходными аналитическими свойствами – аналитические группы. Применение разнообразных групповых реактивов позволило разработать различные аналитические классификации катионов (и анионов). Наибольшее распространение получили сульфидная, кислотно-основная и аммиачно-фосфатная классификации. По кислотно-основной классификации катионы делят на шесть аналитических групп.
Кислотно-основная классификация катионов
|
