
- •4. Качественный химический анализ. Основные понятия. Предмет и средства. Чувствительность, специфичность, селективность.
- •Типы аналитических реакций:
- •1. Микрокристаллоскопический
- •2. Капельный
- •5. Классификация катионов и анионов на группы. Аналитические группы катионов. Обзор реакций.
- •6. Количественный анализ. Предмет и методы.
- •7. Весовой анализ. Принципы и методы объемного анализа. Растворы в объемном анализе.
- •8. Метод нейтрализации. Кислотно-основные индикаторы. Смешанные индикаторы. Кривые титрования. Титрование в неводных средах.
- •9. Комплексометрия. Реакции, применяемые в комплексометрии. Кривые титрования. Этилендиаминтетрауксусная кислота, как реагент в комплексометрии.
- •10. Редоксметрия. Перманганатометрическое титрование. Иодометрическое титрование. Электроды в редоксметрии.
- •11. Физико-химические и физические методы анализа. Общая характеристика методов.
- •12. Методы адсорбционного фотометрического анализа.
- •13. Хроматографический анализ. Классификация методов.
- •Классификация методов хроматографии
- •14. Жидкостная адсорбционная, ионообменная хроматография. Хроматография в тонком слое. Гель-хроматография.
- •15. Спектральные методы исследования органических соединений (уф-, ик- и ямр-спектроскопия).
- •16. Электронная спектроскопия органических соединений (уф-спектроскопия).
- •17. Законы поглощения света веществом. Коэффициент молярной экстинции.
- •18. Спектры поглощения органических соединений.
- •19. Возможности электронной спектроскопии в установлении строения органических соединений.
- •20.Спектры испускания (флуоресценция, фосфоресценция.)
- •21. Действие ик-излучения на молекулы органических соединений. Возможности ик-спектроскопии при изучении органических соединений.
- •22. Спектроскопия ядерного магнитного резонанса. Ядерный магнитный резонанс (ямр) и условия его возникновения.
- •23. Масс-спектрометрия органических соединений. Происхождение масс-спектров (ионизация молекул органических соединений при бомбардировке электронами, лазерного излучения и др.).
- •24. Рентгеноструктурный анализ органических соединений. Преимущества и недостатки метода рентгеноструктурного анализа в исследовании органических соединений.
- •2) Что такое активность? Как связана активноть иона и его равновесная концентрация? Что такое ионная ила ратвора, коэффициент активности?
- •3.Что такое мольная доля?
- •4.Как формулируется закон действия масс? Что такое термодинамичекая канстанта равноввессия? Какие факторы влияют на ее величину?
- •6)Что такое условная константа равновесия? Какие факторы влияют на ее величину?
- •8) В чем суть условия материального баланса? Сформулируйте принцип решения уравнения материального баланса.
- •9. Что такое константа диссоциации и степень диссоциации.
- •11. Как влияет введение одно- и разноименных ионов на степень диссоциации слабого электролита?
- •2. Что такое окислитель, восстановитель, окисление и восстановление?
- •3. Что называется электродным потенциалом?
- •4. Как влияет ионная сила на величину электродного потенциала?
- •5. Как влияет рН среды на величину потенциала? Выведите формулу зависимости потенциала от рН для полуреакции, протекающей с участием ионов водорода или гидроксида.
- •6. Как определить направление реакции окисления-восстановления и полноту ее протекания?
- •8. Приведите примеры использования окислительно-восстановительных реакций для растворения малорастворимых соединений.
- •9. Назовите основные окислители и восстановители, используемые для разделения и обнаружения ионов. Напишите соответствующие полуреакции.
- •12. Почему избыток хлорид-ионов мешает обнаружению ионов марганца по реакции образования перманганата?
- •13. Почему не удается обнаружить ион марганца (II) действием окислителя на концентрированные растворы солей марганца (II) ?
- •14. Напишите реакции взаимодействия бромид- и иодид-ионов с хлорной водой и объясните, в какой последовательности они протекают.
- •15. В каких условиях нитрат-ион можно восстановить до: а) аммиака; б) нитрит-иона?
- •1.Какие системы называются гетерогенными? Приведите примеры.
- •2. Выведите формулу константы растворимости.
- •3. Как выражают константу растворимости для идеальных и реальных систем? От чего зависит величина константы растворимости для этих систем?
- •4. Как связаны термодинамическая, реальная и условная константы растворимости?
- •5. Как влияет одноименный ион на растворимость осадка?
- •6. Почему при выделении осадка следует избегать большого избытка осадителя?
- •7. Как влияют электролиты на растворимость осадка?
- •8. Что называется растворимостью и молярной растворимостью?
- •9. Выведите формулу для расчета растворимости соединения АmВn.
- •10. В каких случаях по величинам констант растворимости можно сравнивать растворимость малорастворимых соединений?
- •11. Сформулируйте условия образования и растворения осадка.
- •12. Как влияет температура на растворимость осадка?
- •13. Каковы причины растворимости малорастворимых соединений: а) в кислотах; б) в щелочах?
- •16. Как перевести сульфаты катионов II группы в карбонаты?
- •1. Дайте определение следующим понятиям: разделение, концентрирование, абсолютное и
- •2. Приведите примеры классификаций методов разделения и концентрирования. На чем они основаны?
- •3. Осаждение и соосаждение как методы разделения и концентрирования.
- •4. Перечислите факторы, от которых зависит коэффициент распределения.
- •5. Какие из перечисленных параметров (концентрация, рН раствора, маскирующие вещества, температура) влияют на значение коэффициента распределения?
- •8. В чём сущность методов экстракции? Какие задачи решаются с помощью этих методов?
- •10. Какие процессы определяют скорость экстракции?
- •11. Классификация экстракционных систем.
- •12. Назвать органические растворители, наиболее часто используемые в методах экстракции.
- •13. Назвать основные типы соединений, в виде которых экстрагируются ионы металлов. Привести примеры.
- •14. Каковы достоинства и недостатки методов экстракции?
- •15. В чем сущность методов хроматографии?
- •16. Как классифицируются методы хроматографии по агрегатному состоянию фаз; механизму процесса разделения; технике выполнения и по цели проведения?
- •18. Каковы области применения, достоинства и недостатки методов адсорбционной хроматографии?
- •19. В чём сущность метода ионообменной хроматографии?
- •20. Назвать основные типы ионитов. Что называется обменной ёмкостью ионита?
- •21. Каковы области применения, достоинства и недостатки метода ионообменной хроматографии.
- •22. Пояснить сущность метода осадочной хроматографии. Назвать варианты этого метода анализа.
- •23. На чём основан качественный анализ методами осадочной и распределительной хроматографии на бумаге?
- •24. Как количественно оценивают способность различных веществ к разделению на бумаге?
- •28. В чем сущность тонкослойной хроматографии?
- •29. Каковы преимущества тонкослойной хроматографии перед другими хроматографическими методами?
- •1.Что такое комплексное соединение
- •2. Какие факторы влияют на устойчивость комплексных соединений
- •3.Какие принципы могут быть положены в основу классификации комплексных соединений?
- •4. Назовите основные типы комплексных соединений. Приведите примеры.
- •5. Дайте определение следующим понятиям: комплексообразователь, лиганды, координационное число, дентатность лиганда, заряд комплексного иона.
- •6. Что называется внутрикомплексным соединением? Приведите примеры
- •7. Какие равновесия имеют место в растворах комплексных соединений? Как можно охарактеризовать эти равновесия?
- •8.Что такое ступенчатые и общие константы устойчивости комплексных соединений?
- •9.Дайте теоретическое обоснование возможности использования комплексных соединений для избирательного растворения и осаждения малорастворимых соединений.
- •10.Какие свойства комплексных соединений имеют наиболее важное значение для обнаружения и разделения ионов?
- •11. Приведите примеры использования реакций комплексообразования для растворения:
- •13. Приведите примеры использования реакций комплексообразования для маскирования мешающих ионов.
- •14. Приведите примеры использования реакций комплексообразования для идентификации ионов.
11. Как влияет введение одно- и разноименных ионов на степень диссоциации слабого электролита?
Добавление одноименных ионов уменьшает степень диссоциации, что также согласуется с принципом Ле Шателье. Прибавление одноименных ионов уменьшает степень диссоциации. Это положение также находится в соответствии с принципом Ле-Шателье. Добавлением одноименных ионов часто пользуются для более полного выделения малорастворимого вещества. Прибавление одноименных ионов оказывает влияние на растворимость малорастворимых соединений и способствует более полному осаждению твердой фазы.
12) Ионное произведение воды. Вода является слабым электролитом и диссоциирует по схеме:
2Н2О ↔ Н3О+ + ОН-
Ионы Н+ в воде и водных растворах практически отсутствуют, т.к. равновесие реакции
Н2О + Н+ ↔ Н3О+
полностью смещено влево, обычно реакцию диссоциации воды записывают упрощенно
Н2О ↔ Н+ + ОН-
Константу диссоциации воды можно записать:
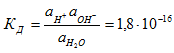
В чистой воде концентрации ионов водорода и гидроксида очень малы и вместо активностей можно использовать аналитические концентрации. Диссоциация практически не влияет на концентрацию воды, поэтому
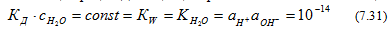
Эта величина носит название ионное произведение воды. При 295 К (22оС) ионное произведение равно точно 10-14.
Диссоциация воды протекает с поглощением тепла, поэтому при повышении температуры КW возрастает Из ур-ния (7.31) следует, что в чистой воде концентрации ионов водорода и гидроксила равны и составляют при 295 К
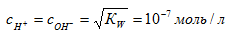
Такой
раствор называют нейтральным. Если ![]() то
раствор будет кислым, а если
то
раствор будет кислым, а если![]() то
раствор щелочной.
то
раствор щелочной.
Для характеристики кислотности среды обычно используют вместо концентрации водородный показатель (рН) – отрицательный десятичный логарифм активности (концентрации) ионов водород:
![]() (7.32)
(7.32)
При 295 К в нейтральной среде рН=7, в кислой – рН<7, в щелочной - pH>7.
Несколько реже используют гидроксидный покадатель (рОН) отрицательный десятичный логарифм активности (концентрации) ионов гидроксила:
![]() (7.32а)
(7.32а)
При 295 К в нейтральной среде рОН=7, в кислой – pОH>7, в щелочной - рОН<7.
рН+рОН=14.
Величина рН может контролироваться с помощью приборов (рН-метров) или посредством специальных реактивов, называемых индикаторами. Окраска индикаторов изменяется в зависимости от концентрации ионов водорода. Кислотно-основные индикаторы представляют собой слабые органические кислоты (HInd) или основания (IndOH), диссоциирующие по схемам:
HInd↔H+ + Ind-
IndOH↔Ind+ + OH-
Молекулярная и ионная формы индикаторов имеют разные окраски. При избытке ионов водорода HInd находится преимущественно в молекулярной форме, а IndOH – в ионной, а при избытке ионов гидроксила, наоборот - HInd находится преимущественно в ионной форме, а IndOH –в молекулярной.
Изменение окраски индикатора происходит в некотором интервале рН, называемом интервал перехода индикатора, определяемом величиной рКHind.
13. По Бренстеду-Лоури, кислоты представляют собой вещества, способные отдавать протон, а основания - вещества, присоединяющие протон. Такой подход известен как бренстедовская кислотность и основность органических соединений или протонная теория кислот и оснований (протолитическая теория): кислота протон + основание.
14) Поведение электролитов в различных по характеру средах. Многосторонние исследования показали, что некоторые вещества, которые ведут себя как кислоты в среде одного растворителя, в другом проявляют себя как основания. Соединения, проявляющие себя как основания в одних средах, ведут себя как кислоты в других; нередко в неводных растворах кислые или основные свойства проявляют также вещества, которые, казалось бы, ничего общего не имеют с кислотами и основаниями в обычном их представлении.
При переходе от амфотерных, или амфипротных. растворителей (каким является вода) к основным или протофильным (какими являются аммиак, этилендиамин и др.), отличающимся склонностью к присоединению протонов, ионизация по типу кислот усиливается, а ионизация по типу оснований уменьшается.
При переходе от амфотерных, или амфипротных, растворителей к кислым или протогенным (какими являются безводная уксусная кислота, жидкий фтористый водород и др.), отличающимся склонностью отдавать свои протоны, усиливается ионизация по типу оснований, а ионизация по типу кислот уменьшается.
Одно и то же вещество может вести себя различно в зависимости от растворителя, в котором оно растворено. Таково, например, поведение мочевины, являющейся кислотой в растворе жидкого аммиака, сильным основанием в среде безводной уксусной кислоты и слабым основанием в водном растворе.
Кислотная сила растворенного вещества значительно увеличивается в сильноосновном растворителе. Чем сильнее основные свойства растворителя, тем сильнее его влияние на слабые кислоты. Все кислоты становятся одинаково сильными в основных растворителях. Например, в среде жидкого аммиака слабая синильная кислота становится столь же сильной, как азотная кислота в водном растворе. Благодаря этому слабые кислоты можно титровать в неводных растворителях.
Равным образом в кислых растворителях наблюдается сильное влияние растворителя на основания. Чем сильнее кислотные свойства растворителя, тем сильнее его влияние на слабые основания. В сильнокислом растворителе основные свойства растворенного вещества значительно увеличиваются. Все основания становятся одинаково сильными в кислых растворителях. Этиловый спирт в среде жидкого фтористого водорода является ясно выраженным основанием и отличается сильноосновными свойствами, а уксусная и муравьиная кислоты, характеризующиеся кислыми свойствами в врдных растворах, проявляют основные свойства в среде жидкого
19. Гидро́лиз — один из видов химических реакций сольволиза, где при взаимодействии веществ с водой происходит разложение исходного вещества с образованием новых соединений. Константа гидролиза − константа равновесия обратимой реакции. Зависит от температуры, но не зависит от концентрации раствора
20. Степень гидролиза соли зависит от природы соли, её концентрации и температуры. Усилить или подавить гидролиз можно тремя способами:
1) прибавлением к раствору соли другого гидролизующегося электролита, кислоты или щелочи;
2) изменением концентрации раствора соли;
3) повышением или понижением температуры раствора соли.
21. БУФЕРНЫЙ РАСТВОР, поддерживает при изменении состава среды постоянство значения к.-л. характеристики, напр. рН (кислотно-основной буферный раствор) или окислит.-восстановит. потенциала (окислит.-восстановит. буферный раствор).
Значение рН кислотно-основного буферного раствора зависит от концентраций компонентов буферной смеси, находящихся в хим. равновесии, и мало меняется при концентрировании и разбавлении р-ра, введении относительно небольших кол-в в-в, взаимодействующих с одним из компонентов буферного раствора.
Буферная емкость раствора определяется суммарной и относительной концентрацией компонентов буферной системы.
ОВР
Какие реакции называются окислительно-восстановительными?
Окисли́тельно-восстанови́тельные реа́кции, ОВР— это встречно-параллельные химические реакции, протекающие с изменениемстепеней окисленияатомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем.
В процессе окислительно-восстановительной реакции восстановитель отдаёт электроны, то есть окисляется; окислитель присоединяет электроны, то есть восстанавливается. Причём любая окислительно-восстановительная реакция представляет собой единство двух противоположных превращений — окисления и восстановления, происходящих одновременно и без отрыва одного от другого.
