
- •4. Качественный химический анализ. Основные понятия. Предмет и средства. Чувствительность, специфичность, селективность.
- •Типы аналитических реакций:
- •1. Микрокристаллоскопический
- •2. Капельный
- •5. Классификация катионов и анионов на группы. Аналитические группы катионов. Обзор реакций.
- •6. Количественный анализ. Предмет и методы.
- •7. Весовой анализ. Принципы и методы объемного анализа. Растворы в объемном анализе.
- •8. Метод нейтрализации. Кислотно-основные индикаторы. Смешанные индикаторы. Кривые титрования. Титрование в неводных средах.
- •9. Комплексометрия. Реакции, применяемые в комплексометрии. Кривые титрования. Этилендиаминтетрауксусная кислота, как реагент в комплексометрии.
- •10. Редоксметрия. Перманганатометрическое титрование. Иодометрическое титрование. Электроды в редоксметрии.
- •11. Физико-химические и физические методы анализа. Общая характеристика методов.
- •12. Методы адсорбционного фотометрического анализа.
- •13. Хроматографический анализ. Классификация методов.
- •Классификация методов хроматографии
- •14. Жидкостная адсорбционная, ионообменная хроматография. Хроматография в тонком слое. Гель-хроматография.
- •15. Спектральные методы исследования органических соединений (уф-, ик- и ямр-спектроскопия).
- •16. Электронная спектроскопия органических соединений (уф-спектроскопия).
- •17. Законы поглощения света веществом. Коэффициент молярной экстинции.
- •18. Спектры поглощения органических соединений.
- •19. Возможности электронной спектроскопии в установлении строения органических соединений.
- •20.Спектры испускания (флуоресценция, фосфоресценция.)
- •21. Действие ик-излучения на молекулы органических соединений. Возможности ик-спектроскопии при изучении органических соединений.
- •22. Спектроскопия ядерного магнитного резонанса. Ядерный магнитный резонанс (ямр) и условия его возникновения.
- •23. Масс-спектрометрия органических соединений. Происхождение масс-спектров (ионизация молекул органических соединений при бомбардировке электронами, лазерного излучения и др.).
- •24. Рентгеноструктурный анализ органических соединений. Преимущества и недостатки метода рентгеноструктурного анализа в исследовании органических соединений.
- •2) Что такое активность? Как связана активноть иона и его равновесная концентрация? Что такое ионная ила ратвора, коэффициент активности?
- •3.Что такое мольная доля?
- •4.Как формулируется закон действия масс? Что такое термодинамичекая канстанта равноввессия? Какие факторы влияют на ее величину?
- •6)Что такое условная константа равновесия? Какие факторы влияют на ее величину?
- •8) В чем суть условия материального баланса? Сформулируйте принцип решения уравнения материального баланса.
- •9. Что такое константа диссоциации и степень диссоциации.
- •11. Как влияет введение одно- и разноименных ионов на степень диссоциации слабого электролита?
- •2. Что такое окислитель, восстановитель, окисление и восстановление?
- •3. Что называется электродным потенциалом?
- •4. Как влияет ионная сила на величину электродного потенциала?
- •5. Как влияет рН среды на величину потенциала? Выведите формулу зависимости потенциала от рН для полуреакции, протекающей с участием ионов водорода или гидроксида.
- •6. Как определить направление реакции окисления-восстановления и полноту ее протекания?
- •8. Приведите примеры использования окислительно-восстановительных реакций для растворения малорастворимых соединений.
- •9. Назовите основные окислители и восстановители, используемые для разделения и обнаружения ионов. Напишите соответствующие полуреакции.
- •12. Почему избыток хлорид-ионов мешает обнаружению ионов марганца по реакции образования перманганата?
- •13. Почему не удается обнаружить ион марганца (II) действием окислителя на концентрированные растворы солей марганца (II) ?
- •14. Напишите реакции взаимодействия бромид- и иодид-ионов с хлорной водой и объясните, в какой последовательности они протекают.
- •15. В каких условиях нитрат-ион можно восстановить до: а) аммиака; б) нитрит-иона?
- •1.Какие системы называются гетерогенными? Приведите примеры.
- •2. Выведите формулу константы растворимости.
- •3. Как выражают константу растворимости для идеальных и реальных систем? От чего зависит величина константы растворимости для этих систем?
- •4. Как связаны термодинамическая, реальная и условная константы растворимости?
- •5. Как влияет одноименный ион на растворимость осадка?
- •6. Почему при выделении осадка следует избегать большого избытка осадителя?
- •7. Как влияют электролиты на растворимость осадка?
- •8. Что называется растворимостью и молярной растворимостью?
- •9. Выведите формулу для расчета растворимости соединения АmВn.
- •10. В каких случаях по величинам констант растворимости можно сравнивать растворимость малорастворимых соединений?
- •11. Сформулируйте условия образования и растворения осадка.
- •12. Как влияет температура на растворимость осадка?
- •13. Каковы причины растворимости малорастворимых соединений: а) в кислотах; б) в щелочах?
- •16. Как перевести сульфаты катионов II группы в карбонаты?
- •1. Дайте определение следующим понятиям: разделение, концентрирование, абсолютное и
- •2. Приведите примеры классификаций методов разделения и концентрирования. На чем они основаны?
- •3. Осаждение и соосаждение как методы разделения и концентрирования.
- •4. Перечислите факторы, от которых зависит коэффициент распределения.
- •5. Какие из перечисленных параметров (концентрация, рН раствора, маскирующие вещества, температура) влияют на значение коэффициента распределения?
- •8. В чём сущность методов экстракции? Какие задачи решаются с помощью этих методов?
- •10. Какие процессы определяют скорость экстракции?
- •11. Классификация экстракционных систем.
- •12. Назвать органические растворители, наиболее часто используемые в методах экстракции.
- •13. Назвать основные типы соединений, в виде которых экстрагируются ионы металлов. Привести примеры.
- •14. Каковы достоинства и недостатки методов экстракции?
- •15. В чем сущность методов хроматографии?
- •16. Как классифицируются методы хроматографии по агрегатному состоянию фаз; механизму процесса разделения; технике выполнения и по цели проведения?
- •18. Каковы области применения, достоинства и недостатки методов адсорбционной хроматографии?
- •19. В чём сущность метода ионообменной хроматографии?
- •20. Назвать основные типы ионитов. Что называется обменной ёмкостью ионита?
- •21. Каковы области применения, достоинства и недостатки метода ионообменной хроматографии.
- •22. Пояснить сущность метода осадочной хроматографии. Назвать варианты этого метода анализа.
- •23. На чём основан качественный анализ методами осадочной и распределительной хроматографии на бумаге?
- •24. Как количественно оценивают способность различных веществ к разделению на бумаге?
- •28. В чем сущность тонкослойной хроматографии?
- •29. Каковы преимущества тонкослойной хроматографии перед другими хроматографическими методами?
- •1.Что такое комплексное соединение
- •2. Какие факторы влияют на устойчивость комплексных соединений
- •3.Какие принципы могут быть положены в основу классификации комплексных соединений?
- •4. Назовите основные типы комплексных соединений. Приведите примеры.
- •5. Дайте определение следующим понятиям: комплексообразователь, лиганды, координационное число, дентатность лиганда, заряд комплексного иона.
- •6. Что называется внутрикомплексным соединением? Приведите примеры
- •7. Какие равновесия имеют место в растворах комплексных соединений? Как можно охарактеризовать эти равновесия?
- •8.Что такое ступенчатые и общие константы устойчивости комплексных соединений?
- •9.Дайте теоретическое обоснование возможности использования комплексных соединений для избирательного растворения и осаждения малорастворимых соединений.
- •10.Какие свойства комплексных соединений имеют наиболее важное значение для обнаружения и разделения ионов?
- •11. Приведите примеры использования реакций комплексообразования для растворения:
- •13. Приведите примеры использования реакций комплексообразования для маскирования мешающих ионов.
- •14. Приведите примеры использования реакций комплексообразования для идентификации ионов.
2. Выведите формулу константы растворимости.
Константа равновесия называется произведением растворимости ПР или константой растворимости KS. Как любая константа равновесия величина ПР зависит от температуры и не зависит от концентрации.
В общем виде, произведение растворимости для вещества с формулой AmBn, которое диссоциирует на m катионов An+ и n анионов Bm-, рассчитывается по уравнению:
![]()
где [An+] и [Bm-] — равновесные молярные концентрации ионов, образующихся при электролитической диссоциации.
Из произведений растворимости можно рассчитать концентрации катионов и анионов в растворе малорастворимого электролита. Значения произведений растворимости приведены в справочниках.
3. Как выражают константу растворимости для идеальных и реальных систем? От чего зависит величина константы растворимости для этих систем?
Константа равновесия для идеальных систем может быть выражена через равновесные парциальные давлениякомпонентовpi по формуле:
![]()
где νi — стехиометрический коэффициент(для исходных веществ принимается отрицательным, для продуктов — положительным).Kp не зависит от общего давления, от исходных количеств веществ или от того, какие участники реакции были взяты в качестве исходных, но зависит от температуры .
Константа равновесия для реальных систем
вместо парциального давления и концентрации используют соответственно фугитивность fi и активность ai:
![]()
![]()
4. Как связаны термодинамическая, реальная и условная константы растворимости?
В системе, состоящей из раствора и осадка, идут два процесса - растворение осадка и осаждение. Равенство скоростей этих двух процессов является условием равновесия. Насыщенный раствор - это раствор, который находится в равновесии с осадком.
^ Константа растворимости KS (или произведение растворимости ПР) - произведение концентраций ионов в насыщенном растворе малорастворимого электролита - есть величина постоянная и зависит лишь от температуры.
Способы выражения констант равновесия: термодинамическая и концентрационные (реальная, условная) константы.
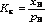
Кs – практическая константа. Такая константа называется константой растворимости
Условная константа - это константа какого-либо равновесия в вполне конкретных "отягчающих" условиях. По сути она может представлять собой, например, произведение реальной константы рассматриваемого равновесия на константу равновесия побочной реакции в случае, если они протекают последовательно. Либо эта зависимость может носить более сложный характер.
5. Как влияет одноименный ион на растворимость осадка?
Уменьшение растворимости. Абсолютно нерастворимых веществ нет. Все вещества растворимы в большей или меньшей степени. Добавление избытка осаждающего реактива при осаждении является одним из способов уменьшения растворимости осадков.
растворимость осадка при добавлении избытка осаждающего реактива уменьшается и зависит от избытка прибавленного иона, общего с одним из ионов, образующих осадок, а также от численного значения произведения растворимости данного малорастворимого электролита.
Аналогичным образом можно доказать, что (если малорастворимое вещество не растворяется с образованием комплексных соединений и не относится к амфотерным соединениям) растворимость малорастворимого электролита также понижается при добавлении не только осаждающего реактива, но и любого другого хорошо растворимого в данной среде электролита, имеющего общие ионы с малорастворимым веществом.
