
- •10. Теория переходного состояния
- •21. Ступенчатая диссоциация электронов
- •28. Комплексные соединения. Основные положения теории Вернера. Тип химической связи в комплексных соединениях.
- •29. Диссоциация комплексных соединений в водных растворах (типы диссоциации, ступени диссоциации). Привести примеры.
- •33. Электрохимические процессы. Механизм возникновения тока в гальваническом элементе. Устройство и принцип работы медно-цинкового гальванического элемента (Якоби-Даниэля).
- •34. Стандартный электродный потенциал. Уравнения Нернста. Эдс гальванического элемента.
- •37. Электрохимическая коррозия: классификация, условия протекания.
- •38. Атмосферная коррозия
- •Виды атмосферной коррозии
- •Особенности протекания атмосферной коррозии металлов
- •Уравнение атмосферной коррозии:
- •Свойства лакокрасочных материалов
- •Свойства лакокрасочных покрытий
- •Виды лакокрасочных материалов (лкм)
- •Состав лакокрасочных материалов
- •Классификация лакокрасочных материалов
- •42. Электролиз. Схема электролизной установки. Причины электролиза. Анод. Катод. Их заряды при электролизе.
- •54. Химическая связь.
- •Методы умягчения воды
- •70. Двенадцать принципов зелёной химии
- •Основные промышленные группы полимеров, синтезируемых поликонденсацией
Свойства лакокрасочных покрытий
- декоративными (внешний вид, цвет лакокрасочного покрытия, блеск);
- химическими (устойчивость при воздействии атмосферы, агрессивных газов, щелочей, кислот, различных химических растворов, воды, масел, нефти, бензина, эмульсий, мыльного раствора);
- физико-химическими (износостойкость, прочность, твердость, эластичность, прочность на изгиб, адгезия);
- защитными (стойкость в различных атмосферных условиях, термостойкость, светостойкость, морозостойкость);
- малярно-техническими (хорошо поддаваться шлифовке, полировке, зачистке);
- электроизоляционными;
- специальные ЛКМ должны обладать дополнительными специфическими свойствами.
Виды лакокрасочных материалов (лкм)
В зависимости от назначения и состава лакокрасочные материалы (ЛКМ) принято делить на: лаки, краски, эмали, грунтовки, шпаклевки.
Лаки – это растворы пленкообразующих веществ в растворителях (или воде), которые после высыхания образуют однородное, твердое, прозрачное (кроме битумного лака) покрытие. Их состав не содержит пигменты и наполнители.
Краски – суспензии пигментов в пленкообразующих веществах, которые после высыхания образуют непрозрачное однородное покрытие.
Эмаль – суспензия пигментов, наполнителей в лаке, которая после высыхания образует непрозрачное, твердое покрытие различной структуры и блеска.
Грунтовка – суспензия пигментов с наполнителями в пленкообразующем веществе, которая после высыхания образует однородную непрозрачную пленку.
Шпаклевка – смесь наполнителей, пигментов и пленкообразующих веществ, пастообразная вязкая масса, предназначена для заполнения дефектов поверхности, придания ей равномерной фактуры.
Состав лакокрасочных материалов
Основными компонентами лакокрасочных материалов (ЛКМ) являются пленкообразующие, пигменты, наполнители, пластификаторы, растворители, сиккативы, добавки.
Классификация лакокрасочных материалов
Все лакокрасочные материалы подразделяются на основные, промежуточные и прочие.
Основные – лаки, эмали, краски, шпаклевки, грунтовки.
Промежуточные – растворителя, разбавители, смолы, их растворы, сиккативы, олифы.
Прочие – подсобные, вспомогательные материалы (мастики, пасты, смывки, отвердители, порозаполнители).
42. Электролиз. Схема электролизной установки. Причины электролиза. Анод. Катод. Их заряды при электролизе.
Электролиз – совокупность ОВР протекающих на электродах при пропускании постоянного электрического тока через раствор или расплав электролита.
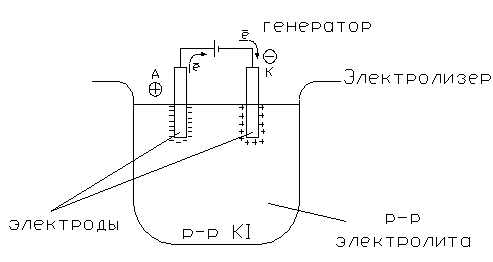
Электролиз – вынужденный процесс. При включении генератора происходит перекачка электронов на катод.
При прохождении тока через расплав катионы под воздействием электрического поля движутся к отрицательному электроду. Здесь, взаимодействуя с приходящими по внешней цепи электронами, они восстанавливаются.
Анод – электрод, на котором происходит процесс окисления. Анод имеет положительный заряд (+)
Катод – электрод, на котором происходит процесс восстановления. Катод имеет отрицательный заряд (-)
43.Катод – электрод, на котором происходит процесс восстановления. Катод имеет отрицательный заряд (-)
Три группы катионов:
Катионы
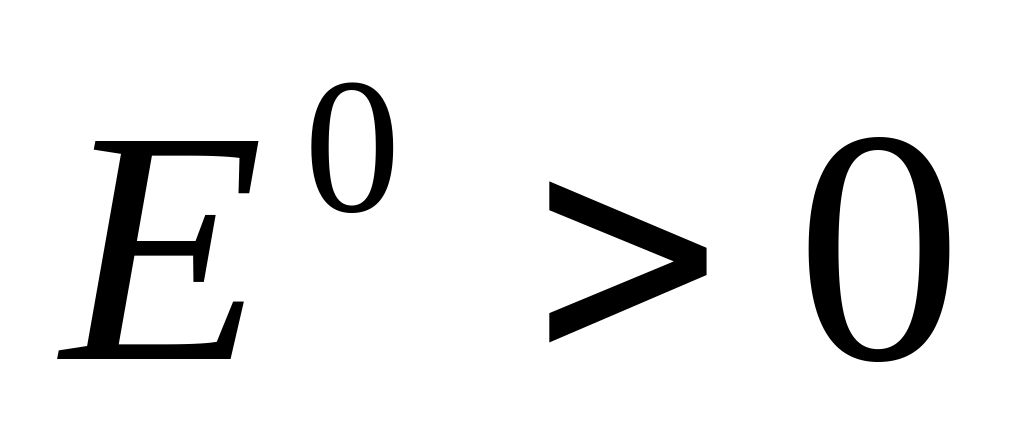 .
Данные катионы всегда восстанавливаются
из водных р-ров.
.
Данные катионы всегда восстанавливаются
из водных р-ров.Металлы
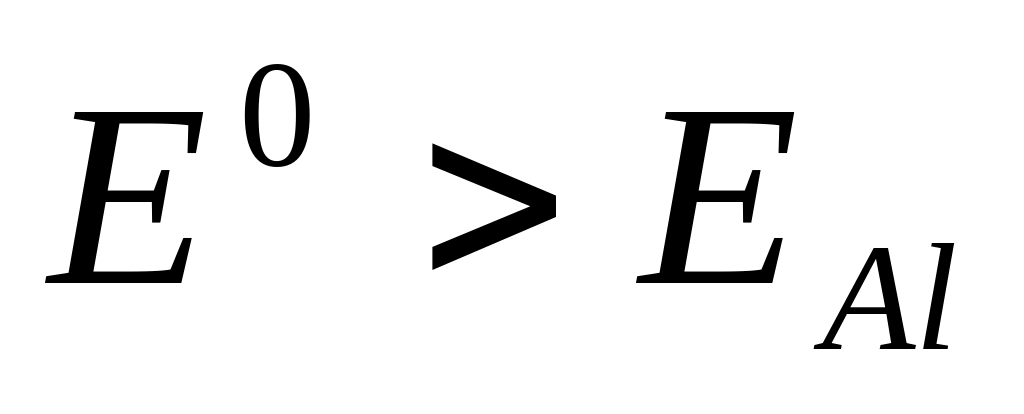 .
Восстанавливаются из водных растворов,
но в некоторых случаях может идти
процесс восстановления воды.
.
Восстанавливаются из водных растворов,
но в некоторых случаях может идти
процесс восстановления воды.Металлы
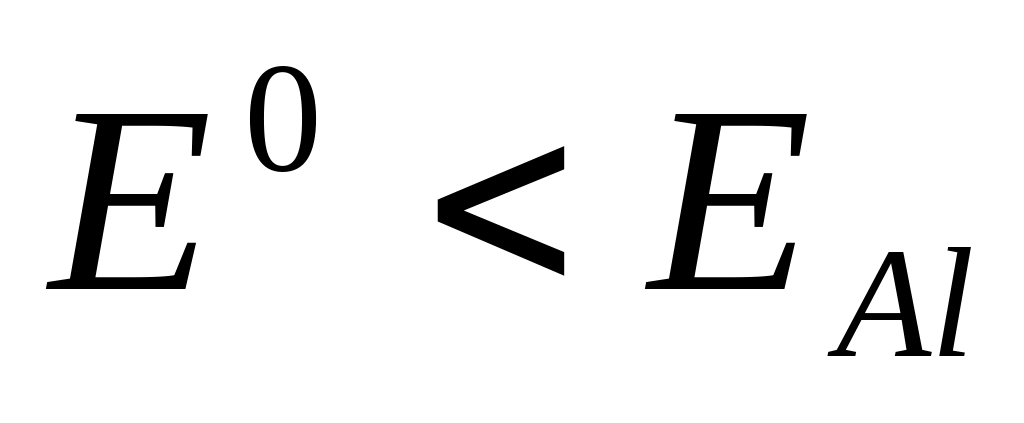 .
Никогда не восстанавливаются из водных
растворов. Всегда идет процесс
восстановления воды. Данные металлы
можно выделить только путем электролиза
расплавов.
.
Никогда не восстанавливаются из водных
растворов. Всегда идет процесс
восстановления воды. Данные металлы
можно выделить только путем электролиза
расплавов.
![]()
![]() - восстановление
воды
- восстановление
воды
P.S.Рассматривая
катодные процессы, протекающие при
электролизе водных растворов, ограничимся
важнейшим случаем — катодным
восстановлением, приводящим к выделению
элементов в свободном состоянии.
Здесь нужно учитывать величину потенциала
процесса восстановления ионов водорода.
Этот потенциал зависит от концентрации
ионов водорода и имеет значение
![]() В.
Поэтому, если катионом электролита
является металл, электродный потенциал
значительно более отрицательный, чем
—0,41 В, металл восстанавливаться не
будет, а произойдет выделение водорода.
К таким металлам относятся металлы
начала ряда напряжений — приблизительно
до титана.
В.
Поэтому, если катионом электролита
является металл, электродный потенциал
значительно более отрицательный, чем
—0,41 В, металл восстанавливаться не
будет, а произойдет выделение водорода.
К таким металлам относятся металлы
начала ряда напряжений — приблизительно
до титана.
Последовательность
разрядки ионов на катоде: Легче всего
из раствора восстановить частицы
стандартных электронных потенциалов
![]() ,
который имеет наибольшее значение.
,
который имеет наибольшее значение.
44.Анод – электрод, на котором происходит процесс окисления. Анод имеет положительный заряд (+)
Существуют две группы катионов:
Бескислородные (
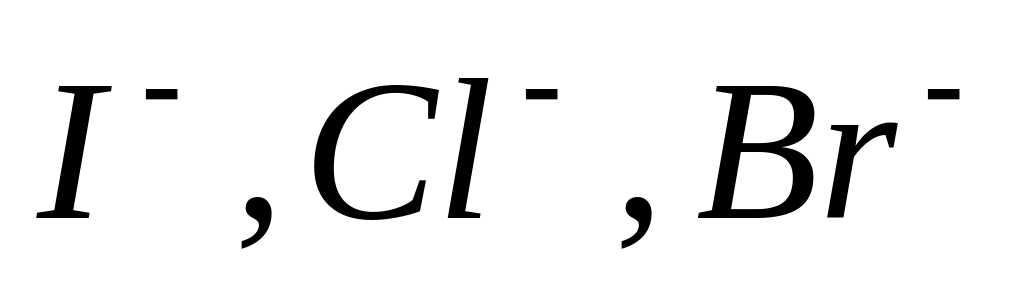 )
При электролизе они окисляются с
образованием простых веществ.
)
При электролизе они окисляются с
образованием простых веществ.Кислородосодержащие. Из растворов на аноде они никогда не окисляются. Идет процесс окисления воды.
Анодные процессы, протекающие при электролизе второй группы катионов металлов:
![]()
![]() - окисление воды
- окисление воды
Легче всего на
аноде окисляются частицы,
![]() которых наименьшее значение.
которых наименьшее значение.
Типы анодов:
Инертный (анод, материал которого не претерпевает окисления в ходе электролиза)
Активный (анод, материал которого может окисляться в ходе электролиза).
45. Электролиз солевых расплавов широко применяется для щелочных, щелочноземельных и редких металлов, а также для магния и алюминия. Процессы выделения металлов из расплавов, как правило, протекают без кинетических затруднений. Расплавленные электролиты имеют высокую проводимость, что позволяет вести процесс электролиза при высоких катодных плотностях тока. Основные преимущества процесса электролиза с участием ионных расплавов перед пиро- и гидрометаллургическими методами заключается в следующем: электролиз ионных расплавов позволяет в одну или две операции получить металл необходимой чистоты. Плотность тока может быть выше, чем при электролизе водных растворов (5000А/м и выше). Металл находится в жидком состоянии, его можно сразу же разливать в чушки.
Для катодного осаждения свинца из ионных расплавов используются хлоридные системы. Способ заключается в том, что подлежащий переработке свинец анодно растворяется в расплавленном электролите, состоящем из смеси хлорида свинца и хлоридов щелочных и щелочно-земельных металлов.
Электролитом
служит система
![]() -NaCl-KCl.
Электролит в ходе процесса почти
не расходуется. Температура электролита
при электролизе не должна превышать
600 С во избежание испарения
хлорида свинца.
-NaCl-KCl.
Электролит в ходе процесса почти
не расходуется. Температура электролита
при электролизе не должна превышать
600 С во избежание испарения
хлорида свинца.
В качестве растворителя при переработке отработанных аккумуляторов методом электролиза расплавов может быть использован также расплавленный гидроксид натрия.
Электролиз расплавов соединений свинца связан и с целым рядом проблем. Одной из важнейших является проблема коррозионной стойкости конструкционных материалов. К коррозионно-стойким материалам следует отнести никель и сталь.
|
46. Применение электролиза. Получение целевых продуктов путем электролиза позволяет сравнительно просто (регулируя силу тока) управлять скоростью и направленностью процесса, благодаря чему можно осуществлять процессы как в самых "мягких", так и в предельно "жестких" условиях окисления или восстановления, получая сильнейшие окислители и восстановители. Путем электролиза производят Н2 и О2 из воды, С12 из водных р-ров NaCl, F2 из расплава KF в KH2F3. Гидроэлектрометаллургия - важная отрасль металлургии цветных металлов (Сu, Bi, Sb, Sn, Pb, Ni, Co, Cd, Zn); она применяется также для получения благородных и рассеянных металлов, Мn, Сr. Электролиз используют непосредственно для катодного выделения металла после того, как он переведен из руды в р-р, а р-р подвергнут очистке. Такой процесс наз. электроэкстракцией. Электролиз применяют также для очистки металла - электролитич. рафинирования (электрорафинирование). Этот процесс состоит в анодном растворении загрязненного металла и в последующем его катодном осаждении. Рафинирование и электроэкстракцию проводят с жидкими электродами из ртути и амальгам (амальгамная металлургия) и с электродами из твердых металлов. Электролиз расплавов электролитов - важный способ произ-ва мн. металлов. Так, напр., алюминий-сырец получают электролизом криолит-глиноземного расплава (Na3AlF6 + A12O3), очистку сырца осуществляют электролитич. рафинированием. При этом анодом служит расплав А1, содержащий до 35% Сu (для утяжеления) и потому находящийся на дне ванны электролизера. Средний жидкий слой ванны содержит ВаС12, A1F3 и NaF, a верхний - расплавленный рафинир. А1 и служит катодом. Электролиз расплава хлорида магния или обезвоженного карналлита - наиб. распространенный способ получения Mg. В пром. масштабе электролиз расплавов используют для получения щелочных и щел.-зем. металлов, Be, Ti, W, Mo, Zr, U и др. К электролитич. способам получения металлов относят также восстановление ионов металла другим, более электро-отрицат. металлом. Выделение металлов восстановлением их водородом также часто включает стадии электролиза - электрохим. ионизацию водорода и осаждение ионов металла за счет освобождающихся при этом электронов. Важную роль играют процессы совместного выделения или растворения неск. металлов, совместного выделения металлов и мол. водорода на катоде и адсорбции компонентов р-ра на электродах. Электролиз используют для приготовления металлич. порошков с заданными св-вами. Другие важнейшие применения электролиза- гальванотехника, электросинтез, электрохимическая обработка металлов, защита от коррозии
47. С другой стороны можно сказать, что единой классификации металлов (и их сплавов) не существует. Металлы и сплавы классифицируют следующим образом:
по основному компоненту - на железные, алюминиевые, медные, магниевые, титановые и другие;
по числу компонентов - на двухкомпонентные (двойные), трёхкомпонентные (тройные) и многокомпонентные;
по технологии изготовления полуфабрикатов и изделий металлы делят на литейные, деформируемые, порошковые (спеченные) и другие;
классификация металлов по плотности: лёгкие (магниевые, бериллиевые, алюминиевые, титановые сплавы) с малой плотностью (до 5000 кг/м3) и тяжелые (стареющие сплавы, главным образом на основе вольфрама) с высокой плотностью (не менее 15000 кг/м3);
по температуре плавления металлы классифицируют на легкоплавкие, имеющие низкую температуру плавления (припои, баббиты и др.), и тугоплавкие (сплавы на основе ниобия, молибдена, тантала, вольфрама и др.), температура плавления которых выше 1800°С;
классификация металлов и сплавов по применению такова:
антифрикционные (сплавы с низким коэффициентом трения и высоким уровнем износостойкости);
коррозионно-стойкие (сплавы на основе железа, никеля, меди, алюминия, титана и других элементов, отличающиеся повышенной коррозионной стойкостью в различных агрессивных средах);
криогенные (прецизионные сплавы на основе железа, никеля, алюминия, характеризующиеся комплексом тепловых, электрических, магнитных, механических свойств и предназначенные для работы при низких температурах (от -269 до +20°С);
магнитные (сплавы, обладающие ферромагнетизмом);
немагнитные (сплавы на основе меди, алюминия, железа, магнитная проницаемость которых близка к единице);
пружинные (сплавы на железной, медной, никелевой, кобальтовой и других основах с высоким пределом упругости и релаксационной стойкостью) и т.д.
48. Процесс получения металлов из руд при помощи восстановительных реакций. Под Восстановлением металлов первоначально понимались реакции получения металлов из их окислов путём применения веществ, отличающихся более высоким сродством к кислороду, чем металл. Простейший пример — получение металлического железа из его закиси: FeO + С = Fe + CO, которое, в частности, протекает в доменных печах.
Возможность В. м. определяется изменением свободной энергии при реакции: MeO + В = Me + BO, где MeO — окисел металла, В — восстановитель. Если при этой реакции (при постоянных температуре и давлении) сумма свободных энергий Me и BO меньше, чем MeO и В, то процесс протекает слева направо с образованием металла. Процесс облегчается, если конечный продукт — металл — находится в виде раствора (твёрдого или жидкого), так как растворение сопровождается уменьшением свободной энергии. Этим объясняется, что при восстановлении металлов из некоторых особенно прочных окислов получают в качестве конечных продуктов соответствующие сплавы. Таким образом, для восстановление металлов необходимо наличие определённого термодинамического стимула. Наряду с этим большое значение имеют и кинетические условия восстановления, которые определяются кристаллохимическими превращениями (в случае твёрдых окислов), механизмом химических реакций на границах фаз, условиями массопереноса реагентов, например диффузией.
В более общем, химическом смысле восстановление металлов сводится к присоединению электронов к атому или группе атомов. Поэтому к восстановлению металлов относятся и процессы получения металлов электролизом из солевых расплавов или растворов на катоде, например для меди: Cu++ + 2e = Cu, где е — электрон.
Наиболее важные примеры подобных процессов в технике — производство Al электролизом глинозёма из расплавов и Cu из водных растворов CuSO4. Восстановление металлов осуществляется в цветной металлургии при получении металлов из сульфидов, хлоридов и других соединений. Так как для восстановления необходимы электроны, которые отдаёт восстановитель, то восстановительные процессы неразрывно связаны с окислительными.
49. К черным металлам относятся:
− железные металлы – железо, кобальт, никель, марганец;
− тугоплавкие металлы; имеют температуру плавления выше чем у железа, т.е. более 15390С
- титан, ванадий, хром, цирконий, ниобий, молибден, вольфрам, технеций, гафний, рений;
− урановые металлы (актиноиды) – торий, актиний, уран, нептуний, плутоний и др. (с 89 до 103 элемента);
− редкоземельные металлы (с 57 -71 элементы), лантан, церий, ниодим и д.р.;
− щелочноземельные металлы
- литий, натрий, кальций, калий, рубидий, стронций, цезий, барий, франций, родий, скандий.
51. Орбиталь – область пространства, где наиболее вероятно нахождение электрона.
Главное квантовое число (n) – характеризует энергетический уровень. Определяет энергию и размеры электронных орбиталей.
Орбитальное квантовое число (l) – определяет форму атомной орбитали. Характеризует энергетические подуровни в электронной оболочке атома. (s – 0; p – 1; d – 2; f – 3).
Магнитное квантовое число (m) – характеризует ориентацию орбитали в пространстве. (от –l до +l)
Спиновое квантовое число (s) – спин электрона. (+1/2 - ; -1/2 - )
52. Правило В. Клечковского. Увеличение энергии и соответственно заполнение орбиталей происходит в порядке возрастания суммы квантовых чисел n+l, а при равной сумме в порядке возрастания числа n. (1s 2s 3p 4s 3d 4p 5s 4d 5p 6s 5d 4f 6p 7s 6d 5f )
Принцип минимальной энергии. Электроны в основном состоянии заполняют орбитали в порядке повышения уровня энергии орбиталей.
Принцип запрета Паули. В атоме не может быть двух электронов, обладающих одинаковым набором квантовых чисел.
Правило Хунда. Заполнение орбитали одной подоболочки в основном состоянии атома начинается одиночными электронами с одинаковыми спинами.
53. Энергия ионизации(I1). Энергия необходимая для удаления одного моля электронов от одного моля атомов какого-либо элемента называется первой энергией ионизации I1.[кДж/моль, эВ]. Характеризует восстановительную способность элемента. Первая энергия определяется электронным строением элементов и её изменение имеет периодический характер. Наименьшее значение имеют щелочные элементы находящиеся в начале периода, наибольшее – благородные газы, находящиеся в конце периода. По группе сверху вниз – уменьшается, что обусловлено увеличением размеров атомов и расстояния внешних подоболочек от ядра.
Сродство к электрону(Eср). Энергетический эффект присоденения моля электронов к молю нейтральных атомов. Eср выражается в кДж/моль или в эВ. Наибольшие значения имеют галогены, кислород, сера, наименьшие и даже отрицательные значения её – элементы с электронной конфигурацией s2 (He, Be, Mg, Zn) ,с полностью или наполовину заполненными p-подоболочками (Ne, Ar, Kr, N, P, As).
Атомный радиус. По группе – возрастают. Al – Ga убывают.
