
- •П.А. Киселев, с.Б. Бокуть курс лекций по коллоидной химии
- •1. Коллоидная химия
- •1.1. Классификация коллоидных систем
- •1.2.Свойства коллоидных растворов
- •1.3. Методы приготовления коллоидных растворов
- •1.4. Оптические свойства и методы исследования коллоидных растворов
- •1.5.Рассеяние света (опалесценция)
- •1.6.Нефелометрия
- •1.7. Абсорбция (поглощение) света коллоидами и окраска коллоидных растворов
- •2. Молекулярно-кинетические свойства коллоидных растворов
- •2.1. Броуновское движение
- •2.2. Кинетическая устойчивость дисперсионных систем и седиментационное равновесие
- •2.3. Осмотическое давление
- •2.4. Равновесие Гиббса-Доннана
- •2.5. Электрические свойства коллоидных растворов. Электроосмос и электрофорез
- •2.6. Строение коллоидных частиц
- •3. Устойчивость дисперсных систем
- •3.1. Основные положения
- •3.2. Коагуляция гидрофобных коллоидов
- •3.3.Адсорбционно-сольватный барьер как фактор стабилизации коллоидных систем
- •3.4. Электрокинетический потенциал
- •3.5.Обратимость коагуляции. Пептизация
- •3.6. Студни и гели
- •4. Свойства растворов высокомолекулярных соединений
- •4.1. Набухание и растворение вмс
- •4.2. Термодинамические свойства растворов вмс
- •4.3. Вязкость растворов вмс
- •4.4. Растворы полимерных электролитов. Изоэлектрическая точка
- •5. Характеристика некоторых широко применяемых дисперсных систем
- •5.1. Общая характеристика эмульсий
- •5.2. Устойчивость эмульсий
- •5.3. Разрушение и обращение эмульсий
- •5.4. Пены
- •5.5. Суспензии
- •5.6. Аэрозоли
- •6. Характеристика некоторых спектральных методов исследования растворов вмс
- •6.1. Абсорбционная спектроскопия
- •6.2. Факторы, влияющие на абсорбционные свойства хромофора
- •6.3. Инфракрасная спектроскопия
- •6.4. Спектроскопия комбинационного рассеяния
- •6.5. Флуоресцентная спектроскопия
- •6.6. Изучение белков путем измерения их собственной флуоресценции
- •6.7. Поляризация флуоресценции
- •Содержание
2.5. Электрические свойства коллоидных растворов. Электроосмос и электрофорез
Возникновение электрического заряда на поверхности играет чрезвычайно большую роль в физической химии дисперсных систем и поверхностных явлений. Явления, связанные с взаимодействием электрического поля с зарядом жидкости или с поверхностным зарядом диспергированных частиц твердого тела, получили название электрокинетических.
Движение жидкости относительно стенок твердых тел при наложении электрического поля получило название электроосмос. Движение твердых частиц под воздействием электрического поля названоэлектрофорез. Оба эти явления были впервые открыты и описаны в 1809 г. профессором МГУ Ф.Ф.Рейсом.
Если в нижнюю зону U-образной трубки поместить пористое тело или пучок большого числа стеклянных капилляров, заполнить оба коленаU-образной трубки сильно разбавленным водным раствором электролита и пропускать ток, то жидкость будет перемещаться из одного колена в другое, т.е. будет осуществлять явление электроосмоса. Если пористая масса – стекло, то вода будет перемещаться к катоду. Объясняется это тем, что поверхность стекла адсорбирует гидроксид-ионы. В водном растворе остаются свободные ионы гидроксония, которые двигаются по направлению к катоду, увлекая за собой полярные молекулы воды.
Электрофорез в опытах рейса был осуществлен следующим образом: частицы диспергированной в воде глины передвигались при наложении электрического поля к аноду. Следовательно, частицы глины несут отрицательный заряд. Диспергированные частицы приобретают заряд вследствие избирательной адсорбции ионов.
2.6. Строение коллоидных частиц
Рассмотрим строение коллоидных частиц на примере коллоидного раствора иодида серебра, приготовленного из растворов AgNO3иKIпри избыткеAgNO3.
Твердая частица – ядро коллоидной частицы – кристаллы иодида серебра (AgJ)n(рис. 2.2). Поверхность ядра адсорбирует преимущественно ионыAg+, входящие в состав кристалла ядра, приобретая положительный заряд. Обозначим количество ионовAg+, адсорбированное ядром, черезn. Это количество входит в состав ядра. К заряженному ядру притягиваются противоионыNO3-, формируя двойной электрический слой. Часть противоионовn-xнаходится в адсорбционном слое, которые вместе с ядром составляют частицу, или гранулу. Остальная часть противоионов (х) находится в свободном объеме раствора. Пунктиром изображена линия, замыкающая весь объем
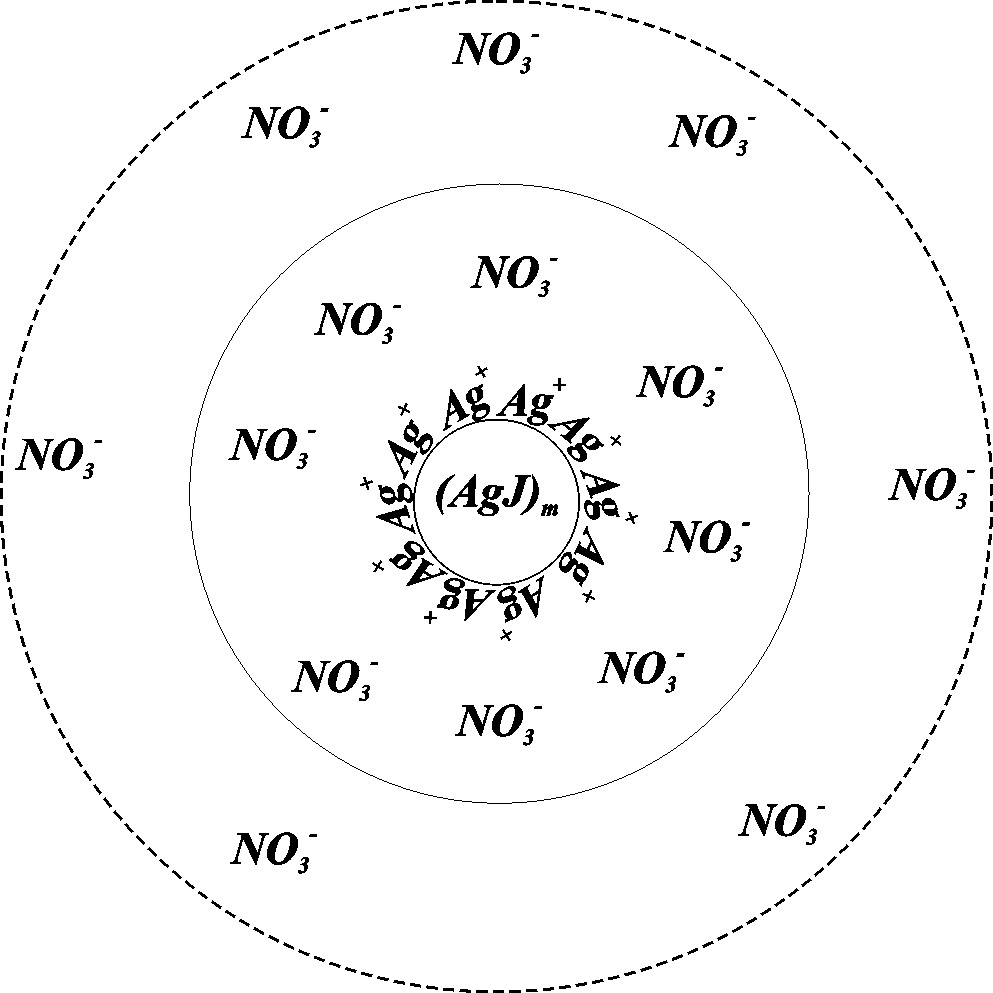
Рис. 2.2 Схема строения коллоидной частицы
электролита, в котором находятся противоионы. Ядро вместе с адсорбционным слоем и слоем свободной жидкости, в которой находятся противоионы, называется мицеллой.
В коллоидной химии принята такая форма записи строения мицеллы:
![]()
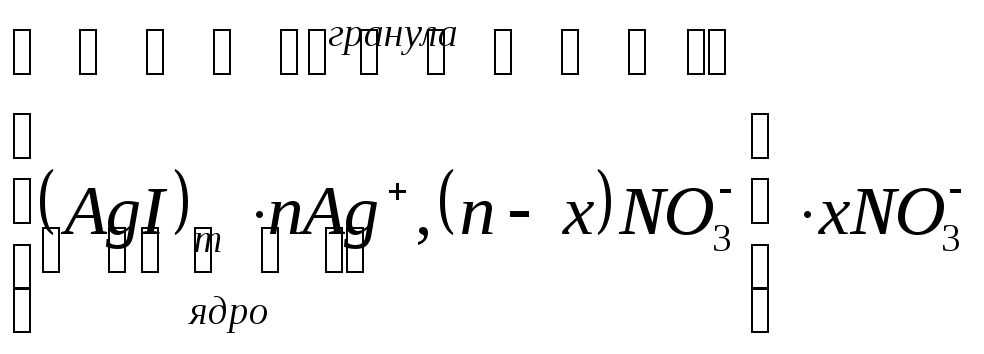
Эта формула соответствует схеме коллоидной частицы, изображенной на рис. 2.2.
3. Устойчивость дисперсных систем
3.1. Основные положения
Под устойчивостью системы понимают неизменность во времени ее основных параметров. В нашем случае такими параметрами являются дисперсность и равновесное распределение дисперсной фазы в среде. Коллоидные системы, за исключением растворов высокомолекулярных соединений (ВМС), представляют собой термодинамически неустойчивые системы. В месте с тем в плане устойчивости существует резкое различие между двумя основными классами: лиофильными и лиофобными коллоидами. Значительное взаимодействие дисперсной фазы со средой (лиофильность) способствует самопроизвольному диспергированию. Можно отметить глубокую общность процессов диспергирования (в случае лиофильных систем) и растворения, так как растворение также определяется соотношением энергии сольватации и энергии разрушения кристаллической решетки с учетом энтропии смешения.
Вопросы термодинамики равновесия и устойчивости дисперсных систем рассматривались в работах Фольмера, Ленгмюра, Онзагера и других ученых. Общие термодинамические соотношения, характеризующие процесс образования коллоидных систем, даны в работах Ребнидера, Щукина, а впоследствии Русанова, Куни.
В соответствии с этими представлениями к лиофильным дисперсным системам относят все системы, способные к самопроизвольному диспергированию.
Лиофобные коллоиды характеризуются энергией связи внутри дисперсной фазы, значительно большей, чем энергия межфазного взаимодействия, и эта разность не компенсируется энтропийным фактором. Поэтому диспергирование в этом случае не является самопроизвольным процессом, а может быть реализовано либо за счет внешней работы, либо за счет других процессов, протекающих в системе спонтанно (например, химических). Вследствие этого образующиеся дисперсии термодинамически неустойчивы. Такие системы, неспособные к самопроизвольному диспергированию, получили название лиофобных коллоидов, хотя и для них всегда характерна некоторая степень межфазного взаимодействия (лиофильность).
Несмотря на термодинамическую неустойчивость, многие лиофобные коллоидные системы в течение долгого времени (иногда десятилетиями) сохраняют свои свойства неизменными.
Для выяснения причин относительной устойчивости подобных систем прежде всего необходимо определить, о каком виде устойчивости идет речь. Различают два основных типа устойчивости: седиментационную (кинетическую) и агрегативную.Существует также понятиефазовой устойчивости.Кинетическая устойчивость дисперсной системы была подробно рассмотрена в п.2.
Агрегативная устойчивость может быть определена как способность системы к сохранению дисперсности и индивидуальности частиц дисперсной фазы. При потере агрегативной устойчивости происходит объединение частиц, приводящее к коагуляции дисперсной фазы.
Такое объединение частиц силами молекулярного притяжения может привести к образованию сплошной структурированной системы, обладающей фазовой устойчивостью. Однако в общем виде под коагуляцией понимают процесс слипания частиц, образования крупных агрегатов с потерей седиментационной устойчивости и последующим разделением фаз, заканчивающимся разрушением дисперсной системы.
В настоящее время различают два основных фактора агрегативной устойчивости – электростатический барьер, обусловленный силами отталкивания одноименно-заряженных коллоидных частиц, и адсорбционно-сольватный барьер, представленный молекулами дисперсионной среды, связанными с коллоидными частицами, что препятствует их взаимному сближению. Второй фактор доминирует в лиофилизованных системах и является весьма важным в обеспечении устойчивости систем с высоким содержанием дисперсной фазы (имеющих наибольшее практическое значение). Между обоими факторами существует взаимосвязь, заключающаяся прежде всего в том, что увеличение заряда и потенциала поверхности обычно способствует развитию сольватных оболочек и адсорбции стабилизаторов.
