
- •П.А. Киселев, с.Б. Бокуть курс лекций по коллоидной химии
- •1. Коллоидная химия
- •1.1. Классификация коллоидных систем
- •1.2.Свойства коллоидных растворов
- •1.3. Методы приготовления коллоидных растворов
- •1.4. Оптические свойства и методы исследования коллоидных растворов
- •1.5.Рассеяние света (опалесценция)
- •1.6.Нефелометрия
- •1.7. Абсорбция (поглощение) света коллоидами и окраска коллоидных растворов
- •2. Молекулярно-кинетические свойства коллоидных растворов
- •2.1. Броуновское движение
- •2.2. Кинетическая устойчивость дисперсионных систем и седиментационное равновесие
- •2.3. Осмотическое давление
- •2.4. Равновесие Гиббса-Доннана
- •2.5. Электрические свойства коллоидных растворов. Электроосмос и электрофорез
- •2.6. Строение коллоидных частиц
- •3. Устойчивость дисперсных систем
- •3.1. Основные положения
- •3.2. Коагуляция гидрофобных коллоидов
- •3.3.Адсорбционно-сольватный барьер как фактор стабилизации коллоидных систем
- •3.4. Электрокинетический потенциал
- •3.5.Обратимость коагуляции. Пептизация
- •3.6. Студни и гели
- •4. Свойства растворов высокомолекулярных соединений
- •4.1. Набухание и растворение вмс
- •4.2. Термодинамические свойства растворов вмс
- •4.3. Вязкость растворов вмс
- •4.4. Растворы полимерных электролитов. Изоэлектрическая точка
- •5. Характеристика некоторых широко применяемых дисперсных систем
- •5.1. Общая характеристика эмульсий
- •5.2. Устойчивость эмульсий
- •5.3. Разрушение и обращение эмульсий
- •5.4. Пены
- •5.5. Суспензии
- •5.6. Аэрозоли
- •6. Характеристика некоторых спектральных методов исследования растворов вмс
- •6.1. Абсорбционная спектроскопия
- •6.2. Факторы, влияющие на абсорбционные свойства хромофора
- •6.3. Инфракрасная спектроскопия
- •6.4. Спектроскопия комбинационного рассеяния
- •6.5. Флуоресцентная спектроскопия
- •6.6. Изучение белков путем измерения их собственной флуоресценции
- •6.7. Поляризация флуоресценции
- •Содержание
4.2. Термодинамические свойства растворов вмс
Свойства растворов ВМС тесно связаны со строением, размерами и гибкостью макромолекул в растворе, а также энергией их взаимодействия с растворителем. Последний фактор особенно важен, поскольку сродство полимера к растворителю определяет форму молекулярных клубков.
Как любые высокодисперсные системы, частицы которых подвержены тепловому давлению, растворы ВМС проявляют осмотическое давление. Осмотическое давление разбавленных идеальных растворов НМС описывается уравнением Вант-Гоффа:
![]() , (4.1)
, (4.1)
где с– мольно-объемная концентрация;m– концентрация растворенного вещества, выраженная в единицах массы. Оно является количественным, т.е. определяется только концентрацией частиц в растворе. Осмотическое давление ВМС вследствие их больших молекулярных масс невелико. Однако даже в сравнительно разбавленных растворах ВМС измеренное осмотическое давление (рис. 4.3., кривая 1) оказывается большим, чем вычисленное по уравнению Вант-Гоффа (кривая 2).
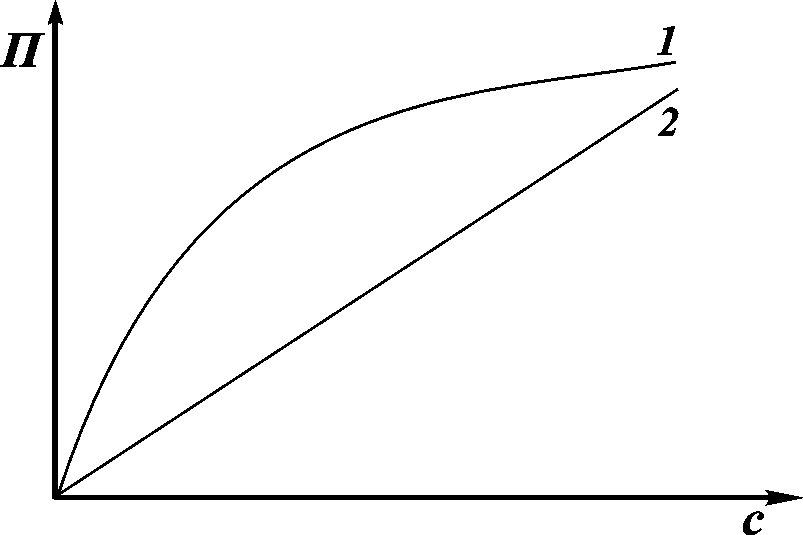
Рис. 4.3. Зависимость осмотического давления от концентрации раствора ВМС (1) и НМС (2)
Степень отклонения больше в растворителях, которые обеспечивают более высокую гибкость полимера. Объясняется это тем, что для длинных гибких макромолекул характерна так называемая сегментарная форма молекулярно-кинетического движения. Отдельные части (сегменты) макромолекулы, расположенные достаточно далеко друг друга, оказываются независимыми в своем тепловом движении. Поэтому молекула ведет себя в растворе, как несколько молекул меньшего размера или несколько отдельных кинетических элементов. Чем более гибка и асимметрична молекула в растворе, тем более осмотическое давление отличается от вычисленного.
Поэтому для описания зависимости осмотического давления от концентрации полимеров было предложено уравнение:
![]() , (4.2)
, (4.2)
где – коэффициент, учитывающий форму (гибкость) макромолекул в растворе и энергию взаимодействия полимера с растворителем.
Чем больше число сегментов (т.е. больше гибкость), тем выше поправочный коэффициент . Для веществ с формой, близкой к сферической (гемоглобин в воде)= 0.
Растворы ВМС, как истинные растворы, подчиняющиеся правилу фаз, обнаруживают понижение давления насыщенного пара растворителя над раствором по сравнению с чистым растворителем. Для них характерны отрицательные отклонения от закона Рауля. Изучая термодинамические характеристики растворов полимеров, можно судить об их строении и свойствах.
4.3. Вязкость растворов вмс
Большое количество исследований размеров и формы ВМС было выполнено методом измерения вязкости растворов. Для характеристики связи между вязкостью системы и вязкостью дисперсионной средыоиспользуют величины:
относительной
вязкости
![]()
удельной
вязкости
![]()
приведенной
вязкости
![]()
т.е. удельной вязкости, отнесенной к единице концентрации.
Приведенная вязкость, экстраполированная к бесконечному разведению, т.е. рассчитанная для условий, исключающих взаимодействие частиц дисперсной фазы между собой, носит название характеристической вязкости дисперсной системы:
![]() .
.
Только очень разбавленные растворы ВМС ведут себя как идеально вязкие жидкости – их вязкость подчиняется законам Ньютона и Пуазейля, т.е. не зависит от скорости течения. В более концентрированных растворах полимеров наблюдается ряд аномалий – непостоянство вязкости при изменении скорости течения, непропорциональное возрастание ее с повышением концентрации. Аномалии связаны с несимметричной формой частиц дисперсной фазы. В растворах ВМС асимметричная форма макромолекул усугубляется их повышенной гибкостью и связанной с ней сегментарной формой теплового движения. При высокой степени сольватируемости значительная часть объема растворителя оказывается включенной в сольватные оболочки макромолекул. Поэтому молекулы растворителя теряют подвижность, что также приводит к повышению вязкости.
Изучение вязкости разбавленных растворов, тем не менее, может дать косвенную информацию о молярной массе полимеров. Согласно уравнению Эйнштейна, описывающему зависимость вязкости от концентрации, оказалось, что для растворов ВМС коэффициент kэтого уравнения зависит от степени полимеризации ВМС. Вязкость растворов ВМС одного полимергомологического ряда с различной относительной молярной массой в одном и том же растворителе различна, т.е. удельная вязкость увеличивается с ростом М.
По Э. Штаудингеру, эта зависимость имеет вид:
уд = kMс, (4.3)
где с - молярно-массовая концентрация раствора, выраженная в молях мономера цепи на 1 л раствора; k – константа, характерная для длинного гомологического ряда, зависящая от взаимодействия молекул ВМС с растворителем. Более детальное изучение показало, что это уравнение справедливо лишь в узком интервале молярных масс и для сравнительно коротких или более длинных, но достаточно жестких макромолекул. При увеличении длины макромолекулы, ее гибкости и асимметрии эта зависимостьудот М нарушается. Для учета этих факторов была предложена обобщенная форма уравнения Штаудингера
[] = kM(4.4)
где []– характеристическая вязкость раствора,– величина, учитывающая свертывание макромолекул (гибкости цепи) и имеющая значение от 0,5 для растворов с низкой степенью сольватации, когда форма макромолекул близка к сферической, до ~ 1 для жестких макромолекул, имеющих палочкообразную форму.
