
- •П.А. Киселев, с.Б. Бокуть курс лекций по коллоидной химии
- •1. Коллоидная химия
- •1.1. Классификация коллоидных систем
- •1.2.Свойства коллоидных растворов
- •1.3. Методы приготовления коллоидных растворов
- •1.4. Оптические свойства и методы исследования коллоидных растворов
- •1.5.Рассеяние света (опалесценция)
- •1.6.Нефелометрия
- •1.7. Абсорбция (поглощение) света коллоидами и окраска коллоидных растворов
- •2. Молекулярно-кинетические свойства коллоидных растворов
- •2.1. Броуновское движение
- •2.2. Кинетическая устойчивость дисперсионных систем и седиментационное равновесие
- •2.3. Осмотическое давление
- •2.4. Равновесие Гиббса-Доннана
- •2.5. Электрические свойства коллоидных растворов. Электроосмос и электрофорез
- •2.6. Строение коллоидных частиц
- •3. Устойчивость дисперсных систем
- •3.1. Основные положения
- •3.2. Коагуляция гидрофобных коллоидов
- •3.3.Адсорбционно-сольватный барьер как фактор стабилизации коллоидных систем
- •3.4. Электрокинетический потенциал
- •3.5.Обратимость коагуляции. Пептизация
- •3.6. Студни и гели
- •4. Свойства растворов высокомолекулярных соединений
- •4.1. Набухание и растворение вмс
- •4.2. Термодинамические свойства растворов вмс
- •4.3. Вязкость растворов вмс
- •4.4. Растворы полимерных электролитов. Изоэлектрическая точка
- •5. Характеристика некоторых широко применяемых дисперсных систем
- •5.1. Общая характеристика эмульсий
- •5.2. Устойчивость эмульсий
- •5.3. Разрушение и обращение эмульсий
- •5.4. Пены
- •5.5. Суспензии
- •5.6. Аэрозоли
- •6. Характеристика некоторых спектральных методов исследования растворов вмс
- •6.1. Абсорбционная спектроскопия
- •6.2. Факторы, влияющие на абсорбционные свойства хромофора
- •6.3. Инфракрасная спектроскопия
- •6.4. Спектроскопия комбинационного рассеяния
- •6.5. Флуоресцентная спектроскопия
- •6.6. Изучение белков путем измерения их собственной флуоресценции
- •6.7. Поляризация флуоресценции
- •Содержание
5.6. Аэрозоли
Аэрозоли представляют собой дисперсные системы, в которых дисперсная фаза – жидкость или твердое тело, а дисперсионная среда – газ, обычно воздух. В первом случае это туманы, во втором – дым, пыль. Дисперсность аэрозолей значительно меньше дисперсности коллоидных частиц. Однако наряду с частицами, величина которых равна нескольким миллиметрам, могут быть частицы и малых размеров. Размеры частиц табачного дыма составляют 0,1‑1,0 мкм, топливного дыма – 0,1‑100 мкм, тумана (Н2О) – 0,5 мкм.
Скорость оседания частиц аэрозоля, определяемая седиментационной формулой, весьма велика в связи с малой вязкостью дисперсионной среды.
Аэрозоли, как правило, – агрегативно неустойчивые системы, так как взаимодействие между поверхностями твердых или жидких частиц и газообразной средой практически отсутствует. Частицы аэрозолей могут приобретать электрический заряд, адсорбируя ионы газовой фазы. Однако величина заряда, как правило невелика, чтобы противодействовать их агрегации. В отличие от лиозолей частицы в аэрозолях не имеют диффузного слоя.
Аэрозоли рассеивают свет и подчиняются в первом приближении уравнению Рэллея.
Аэрозоли органических веществ – угля, сахара, муки, бумаги – взрывоопасны. Вследствие того, что они имеют развитую поверхность, их взаимодействие с кислородом воздуха происходит с большой скоростью, что при значительном тепловом эффекте и приводит к взрыву.
6. Характеристика некоторых спектральных методов исследования растворов вмс
Для изучения свойств ВМС и, в частности, биологических макромолекул применяются практически все известные к настоящему времени физико-химические методы. Здесь мы коснемся лишь некоторых спектральных подходов, без которых сегодня не обходится ни одна научно-исследовательская лаборатория.
6.1. Абсорбционная спектроскопия
Молекулы поглощают свет. Длины волн, при которых происходит поглощение, и степень поглощения зависят от структуры и от окружения молекулы, поэтому адсорбционная спектроскопия является полезным инструментом для характеристики макромолекул различного размера.
Световая волна состоит из взаимно перпендикулярных электрического и магнитного полей, амплитуды которых по мере распространения в пространстве изменяются по синусоиде.
Энергия равна
![]() , (6.1)
, (6.1)
где h – постоянная Планка; с – скорость света; – длина волны;– частота. Когда волна сталкивается с молекулой, она может либо рассеиваться (т.е. изменяется направление ее распространения), либо поглощается. Если произошло поглощение электромагнитной энергии света, о молекуле говорят, что она возбуждена или перешла в возбужденное состояние. Молекула или часть молекулы, которая может быть возбуждена посредством поглощения света в видимой и ближней ультрафиолетовой (УФ) -области, называется хромофором.
Поглощение энергии происходит с наибольшей вероятностью только в том случае, если количество поглощенной энергии соответствует разности энергий квантованных состояний. Это можно выразить, констатируя, что свет с длиной волны l поглощается только тогда, когда
![]() ,
,
где Е1– энергетический уровень молекулы до поглощения; E2 – энергетический уровень, достигаемый в результате поглощения.
Изменение энергетического состояния при испускании или поглощении кванта называется переходом. Зависимость вероятности поглощения от длины волны называется спектром поглощения.
Если бы все переходы происходили только между самыми низкими колебательными уровнями основного состояния и первого возбужденного состояния, тогда спектр состоял бы из узких, дискретных линий. Однако, поскольку возможны переходы из основного состояния на любой колебательный и вращательный уровни первого возбужденного состояния, а линии имеют конечную ширину, то спектр проявляется в виде относительно плавной кривой. (Далеко не все переходы происходят с высокой вероятностью: в реальных системах действуют определенные ограничения, или правила отбора квантовой механики. Эти правила мы здесь обсуждать не будем.)
Для большинства молекул длины волн, соответствующие переходам между основным состоянием и любым колебательным уровнем первого возбужденного состояния, лежат в ультрафиолетовой и видимой области спектра. Возможны также низкие по энергии переходы между колебательными уровнями в пределах одного электронного уровня. Эти переходы происходят в результате поглощения в инфракрасной области.
На рис. 6.1 показана часть электромагнитного спектра, представляющая интерес для биологических исследований, и обозначены переходы, которые возникают при поглощении излучения в различных диапазонах частот.
Вероятность перехода при одной длине волны характеризуется молярным коэффициентом поглощения при этой длине волны – см. (14.5) – (14.7)
В
практике биологических исследований
для характеристики спектральных свойств
объекта наиболее широко используется
параметр, называемый оптической
плотностью и обозначаемый как Dили А. Этот параметр равен![]() ,
гдеI0–
интенсивность падающего, аI– поглощенного света.
,
гдеI0–
интенсивность падающего, аI– поглощенного света.
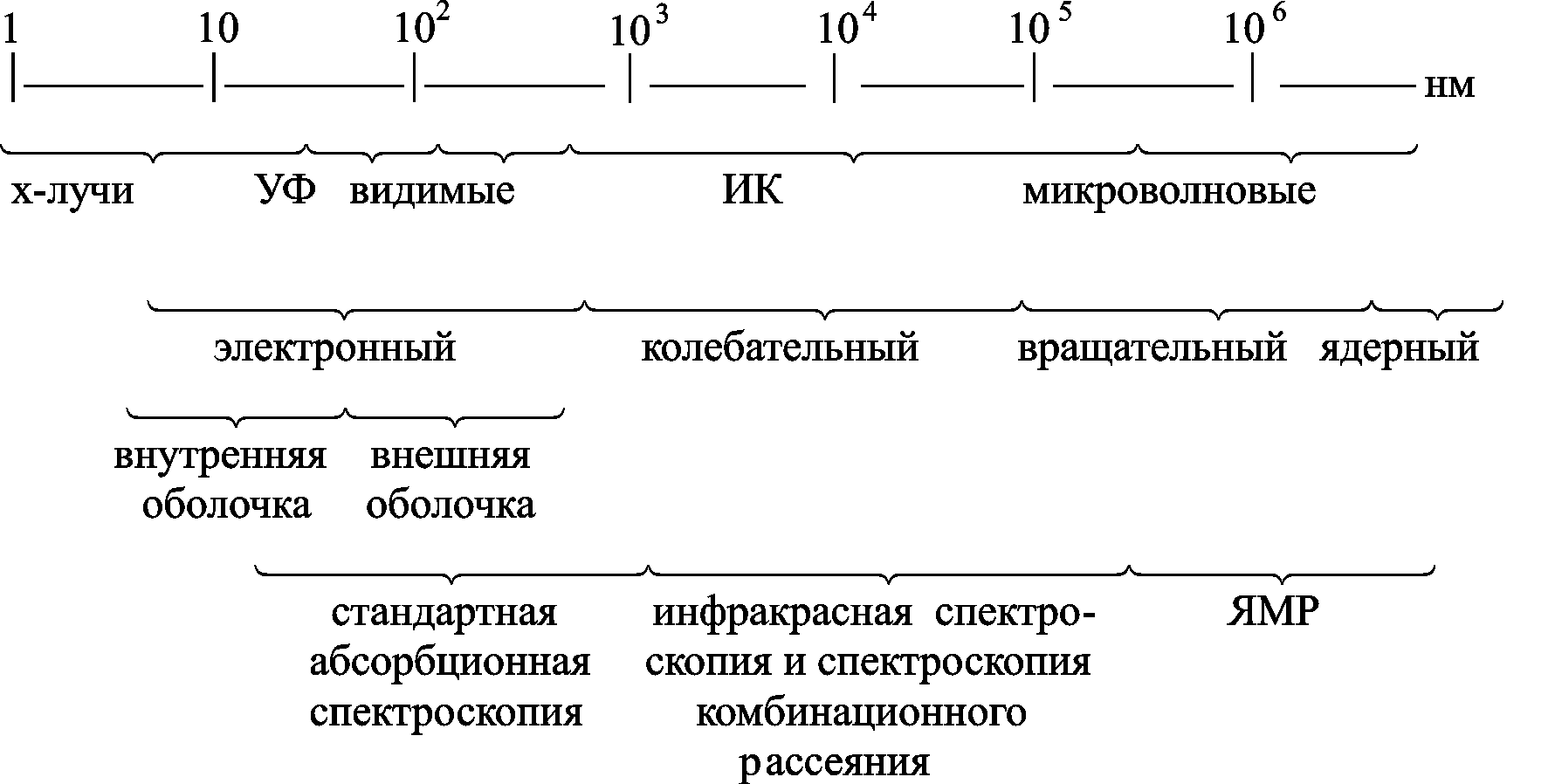
Рис. 6.1. Часть электромагнитного спектра, представляющая интерес для биологических исследований
В этом случае закон Ламберта – Бера можно записать следующим образом:
![]() , (6.2)
, (6.2)
где А– оптическая плотность,k– молярный коэффициент поглощения,с– концентрация,– длина оптического пути (толщина слоя раствора). Оптической плотностью удобно пользоваться, поскольку она отличается прямо пропорциональной зависимостью от концентрации раствора.
В некоторых случаях, если свелико,kстановится функциейс,и тогда можно сказать, что закон Ламберта-Бера нарушается. Это может быть результатом рассеяния света или структурных изменений (например, димеризации, агрегации или химических изменений) при высоких концентрациях.
