
- •П.А. Киселев, с.Б. Бокуть курс лекций по коллоидной химии
- •1. Коллоидная химия
- •1.1. Классификация коллоидных систем
- •1.2.Свойства коллоидных растворов
- •1.3. Методы приготовления коллоидных растворов
- •1.4. Оптические свойства и методы исследования коллоидных растворов
- •1.5.Рассеяние света (опалесценция)
- •1.6.Нефелометрия
- •1.7. Абсорбция (поглощение) света коллоидами и окраска коллоидных растворов
- •2. Молекулярно-кинетические свойства коллоидных растворов
- •2.1. Броуновское движение
- •2.2. Кинетическая устойчивость дисперсионных систем и седиментационное равновесие
- •2.3. Осмотическое давление
- •2.4. Равновесие Гиббса-Доннана
- •2.5. Электрические свойства коллоидных растворов. Электроосмос и электрофорез
- •2.6. Строение коллоидных частиц
- •3. Устойчивость дисперсных систем
- •3.1. Основные положения
- •3.2. Коагуляция гидрофобных коллоидов
- •3.3.Адсорбционно-сольватный барьер как фактор стабилизации коллоидных систем
- •3.4. Электрокинетический потенциал
- •3.5.Обратимость коагуляции. Пептизация
- •3.6. Студни и гели
- •4. Свойства растворов высокомолекулярных соединений
- •4.1. Набухание и растворение вмс
- •4.2. Термодинамические свойства растворов вмс
- •4.3. Вязкость растворов вмс
- •4.4. Растворы полимерных электролитов. Изоэлектрическая точка
- •5. Характеристика некоторых широко применяемых дисперсных систем
- •5.1. Общая характеристика эмульсий
- •5.2. Устойчивость эмульсий
- •5.3. Разрушение и обращение эмульсий
- •5.4. Пены
- •5.5. Суспензии
- •5.6. Аэрозоли
- •6. Характеристика некоторых спектральных методов исследования растворов вмс
- •6.1. Абсорбционная спектроскопия
- •6.2. Факторы, влияющие на абсорбционные свойства хромофора
- •6.3. Инфракрасная спектроскопия
- •6.4. Спектроскопия комбинационного рассеяния
- •6.5. Флуоресцентная спектроскопия
- •6.6. Изучение белков путем измерения их собственной флуоресценции
- •6.7. Поляризация флуоресценции
- •Содержание
6.2. Факторы, влияющие на абсорбционные свойства хромофора
Спектр поглощения хромофора определяется в первую очередь химической структурой молекулы. Однако Imaxиkпретерпевают заметные изменения и под влиянием окружения. Влияние окружения состоит в следующем.
Эффект рН.рН раствора определяет ионную форму ионизируемых хромофоров (рис. 6.2).
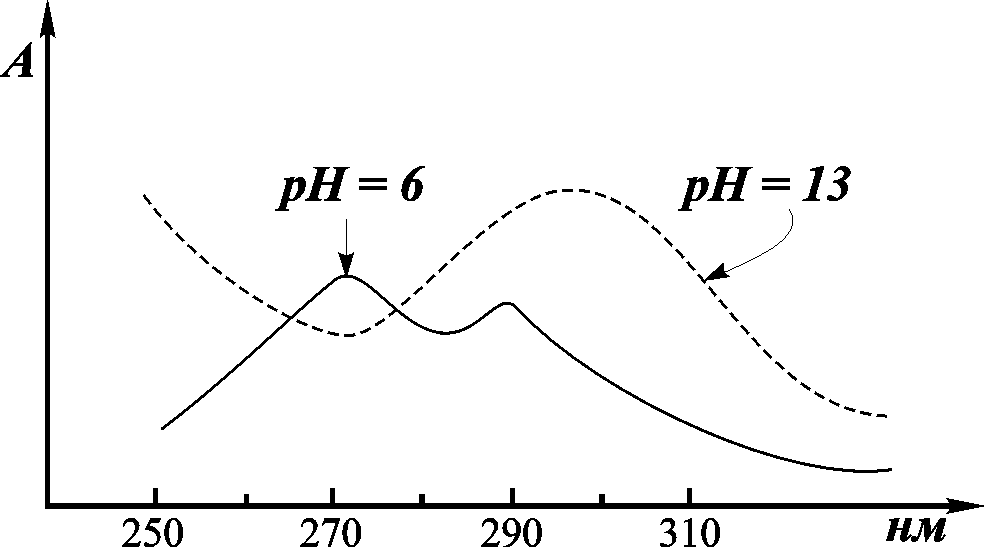
Рис. 6.2. Спектр поглощения тирозина
Эффект полярности.В случае полярных хромофоров часто справедливо (особенно если молекула содержит O, N или S), чтоmaxнаблюдается при более коротких длинах волн в полярных растворителях, содержащих гидроксил (Н2О, спирты), чем в неполярных.
Эффект ориентации.Величиныmax и k существенно зависят от геометрических особенностей молекулы. Известна гипохромия нуклеиновых кислот, т.е. понижение коэффициента поглощения при условии, что нуклеотид входит в состав одноцепочечного полинуклеотида, в котором нуклеиновые основания сближены и расположены друг над другом.
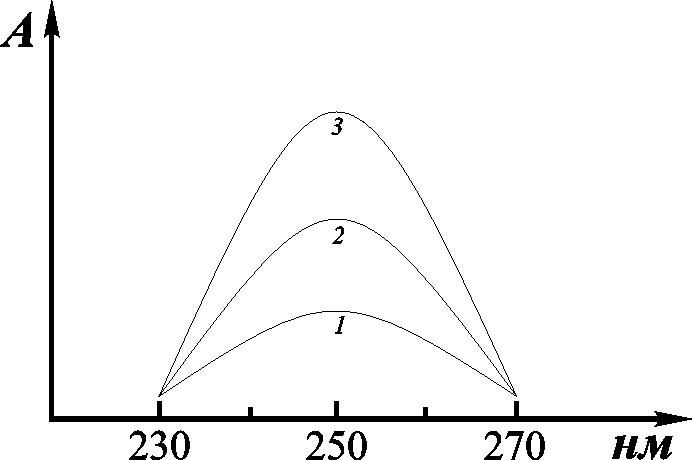
Рис. 6.3. Спектр поглощения двухцепочечной (1) и одноцепочечной (2) ДНК фага Т7, после гидролиза до свободных нуклеотидов (3)
В результате исследований большого числа биологически важных соединений собран ряд эмпирических фактов, которые могут быть названы рабочими правилами абсорбционной спектроскопии биологически важных объектов.
Эмпирические правила интерпретации спектров поглощения биологических макромолекул.
1. Если аминокислоты (триптофан, тирозин, феналаламин и гистидин) перемещаются в менее полярное окружение, мах иkвозрастают. Следовательно:
а) если спектр аминокислоты, находящейся в составе белка, зарегистрирован в полярном растворителе, и при этом наблюдаются большие мах иk, чем эти же величины для свободной аминокислоты в том же растворителе, то эта аминокислота находится во внутренней области белка, спрятана и окружена неполярными аминокислотами;
б) если спектр белка чувствителен к изменению полярности растворителя, аминокислота, для которой наблюдаются изменения мах иk, должна располагаться на поверхности белка.
2. В случае аминокислот мах иkвсегда возрастают, когда титруемая группа (например, ОН тирозина иSHцистеина) заряжена. Следовательно:
а) если не наблюдается изменений в спектре одной из этих аминокислот, а рН таково, что должна бы происходить ионизация свободной кислоты, то она должна быть спрятана в неполярной области молекулы белка;
б) если значение рК ионизируемой группы аминокислоты, определенное по изменению спектра при изменении рН, такое же, как для свободной аминокислоты в растворе, то эта аминокислота находится на поверхности белка;
в) если значение рК, определенное по изменению спектра при изменении рН, существенно другое, то эта аминокислота, вероятно, находится в очень полярном окружении (например, тирозин, окруженный карбоксильными группами).
3. Величина kпуринов и пиримидинов понижается по мере того, как плоскости их колец становятся параллельными и кольца сближаются друг с другом (по мере увеличения стэкинга) (рис. 6.3). Величинаkпонижается в следующем ряду:свободное основание > основание в составе одноцепочечного полинуклеотида, не имеющего стэкинга > основание в составе одноцепочечного полинуклеотида со стэкингом > основание в составе двухцепочечного полинуклеотида.
