
- •П.А. Киселев, с.Б. Бокуть курс лекций по коллоидной химии
- •1. Коллоидная химия
- •1.1. Классификация коллоидных систем
- •1.2.Свойства коллоидных растворов
- •1.3. Методы приготовления коллоидных растворов
- •1.4. Оптические свойства и методы исследования коллоидных растворов
- •1.5.Рассеяние света (опалесценция)
- •1.6.Нефелометрия
- •1.7. Абсорбция (поглощение) света коллоидами и окраска коллоидных растворов
- •2. Молекулярно-кинетические свойства коллоидных растворов
- •2.1. Броуновское движение
- •2.2. Кинетическая устойчивость дисперсионных систем и седиментационное равновесие
- •2.3. Осмотическое давление
- •2.4. Равновесие Гиббса-Доннана
- •2.5. Электрические свойства коллоидных растворов. Электроосмос и электрофорез
- •2.6. Строение коллоидных частиц
- •3. Устойчивость дисперсных систем
- •3.1. Основные положения
- •3.2. Коагуляция гидрофобных коллоидов
- •3.3.Адсорбционно-сольватный барьер как фактор стабилизации коллоидных систем
- •3.4. Электрокинетический потенциал
- •3.5.Обратимость коагуляции. Пептизация
- •3.6. Студни и гели
- •4. Свойства растворов высокомолекулярных соединений
- •4.1. Набухание и растворение вмс
- •4.2. Термодинамические свойства растворов вмс
- •4.3. Вязкость растворов вмс
- •4.4. Растворы полимерных электролитов. Изоэлектрическая точка
- •5. Характеристика некоторых широко применяемых дисперсных систем
- •5.1. Общая характеристика эмульсий
- •5.2. Устойчивость эмульсий
- •5.3. Разрушение и обращение эмульсий
- •5.4. Пены
- •5.5. Суспензии
- •5.6. Аэрозоли
- •6. Характеристика некоторых спектральных методов исследования растворов вмс
- •6.1. Абсорбционная спектроскопия
- •6.2. Факторы, влияющие на абсорбционные свойства хромофора
- •6.3. Инфракрасная спектроскопия
- •6.4. Спектроскопия комбинационного рассеяния
- •6.5. Флуоресцентная спектроскопия
- •6.6. Изучение белков путем измерения их собственной флуоресценции
- •6.7. Поляризация флуоресценции
- •Содержание
1.7. Абсорбция (поглощение) света коллоидами и окраска коллоидных растворов
Окраска коллоидных растворов, как и других дисперсных систем, связана с явлениями рассеяния и поглощения света. Поглощение света имеет четко выраженный избирательный характер. Рассеяние света придает коллоиду красноватую окраску в проходящем свете и голубоватую – в рассеянном. В целом окраска коллоидных растворов определяется наложением двух эффектов – рассеяния и поглощения света. С изменением дисперсности или формы частиц дисперсной фазы изменяется вклад обоих эффектов, что вызывает изменения окраски дисперсной системы.
Для молекулярных растворов поглощение света можно количественно описать формулой Ламберта-Бера:
![]()
![]() , (1.5)
, (1.5)
где IиI0– интенсивность падающего света и света, прошедшего через раствор; с – концентрация растворенного вещества;- толщина слоя раствора;k– коэффициент поглощения.
Относительная прозрачность может быть выражена отношением
![]() , (1.6)
, (1.6)
относительное поглощение –
![]() . (1.7)
. (1.7)
Для коллоидных растворов в формулу (1.5) должна быть внесена поправка, учитывающая рассеяние света, которое эквивалентно дополнительному поглощению света.
Одна из модификаций формулы (1.5), учитывающая светорассеяние, имеет вид:
![]() , (1.8)
, (1.8)
где V– объем коллоидной частицы.
Для золей металлов все закономерности намного сложнее. Для них отмечается аномалия как в поглощении света, так и в рассеянии. При этом для них характерно значительное поглощение света, что определяет интенсивность их окраски. Для обоих оптических эффектов наблюдаются максимумы, зависящие от длины волны и степени дисперсности золя. Так, соли золота с частицами близкими к сферической форме радиусом 20 нм имеют максимум адсорбции при =530 нм, что отвечает адсорбции зеленых лучей. Соответственно они приобретают красную окраску. Соли золота с радиусом 30 нм имеют максимум адсорбции при=600 нм. При этом золь приобретает синюю окраску.
Приведенные данные находятся в хорошем соответствии с теоретическими расчетами Ми.
В ряде случаев и для неметаллических золей характерна яркая окраска (золи берлинской лазури, гидроксида железа (III), сульфида сурьмы), интенсивность которой заметно снижается при понижении степени дисперсности.
2. Молекулярно-кинетические свойства коллоидных растворов
2.1. Броуновское движение
В 1827 г. английский ботаник Р. Броун заметил, что частицы цветочной пыльцы, взвешенные в воде, находящиеся в поле зрения микроскопа, непрерывно двигаются по сложным траекториям, не оставаясь ни на мгновение в покое. Только в 1905 г. А. Эйнштейн на основе законов статистической механики дал точную количественную теорию броуновского движения.
Известно, что фундаментальные исследования Л. Больцмана, заложившие основу статистической физики, отвергались многими крупнейшими физиками того времени. Теория броуновского движения, созданная Эйнштейном, подтвержденная экспериментально, продемонстрировала полную достоверность основных положений Л. Больцмана. Не меньшую роль здесь сыграли теоретические исследования М. Смолуховского, которые отличались от работ А. Эйнштейна лишь несколько меньшей строгостью, но были более наглядны.
В ходе теоретических исследований диффузии взвешенных в жидкости шаров малой величины (модель глобулярных коллоидных частиц) А. Эйнштейн вывел формулу
![]() , (2.1)
, (2.1)
где D– коэффициент диффузии;r– радиус частицы;N– число Авогадро;– коэффициент вязкости дисперсионной среды. Как видно из формулы, коэффициент диффузии зависит от Т, вязкости и размеров частицы. Коллоидная частица перемещается в результате столкновений и постоянно меняет направление и скорость. Она претерпевает в воздухе 1016столкновений в секунду, а в воде – 1020. По расчетам Смолуховского, она при этом приобретает скорость порядка 102‑104см/сек.
Соединяя прямыми линиями положение частицы в поле наблюдения через определенные, но равные промежутки времени, мы получим проекцию сдвига частицы (рис. 2.1). Каждый отрезок этой ломаной есть проекция сдвига частицы за время наблюдения.
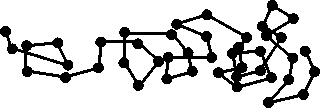
Рис. 2.1. Проекция сдвига частицы
Для расчета величины сдвига за время используют средне-квадратичную величину смещения (сдвига)х2:
![]() , (2.2)
, (2.2)
где х1, х2, хn– отдельные наблюдаемые смещения частицы,n– число смещений.
А. Эйнштейном получена формула, связывающая коэффициент диффузии со среднеквадратичной величиной сдвига:
![]() . (2.3)
. (2.3)
Сопоставим (2.1) и (2.3) и получим:
![]() . (2.4)
. (2.4)
И далее:
![]() . (2.5)
. (2.5)
Формула (2.5) позволяет определить число Авогадро по результатам измерения частных значений величин сдвига, коэффициента вязкости и размера частиц. Формулы А. Эйнштейна были подтверждены Ж. Перреном и его учениками Они наблюдали за движением частиц с помощью микроскопа и регистрировали их положения через равные промежутки времени. Подставив полученные значения в формулу (2.5), они получили величину N, близкую к действительной.
Он, кроме того, подверг экспериментальной проверке формулу (2.4), исследовав величину сдвига частиц в коллоидных растворах золота с частицами величиной r, равной 27 и 52 нм, и подтвердил ее.
Формула (2.1) также была подвергнута экспериментальной проверке. Так, при постоянной температуре изменяли вязкость дисперсионной среды. В этом случае величина сдвига
![]() ,
,
где
![]() – величина постоянная.
– величина постоянная.
Формула была подтверждена при различных соотношениях /, а также при различных значениях длительности наблюдений.
На основе экспериментальных данных (измерений Т, определения вязкости и величины сдвига) были вычислены размеры коллоидных частиц.
Долгое время существование молекул и атомов, которые нельзя было наблюдать и представления о которых вводились молекулярно-кинетической теорией, отрицалось. Например, физико-химик В. Оствальд утверждал, что эти частицы являются лишь удобной "фикцией", которая дает возможность получать полезные результаты.
Теория коллоидных растворов со всеми ее выводами и уравнениями, в основе которых лежат молекулярно-кинетические представления, получила полное экспериментальное подтверждение. Эти частицы можно было видеть, подсчитать количество, определить скорость их движения, величину и частоту флуктуаций.
Таким образом была доказана достоверность основных предпосылок и выводов молекулярно-кинетической теории на отдельных частицах.
