
3. . . .
.pdfЕ.Н. Калюкова
Н.Н. Иванская
химия
Учебное пособие для студентов всех специальностей
заочной формы обучения
Ульяновск
2010
УДК 546 (075) ББК 24я7
К17
Рецензенты: кандидат химических наук, доцент М. А. Ахметов кандидат химических наук, доцент Л. А. Михеева
Утверждено редакционно-издательским советом университета в качестве учебного пособия
Калюкова, Е. Н.
К 17 Химия : учебное пособие для студентов всех специальностей заочной формы обучения / Е. Н. Калюкова, Н. Н. Иванская. - Ульяновск : УлГТУ, 2010.-170 с.
ISNB 978-5-9795-0582-4
Пособие предназначено для студентов первого курса заочной формы обуче ния нехимических специальностей вузов. Оно поможет студентам усвоить теоре тический материал по основным разделам дисциплины. В каждой теме кроме тео ретического материала рассмотрены примеры решения основных типов задач.
Пособие предоставляет студенту-заочнику возможность освоить теоретиче ский материал курса и выполнить контрольную работу по химии.
УДК 546 (075) ББК 24я7
© Калюкова Е. Н., Иванская Н. Н., 2010 ISNB 978-5-9795-0582-4 © Оформление. УлГТУ, 2010

СОДЕРЖАНИЕ
Введение 5 Методические рекомендации студентам при освоении курса химии 5
1. Основные понятия и стехиометрические законы химии 10 Задания для самостоятельной работы 17
2. Эквивалент 20 Задания для самостоятельной работы 29
3.Электронная структура атомов. Зависимость свойств элементов от строения их атомов 31
Задания для самостоятельной работы 38
4.Периодическая система элементов Д. И. Менделеева 41
Задания для самостоятельной работы 46
5.Способы выражения состава растворов 50 Задания для самостоятельной работы 62
6.Энергетика химических реакций. Химико-термодинамические расчеты 65
Задания для самостоятельной работы 75
7.Скорость химических реакций. Химическое равновесие 79 Задания для самостоятельной работы 90
8.Гидролиз солей 94
Задания для самостоятельной работы 98 9. Электрохимические процессы. Окислительно-восстановительные реакции 101
Задания для самостоятельной работы 106
10.Электродный потенциал. Гальванические элементы 112 Задания для самостоятельной работы . 118
11.Коррозия металлов. Способы защиты металлов от коррозии ... 123 Задания для самостоятельной работы 136
12.Электролиз 140
Задания для самостоятельной работы 147
3
Заключение . . 151 Предметный указатель 152 Приложения 154
Таблица ПЛ. Термодинамические константы некоторых веществ 154 Таблица П.2. Названия некоторых кислот и их солей 161
Таблица П.З. Константы диссоциации некоторых слабых элек тролитов в водных растворах при 25 °С 162 Таблица П.4. Растворимость оснований и солей в воде 164
Таблица П.5. Стандартные электродные потенциалы металлов при 25 °С (Ряд напряжений металлов) 165
Таблица П.6. Стандартные потенциалы  некоторых окисли тельно-восстановительных электродов в водных растворах при 298 К 166
некоторых окисли тельно-восстановительных электродов в водных растворах при 298 К 166
Библиографический список 170
4
ВВЕДЕНИЕ
Учебное пособие предназначено для студентов I курса всех специаль ностей заочно-вечернего факультета, изучающих курс «Химия» в ГОУ ВПО «Ульяновский государственный технический университет».
Пособие составлено в соответствии с государственным образователь ным стандартом по химии для студентов нехимических специальностей технических вузов.
Для студентов заочно-вечернего факультета учебным планом по кур су «Химия» предусмотрено чтение установочных обзорных лекций, вы полнение лабораторных работ, консультации преподавателя, одна кон трольная работа и сдача экзамена или зачета.
Методические рекомендации студентам при освоении курса химии
Основные виды учебных занятий студентов заочно-вечернего факуль тета - аудиторные занятия с преподавателем и самостоятельная работа над учебным материалом с книгами.
В курсе химии учебный процесс слагается из следующих элементов: посещение лекций, проработка лекционного материала, учебников, учеб ных пособий; выполнение лабораторного практикума; индивидуальные консультации и собеседования, самостоятельная работа, сдача экзамена (или зачета) по всему курсу.
Эти формы являются способами осуществления взаимодействия сту дентов и преподавателей, в рамках которых реализуется содержание дис циплины и методы обучения.
Лекции.В конспект лекций целесообразно вносить лишь основной материал: определения, объяснения терминов, иллюстрации, методики решения задач, текст важнейших положений и т. п.
Конспект нужно вести аккуратно, четко, записи выполнять разборчи вым почерком. Выделение заголовков и подзаголовков, подчеркивание важнейших мест и использование цветных карандашей и стержней ручек, фломастеров значительно улучшает конспект. Следует выделять опреде ления, термины, количественные величины, которые необходимо запом-
5
нить. Это можно делать применением различного цвета стержней ручек, изменением размера шрифта, подчеркиванием вертикальными и горизон тальными линиями, изменением размещения текста на листе, вынесением ряда сведений на боковое поле листа.
Тщательно оформленный конспект способствует более эффективной работе зрительной памяти.
Помните: собственный конспект лекций по объему составляет примерно десятую часть от объема учебника! А это очень важно при подготовке и к экзамену, и в текущей самостоятельной работе при подготовке к лабораторным работам.
Работа с учебным материалом, книгой, пособием. Изучать курс химии нужно по темам в той последовательности, в которой читаются лекции. При первом чтении старайтесь уловить суть, не задерживайтесь на математических выкладках, составлении уравнений реакций. Поста райтесь получить общее представление об излагаемых вопросах, отмечая трудные и непонятные места.
При повторном чтении усвойте все теоретические положения, мате матические выводы, а также принципы составления уравнений. Работать надо обязательно с карандашом (ручкой) и рабочей тетрадью, в которую заносите формулировки законов, понятий, незнакомые слова, термины, формулы и уравнения реакций, выводы и т. д. Изучение курса должно со провождаться обязательно выполнением упражнений, задач.
Лабораторные работы.
Выполнение графика лабораторных работ обязательно!
График лабораторных работ для каждой специальности и группы вы вешен на кафедральном стенде. Главными руководящими литературными источниками при выполнении лабораторных работ должны быть методи ческие указания, учебники, справочная литература. Наряду с этим, кафед рой издан комплекс методических пособий и указаний с образцами реше ния многих типовых задач, что обеспечивает студентам возможность са мостоятельной работы. При выполнении и оформлении лабораторной ра боты обратите внимание на этапы экспериментальной работы, порядок ее выполнения, порядок расчета, единицы измерения. При выполнении лабо-
раторной работы необходимо соблюдать требования техники безопасно сти.
По окончании лабораторной работы студент представляет преподава телю отчет по проделанной работе. Образец отчета представлен также на кафедральном стенде и включает в себя: название работы, цель работы, теоретическую справку, экспериментальную часть, расчетную часть и вы воды.
Самостоятельная работа студента - важнейшая составная часть учебного процесса по дисциплине, главный метод глубокого и всесторон него изучения и усвоения учебного материала. Она способствует форми рованию высокой культуры умственного труда, необходимых умений и навыков и является, в конечном счете, определяющим фактором в дости жении высоких результатов обучения.
Самостоятельный труд развивает у студента познавательные интере сы, творческие способности, организованность, дисциплинированность, активность, трудолюбие, инициативу, упорство в достижении поставлен ной цели; вырабатывает умение работать с литературой, анализировать учебный материал; учит самостоятельному мышлению. Самостоятельная работа служит главным средством превращения полученных знаний в убеждения, умения и навыки.
Основными видами обязательной самостоятельной работы студентов по химии являются:
-углубление теоретических знаний по дисциплине путем изучения реко мендуемой учебной и методической литературы;
-отработка конспекта лекций по рекомендуемой литературе;
-выполнение, доработка и оформление отчетов по лабораторным рабо там;
-выполнение контрольной работы;
-посещение индивидуальных и групповых консультаций, собеседований;
-повторение учебного материала в целях подготовки экзамену.
Посещение индивидуальных и групповых консультаций, собеседо ваний - одна из форм самостоятельной работы студентов. Консультации и собеседования проводятся по специальному расписанию в течение семе-
6 |
7 |
стра, а также перед экзаменом. Расписание консультаций вывешивается на специальном стенде кафедры.
Контрольная работа - основная форма контроля за самостоятельной работой студента. Приступать к выполнению индивидуальных заданий необходимо только после изучения теоретического материала, усвоения определенной части курса, тщательного разбора решений типовых задач, приведенных в данном пособии. Если тот или иной раздел не усвоен, не следует переходить к изучению следующих материалов, которые, как пра вило, базируются на предыдущих. При этом необходимо использовать ин дивидуальные консультации преподавателя. Расписание консультаций в течение семестра вывешено на Доске объявлений кафедры «Химия».
При оформлении контрольной работы необходимо строго придержи ваться следующих требований.
1. Работа оформляется в тетради, на титульном листе которой приво дятся сведения по образцу:
Контрольная работа по курсу "Химия"
студента группы(указать группу), специальность(указать специальность) Фамилия, имя, отчество Шифр(указать номер шифра) Вариант(указать номер варианта)
2.Номером шифра является номер зачетной книжки студента.
3.Каждый студент выполняет вариант контрольного задания из на стоящего пособия. Номер варианта контрольной работы определяется по следними двумя цифрами шифра студента (последними двумя цифрами в номере зачетной книжки). В таблице 1 приведены номера задач данного сборника согласно варианту.
4.Работа выполняется чернилами, четко, без недопустимых сокраще ний, на страницах оставляются поля для замечаний рецензента.
5.Задачи решают последовательно, в том порядке, в котором они да ны в задании. В тетради записывают номер задания, затем условие задачи (без сокращений), ответ (если дан). После чего приводят решение задачи.
8
6.Решения задач и ответы на вопросы должны быть полными и ис черпывающими. При решении задач следует приводить весь ход решения
иматематические преобразования, в конце дается ответ.
7.В конце выполненной работы приводится список использованной литературы.
8.Работа должна быть датирована, подписана студентом и отправлена
вуниверситет для рецензирования.
9.Рецензия на контрольную работу выдается в деканате заочновечернего факультета, после этого работа попадает на рецензирование преподавателям кафедры «Химия».
10.Рецензируя работу студента, преподаватель указывает на допу щенные ошибки.
11.После получения работы от рецензента студент обязан выполнить его указания, при этом работа над ошибками должна быть в конце тетра ди, а не в рецензируемом тексте.
12.Если работа не зачтена, она выполняется повторно с соответствии
сзамечаниями рецензента и высылается на повторную рецензию вместе с незачтенной работой.
Экзамен (или зачет). К сдаче экзамена (или зачета) допускаются студенты, которые выполнили лабораторный практикум и получили по ложительные рецензии на контрольную работу. Экзаменатору студент предъявляет зачетную книжку, направление на экзамен. Экзамен прово дится в дни и часы в помещениях университета, указанных в расписании.
9
1.ОСНОВНЫЕ ПОНЯТИЯ
ИСТЕХИОМЕТРИЧЕСКИЕ ЗАКОНЫ ХИМИИ
Представление о том, что вещество состоит из отдельных частиц, - атомная гипотеза - возникло еще в Древней Греции. Но научнообоснованное атомно-молекулярное учение развилось в XIX веке.
Атом - это мельчайшая частица химического элемента, сохраняющая
его свойства. Каждый отдельный вид атомов называется |
химическим эле- |
||
ментом.Из атомов образуются молекулы. Вещества, которые состоят из |
|||
атомов одного элемента, называются |
простыми. Вещества, которые со |
||
стоят из атомов разных элементрв, называются |
сложными. |
|
|
Относительная атомная масса элемента (А r) - величина, равная от
ношению массы атома элемента к 1/12 (одной двенадцатой) массы атома изотопа углерода-12 ( 12С).
Относительная молекулярная масса вещества (М r) - величина, рав ная отношению массы молекулы вещества к 1/12 массы атома изотопа уг лерода-12.
Моль - количество вещества, содержащее столько молекул, ато мов, ионов, электронов или других структурных единиц, сколько их со держится в 0,012 кг изотопа углерода-12.
Число структурных единиц (N), содержащихся в 1 моле вещества - N A (число Авогадро), определено с большой точностью. В практических
расчетах его принимают равным 6,02*10 23 частиц. Постоянная Авогадро равна:
Масса 6,02*10 23 молекул, атомов или других частиц вещества равна его молярной массе. Молярная масса М(Х) - это величина, равная отно шению массы вещества (т) к количеству вещества (v):
Молярная масса вещества М(X), выраженная в г/моль, численно равна
относительной молекулярной массе этого вещества |
М r(Х), выражаемой в |
10 |
|
атомных единицах массы (а.е.м.). Например, относительная молекулярная масса кислорода равна 32 атомным единицам массы:
а молярная масса кислорода равна 32 г/моль:
Пример 1. Рассчитайте относительную молекулярную массу хлорной кислоты
Используя периодическую систему Д. И. Менделеева, найдем значения А r элементов, входящих в состав хлор ной кислоты:
Рассчитаем относительную молекулярную массу хлорной кислоты:
Ответ: 100,5.
Пример 2. Определите среднюю массу атома фтора (в кг), если из
вестно, что масса атома углерода-12 равна 1,993*10 |
-26 кг. |
Рассчитаем массу (в кг) атомной единицы массы: |
|
Зная, что Ar(F) = 19, вычислим массу атома фтора: |
|
m(F) = 1,67-10 -27 • 19 = 3.15*10 |
-26 кг. |
Ответ: 3,15*10-26 кг. |
|
Пример 3. Вычислите количество вещества цинка в образце массой 2,6 г. Из скольки атомов состоит этот образец цинка?
Относительная атомная масса цинка равна 65,4, следова тельно, молярная масса цинка равна 65,4 г/моль, т. е. M(Zn) = 65 г/моль.
Вычислим количество вещества цинка в образце по формуле:
11
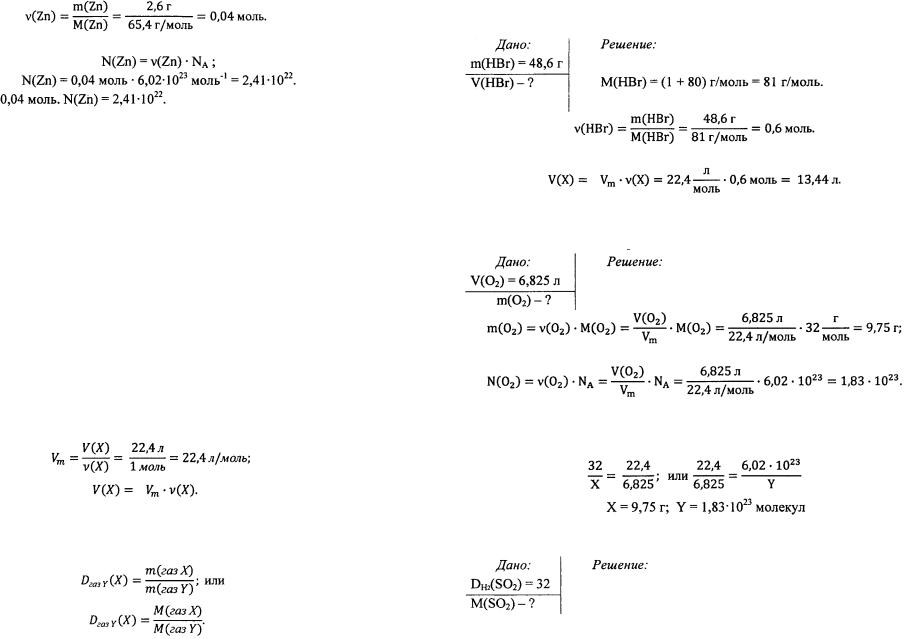
Определим число атомов цинка в этом образце:
Ответ:
Применение основных газовых законов для расчета
характеристик веществ. Законы идеального газа |
|
|
Для характеристики состояния газа вводят специальные физические |
|
|
величины, называемые |
параметрами состояния системы. В качестве |
|
параметров состояния системы выбирают три величины: объем газа |
V, его |
|
температуру Т и давление |
Р. |
|
Температура 0°С и давление 101325 Па (1 атм или 760 мм рт. ст.) |
|
|
характеризуют нормальные условия для газа. При решении задач этого |
|
|
раздела используют ряд законов, которым подчиняются газы. |
|
|
Закон Авогадро:в равных объемах различных газов при одинаковых |
||
условиях (при одной и той же температуре и одинаковом давлении) со |
|
|
держится одинаковое число молекул. |
|
|
Первое следствие из закона Авогадро: один моль любого газа при одинаковых условиях занимает один и тот же объем. Объем, который за нимают 6,02*10 23 молекул любого газа при нормальных условиях
(t = 0°С и Р = 101 325 Па), приблизительно равен 22,4 л. Этот объем назы вается молярным объемом газа V m:
отношение масс, равных объ емов газов, измеренных при одинаковых условиях, называется относительной плотностью одного газа по другому (D):
Пример 4. Вычислите объем, который займет при нормальных усло виях бромоводород массой 48,6 г.
Вычислим молярную массу бромоводорода:
Количество вещества бромоводорода равно:
Следовательно, объем бромоводорода будет равен:
Ответ: 13,44 л.
Пример 5. Какова масса 6,825 л кислорода при нормальных условиях? Какое число молекул содержится в этой порции газа?
А) Молярная масса кислорода равна 32 г/моль. Масса данной порции кислорода будет равна:
Б) 1 моль кислорода имеет массу 32 г и занимает объем 22,4 л (при н. у.) и содержит 6,02*10 23 молекул кислорода. Следовательно, можно составить пропорцию:
Пример 8. Вычислить молярную массу сернистого газа, плотность которого по водороду равна 32.
Относительная плотность сернистого газа по водороду равна:
12 |
13 |
|
Ответ: 64 г/моль. |
|
|
Зависимость между объемом газа, давлением и температурой можно |
|
выразить общим уравнением, объединяющим |
законы Бойля-Мариотта и |
|
Гей-Люссака (объединенный газовый закон): |
||
где |
- давление и объем газа при данной температуре |
|
давление и объем газа при нормальных условиях (н. у.).
Формулировка этого закона: для данной массы газа произведение дав ления на объем, деленное на абсолютную температуру, постоянно при всех изменениях, происходящих с газом.
Приведенное уравнение позволяет находить любую из указанных ве личин, если известны остальные.
Одним из важнейших применений объединенного газового закона является приведение объема газа к нормальным условиям.
Пример 9. Газ при 15°С и давлении 760 мм рт. ст. занимает объем 2 л. Привести объем газа к нормальным условиям.
На основании объединенного законаопределим объем V 2:
Поскольку в объединенном газовом законе нет газовой постоянной (R), то давление и объем газа можно подставить в тех единицах, которые указаны в условии задачи.
Ответ: 1,9 л.
14
Уравнение МенделееваКлапейрона
Оно выведено на основе объединенного закона Бойля-Мариотта и Гей-Люссака с применением закона Авогадро:
где R - универсальная газовая постоянная, не зависящая от природы газа. Так как 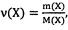 го вышеприведенное уравнение принимает вид
го вышеприведенное уравнение принимает вид
Числовое значение R зависит от единицы измерения давления и объема. Поэтому универсальная газовая постоянная имеет значения:
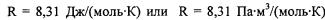 (международная система единиц СИ)
(международная система единиц СИ)
Пример 10. В колбе вместимостью 500 мл при 25°С находится 0,615 г оксида азота(И). Каково давление газа в колбе?
Из уравнения МенделееваКлапейрона находим:
Ответ: 101 592,6 Па. |
|
|
Закон Дальтона |
|
|
Сформулирован этот закон так: |
общее давление смесей газов, не |
|
реагирующих друг с другом, равно сумме парциальных давлении |
||
составных частей (компонентов). |
|
|
где Р - общее давление смеси газов, занимающей при температуре Т |
||
объем V; |
- парциальные давления компонентов смеси; |
|
|
|
15 |
n - сумма числа молей всех компонентов, образующих данную смесь. Парциальным давлением называется давление, оказываемое каждым
компонентом газовой смеси, если представить этот компонент занимающим объем, равный объему смеси при той же температуре. Иными словами, парциальным давлением называется та часть общего давления газовой смеси, которая обусловлена данным газом.
Зависимость между парциальными давлениями и общим выражается уравнениями:
где |
- число молей компонента 1, 2, 3, соответственно, |
|
в смеси газов. |
|
|
Отношение |
называется мольной долей компонента. |
|
Если мольную долю обозначить через |
(читается «хи»), то |
|
парциальное давление любого i-го компонента смеси (где i = 1, 2, 3,...) будет равно:
Таким образом, парциальное давление каждого компонента смеси равно произведению его мольной доли на общее давление газовой смеси.
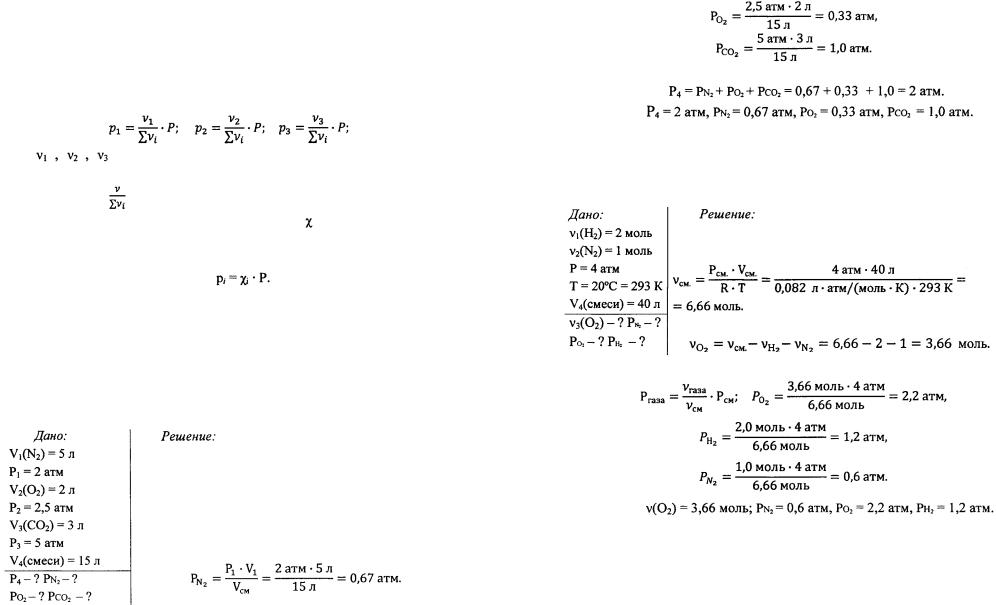
Пример 11. 5 л азота под давлением 2 атм, 2 л кислорода под давлением 2,5 атм и 3 л углекислого газа под давлением 5 атм перемешаны, причем объем предоставленный смеси равен 15 л. Вычислить, под каким давлением находится смесь и парциальные давления каждого газа.
Азот, занимавший объем 5 л при давлении P1 = 2 атм, после смешения с другими газами
распространился в объеме V 2 = 15 л. Парциальное давление азота 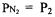 находим из закона БойляМариотта
находим из закона БойляМариотта 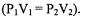
Откуда:
Парциальное давления кислорода и углекислого газа находим аналогичным способом:
Общее давление смеси равно:
Ответ:
Пример 12. Смесь, состоящая из 2 молей водорода, некоторого количества молей кислорода и 1 моля азота при 20°С и давлении 4 атм, занимает объем 40 литров. Вычислить число молей кислорода в смеси и парциальные давления каждого из газов.
Из уравнения Менделеева-Клапейрона находим oбщее число молей всех газов, составляющих смесь
Число молей кислорода в смеси равно:
Парциальные давления каждого из газов вычисляем по уравнению:
Ответ:
Задания для самостоятельной работы
1. При давлении 105,4 кПа и температуре 25 °С оксид серы(IV) зани мает сосуд вместимостью 5,5 л. Вычислите количество вещества оксида
16 |
17 |
cepы(IV), находящегося в данном сосуде. Какова масса одной молекулы данного газа? Ответ: 0,234 моль; 1,063*10 -22 г.
2. Газовая смесь состоит из кислорода (2,24 л) и азота (3,36 л). Объе мы газов приведены к н. у. Рассчитайте массу смеси газов. В каком газе содержится больше молекул и во сколько раз? Ответ: 7,4 г; N2 больше в
1,5 раза.
3. Вычислите массу 100 дм 3 азота при 10 °С и давлении 100 кПа. Какое число молекул газа находится в этом сосуде? Ответ: 119 г; 4,25 моль.
4. Относительная плотность газа по воздуху равна 1,517. Рассчитайте количество вещества этого газа, которое заключается в его образце массой 11 г. Сколько молекул содержит этот образец? Ответ: 0,25 моль; 1,5
5.Плотность галогеноводорода по воздуху равна 4,41. Определите плотность этого газа по водороду и назовите его. Какой объем будут за нимать 8 г этого газа при температуре 300 °С давлении 3 атмосферы?
Ответ: HI; 64; 0,98 л.
6.Газ массой 30,3 г заполнил сосуд вместимостью 15 л при темпера туре 18 °С. Давление газа внутри сосуда составляет 122 кПа. Рассчитайте
молярную массу газа. Какое число молекул содержится в данном объеме газа? Ответ: 40 г/моль; 4,56*10 23.
7.Что такое относительная плотность одного газа по второму? Из скольких атомов состоит молекула серы в парах, если плотность пара се ры по воздуху равна 8,83? Ответ: 8.
8.Некоторый газ объемом 2,8 л (н. у.) поместили в сосуд, который в отсутствие газов имел массу 110,3 г. Масса сосуда с газом равна 115,8 г.
Вычислите относительную плотность газа по воздуху. |
Ответ: 1,517. |
9. Газовая смесь приготовлена из 2 л водорода Н |
2 (Р = 93,3 кПа) и |
5 л метана CH4 (Р = 112 кПа). Объем смеси равен 7 л. Найти парци |
|
альные давления газов и общее давление смеси. |
Ответ: 26,65 кПа; |
80кПа; 106,65 кПа.
10.250 мл водорода собраны над водой при 26 °С и давлении 98,7 кПа. Давление насыщенного пара воды при 26 °С составляет 3,4 кПа. Вычислите объем водорода при нормальных условиях и его массу. Ответ: 214,69 мл; 19 мг.
18
11. Газометр вместимостью 20 дм |
3 наполнен газом под давлением |
||
103,3 кПа при 17 |
°С. Плотность этого газа по воздуху равна 0,4. Вычисли |
||
те массу газа, находящегося в газометре. Какое число молекул газа будет |
|||
содержаться в данном объеме при н. у.? |
Ответ: 9,75 г; 5,06*10 |
23. |
|
12. В газометре над водой находится 0 2 объемом 7,4 дм |
3 при 296 К и |
||
давлении 104,1 кПа. Давление насыщенного водяного пара при этой тем |
|||
пературе равно 21 мм рт. ст. Какой объем (н. у.) займет находящий в газо |
|||
метре кислород? |
Ответ:6,8л. |
|
|
13.Сколько молей кислорода и азота содержится в аудитории разме ром 6x8x5 м при 22 °С и 100 кПа? В воздухе содержится примерно 21 % кислорода и 79 % азота. Ответ: 2055 и 7634 моль.
14.Имеется 1 л кислорода при 0 °С и давлении 760 мм рт.ст. и 1 л уг лекислого газа при 27 °С и давлении 1,18 атм. В каком газе содержится
больше молекул? Во сколько раз? |
Ответ: СО2 больше в 1,1 раза. |
||
15. Неизвестное вещество массой 0,582 г находится в парообразном |
|||
состоянии при температуре 35 °С и давлении 0,99*10 |
5 Па и занимает объем |
||
205 мл. Определите его молярную массу. |
Ответ: 73,4 г/моль. |
||
16. В закрытом баллоне находится 160 г кислорода под давлением |
|||
121,6 кПа при 12 °С. Вычислите массу С0 |
2 в объеме этого баллона, если |
||
газ находится под давлением 202,6 кПа и при 37 °С. |
Ответ: 336,98 г. |
||
17. Определите молярную массу вещества в газообразном состоянии, |
|||
если известно, что масса вещества объемом 400 см |
3 при 360 К и давлении |
||
93,2 кПа равна 0,35 г. Какова плотность этогo газа по воздуху? Ответ: 28 г/моль
18.Какую массу имеет 1 л хлора при нормальных условиях, какова его плотность по воздуху? Какой объем занимают 142 г хлора при нор мальных условиях? Ответ: 3,16 г; 2,44; 44,8 л.
19.Аммиак при давлении 454,2 мм рт. ст. и температуре 18 °С зани мает объем 832 мл. Определить число молей, молекул и массу аммиака.
Ответ: 0,02моль; 1,2*10 22; 0,35 г.
20. |
Вычислите массу 450 мл диоксида серы при 80 °С и 98 642 Па. |
|
Сколько молекул газа содержится в этом объеме? |
Ответ: 0,968 г; 9,1 -10 21. |
|
21. |
Из скольких атомов состоит молекула ртути в парах, если плот |
|
ность пара ртути по воздуху равна 6,92? Ответ: 1. |
|
|
|
19 |
|
