
3. . . .
.pdf
реакции от концентраций (парциальных давлений) определяется законом действующих масс: скорость гомогенной реакции при постоянной температуре прямо пропорциональна произведению концентраций (давлений) реагирующих веществ, возведенных в степень, с показателями, равными стехиометрическим коэффициентам, стоящим в уравнении реакции, если реакция является простой.
Для реакции
где к - константа скорости, показывающая, с какой скоростью протекает реакция при концентрациях веществ, равных 1 моль/л;
[NO], [0 2] - концентрация N0 и 0 2 моль/л; Р - давление газа.
Численное значение к зависит от природы реагирующих веществ, температуры и от присутствия катализатора.
Сумму показателей степени при концентрациях реагирующих ве ществ называют порядком реакции. Вышеприведенная реакция - это реак ция третьего порядка. Но реакций выше третьего порядка не известно. Это обстоятельство существенно ограничивает область применения закона действующих масс. Сущность ограничения заключается в том, что зави симость скорости реакции от концентраций определяется эксперимен тально и редко совпадает со стехиометрическим уравнением реакции.
Для гетерогенной системы,в которой реагирующие компоненты раз делены поверхностями, реакция может протекать только на поверхности. Скорость реакции зависит от площади поверхности. В частности, измель чение приводит к существенному увеличению скорости реакции. Но в общем случае наблюдать за изменением поверхности в процессе реакции трудно, поэтому часто изучение реакции проводят в условиях, когда по верхность не меняется. Тогда площадь поверхности в выражение скорости реакции не входит, то есть для гетерогенных реакций концентрации твер дых веществ в закон действующих масс не входят, так как они постоянны.
Например, для реакции
выражение закона действующих масс имеет вид:
Зависимость скорости химической реакции от температуры выража ется эмпирическим правилом Вант-Гоффа: при увеличении температуры на каждые 10° скорость большинства химических реакций возрастает примерно в 2-4 раза, или
где |
- скорости реакции при температурах t1 и t2 сответственно; |
|
||
- температурный коэффициент скорости реакции, показывающий, во |
0 . |
|||
сколько раз возрастает ее скорость при повышении температуры на 10 |
||||
|
Численное значение |
зависит от природы реагирующих веществ и |
|
|
для данной реакции есть величина постоянная. |
|
|
||
|
Более точная зависимость скорости реакции от температуры выража |
|
||
ется уравнением Аррениуса: |
|
|
|
|
где к - константа скорости реакции; |
|
|
||
R - универсальная газовая постоянная, Дж/(моль*К); |
|
|||
Т2 и T1 температура, К; |
|
|
|
|
Еа - энергия активации реакции, кДж/моль. |
|
|
||
|
Энергия активации — |
та минимальная энергия, которой должны |
|
|
обладать частицы (соударяющиеся молекулы), чтобы их взаимодей |
|
|||
ствие было эффективным (реакция произошла). |
|
|
||
|
Численное значение Е |
а зависит от природы реагирующих ве |
|
|
ществ и присутствия катализатора. Если Т |
2 - T1 = 10, то выражение |
|
||
примет вид: |
|
|
|
|
Скорость гетерогенных реакции зависит также от величины по верхности взаимодействия, с увеличением которой скорость растет.
80 |
81 |

Введение катализатора в систему изменяет путь прохождения ре акции и численное значение Е а: активаторы уменьшают значение Е а, ингибиторы (замедлители) - увеличивают.
Пример 1. Напишите выражение зависимости скорости прямой и обратной реакции от концентрации реагирующих веществ для следую щих процессов:
Как изменится скорость прямой и обратной реакций, если увели чить давление в системе в 3 раза?
Решение.
а) Система гомогенная, тогда скорость прямой и обратной реакций выражается соответственно:
При увеличении давления в 3 раза концентрации веществ также уве личиваются в 3 раза.
Скорость прямой реакции после увеличения давления выражается:
Тогда
скорость прямой реакции возрастет в 9 раз.
Для обратной реакции после увеличения давления в 3 раза выражение закона действия масс примет вид:
Тогда
скорость обратной реакции возрастет в 27 раз. б) Система гетерогенная, тогда:
 (прямая реакция),
(прямая реакция),
82
Следовательно,
скорость прямой реакции увеличится в 3 раза. Для обратной реакции:
скорость также увеличится в 3 раза.
Пример 2. При 60°С некоторая реакция заканчивается за 16 мин. Сколько потребуется времени для проведения той же реакции: а) при 100°С, б) при 40°С? Температурный коэффициент реакции 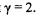
Решение.
Согласно уравнению Вант-Гоффа:
Следовательно,
Таким образом, скорость реакции при повышении температуры от 60° до 100°С возрастает в 16 раз, а следовательно, для проведения реакции потребуется в 16 раз меньше времени, то есть 1 мин.
Можно рассуждать иначе. 2-й способ решения: Скорость реакции выражается:
Учитывая, что реакции одна и та же, то за единицу времени |
изме |
|
нение концентрации будет одинаковым: |
Следовательно, отно |
|
шение скоростей реакций будет обратно пропорцинально времени: |
|
|
83

Согласно правилу Вант-Гоффа:
Поскольку левые части двух предыдущих выражений равны, то и правые части можно приравнять:
Откуда
Определим время протекания реакции при 40 °С (случай б).
Пример 3. В замкнутом сосуде вместимостью 2 л протекает реакция:
Через 2,5 с после смешивания 4,5 моль азота и 3 моль кислорода в ре акционной системе образовался оксид азота(П) количеством вещества
1 моль. Определите среднюю скорость реакции по NO. Рассчитайте коли чества веществ N 2 и 0 2, которые не прореагировали.
Согласно стехиометрическим коэффициен там в уравнении реакции вещества реагируют и образуются в результате реакции как
Из уравнения реакции следует, что
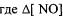 - изменение количества вещества в хо де реакции, знак «-»означает, что вещество расхо дуется в ходе реакции.
- изменение количества вещества в хо де реакции, знак «-»означает, что вещество расхо дуется в ходе реакции.
84
Вычислим количество вещества N2, которое не вступило в реакцию:
Количество вещества O2, которое осталось в реакционной смеси, равно:
Для наглядности решения иногда по ходу рассуждения при решении задачи заполняют таблицу.
Для данной задачи таблица может выглядеть следующим образом:
* так как в условии задачи ничего не сказано об исходной концентрации продукта ре акции, то принимают, что его количество к моменту начала реакции составляет О моль.
Согласно уравнению реакции вещества реагируют и образуются в результате реакции как 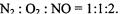
Тогда 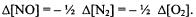 Откуда
Откуда 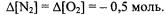 Запишем в таблицу полученные данные:
Запишем в таблицу полученные данные:
85

Легко подсчитать концентрации [Х] |
2 и заполнить оставшиеся графы: |
Среднюю скорость реакции по веществу NO за данный промежуток времени вычисляем по формуле:
Ответ:4 моль; 2,5 моль; 0,1 моль*л -1 *с-1 .
Химическое равновесие -состояние обратимого процесса, при кото
ром скорость прямой реакции |
равна скорости обратной реакции |
т. е. кинетическим условием наступления равновесия является |
|
равенство скоростей |
Численно химическое равновесие выражает |
ся константами равновесия К |
с или К р, которые выводятся из закона дейст |
вующих масс. Например, для обратимой реакции
при равновесии
или
к1 и к2 - константа скорости прямой и обратной реакций соответственно. Заменив отношения k1/k2 через новую постоянную Кс и Кр соответст
венно, получим выражения:
86
где [X] и Р х - равновесные концентрации и равновесные парциальные давления газообразных веществ.
Концентрации, входящие в выражение константы равновесия, назы ваются равновесными концентрациями. Константа равновесия - постоян ная при данной температуре величина, выражающая соотношение между равновесными концентрациями продуктов реакции (числитель) и исход ных веществ (знаменатель).
Для общего случая химической реакции
выражение для константы равновесия реакции имеет вид:
В выражение константы равновесия гетерогенной реакции, как и в выражение закона действия масс, входят только концентрации веществ, находящихся в жидкой или газообразной фазе, так как концентрации твердых веществ остаются, как правило, постоянными.
Численное значение константы равновесия К с и К р показывает, какие вещества (исходные или конечные) преобладают в равновесной системе, т. е. определяет предел, или глубину, протекания процесса в выбранном направлении.Чем больше константа равновесия, тем «глубже» протекает
реакция, т. е . тем больше выход ее продуктов. Если К с (К р) < 1, преобла дают исходные вещества, если К с (К р) > 1 - конечные продукты. Ее значе ние зависит от природы веществ и температуры, но не зависит от концен траций или парциальных давлений.
Исходя из уравнения Менделеева - Клапейрона
можно вывести соотношение между К |
с и К |
р, которое выразится |
уравнением: |
|
|
|
87 |
|
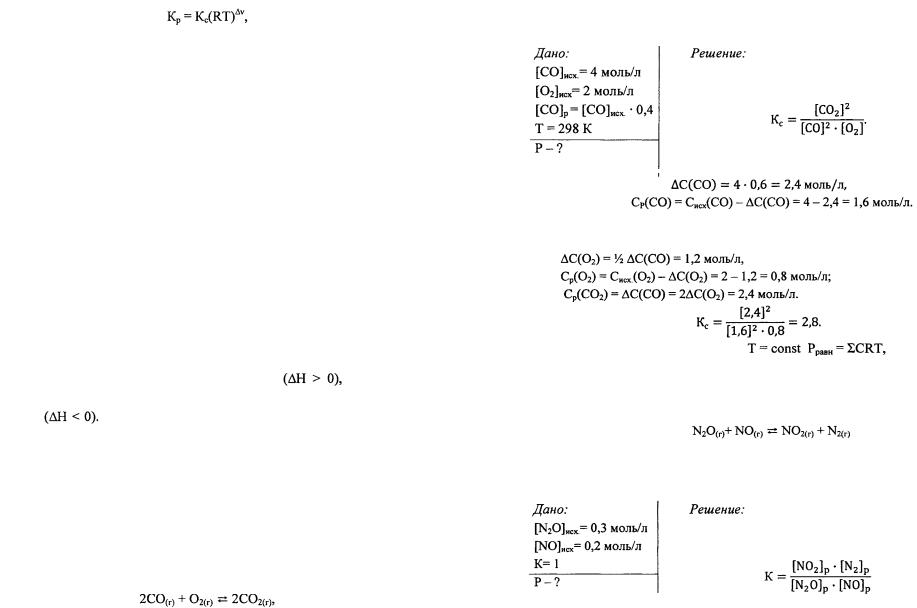
где 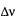 - разность между суммой числа молей газообразных продуктов ре акции и суммой числа молей газообразных исходных веществ. Если
- разность между суммой числа молей газообразных продуктов ре акции и суммой числа молей газообразных исходных веществ. Если
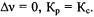 В конденсированных системах (отсутствует газообразная фаза) Kp = К с.
В конденсированных системах (отсутствует газообразная фаза) Kp = К с.
Химическое равновесие устойчиво при заданных условиях: равновес ных концентрациях, температуре и давлении. При изменении условий равновесие нарушается. Направление смещения равновесия определяется принципом Ле Шателье: если на систему, находящуюся в равновесии, оказывается внешнее воздействие, то равновесие системы смещается в сторону противоположную оказанному воздействию.
При уменьшении равновесной концентрации исходных веществ рав новесие смещается в сторону обратной реакции, приводящей к увеличе нию концентрации исходных веществ, и наоборот. Увеличение концен трации исходных веществсмещает равновесие в сторону прямой реакции.
Увеличение давленияв равновесной системе смещает равновесие в сторону образования меньшего числа молей газообразных веществ, т. е. в сторону реакции, уменьшающей давление.
Повышение температурысмещает равновесие в сторону эндотерми-
ческой реакции, идущей с поглощением энергии |
понижение |
|
температуры - в сторону экзотермической реакции, идущей с выделени- |
||
ем энергии |
Численное значение константы равновесия при по- |
|
вышении температуры увеличивается в эндотермических процессах и уменьшается в экзотермических процессах.
Катализатор не влияет на значение константы равновесия, поскольку он одинаково снижает энергию активации прямой и обратной реакций и поэтому одинаково изменяет скорости прямой и обратной реакций. Ката лизатор лишь ускоряет достижение равновесия, но не влияет на количест венный выход продуктов реакции.
Пример 4. Вычислите константу равновесия 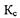 обратимой реакции
обратимой реакции
если начальные концентрации реагентов были: 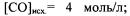
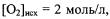 а к моменту равновесия израсходовано 60% оксида уг-
а к моменту равновесия израсходовано 60% оксида уг-
88
лерода(П). Определите равновесное давление газовой смеси при стандарт ной температуре (Т = 298 К).
Запишем выражение для константы равнове сия данной реакции:
Исходя из условия к моменту равновесия израсхо довалось 60% начальной концентрации СО, т. е.
По уравнению реакции на каждые 2 моль СО расходуется 1 моль 0 |
2 и |
образуется 2 моль С0 2, следовательно,
Так как в закрытом сосуде при |
тогда |
Ответ. 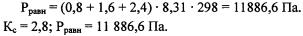
Пример 5. Константа равновесия гомогенной системы
при некоторой температуре равна 1. Вычислите равновесные концентра
ции веществ, если исходные концентрации: [N 20] = 0,3 моль/л, [0 2] = 0,2 моль/л.
Запишем выражение для константы равнове сия данной реакции:
Пусть к моменту равновесия концентрация 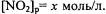 но уравнению реакции число молей образовавшегося водорода при этом
но уравнению реакции число молей образовавшегося водорода при этом
будет также х моль/л. Столько же молей (х) N 20 и NO расходуется для об89

разования х молей N0 2 и N 2. Следовательно, равновесные концентрации всех веществ:
Тогда
Искомые равновесные концентрации будут равны:
Ответ:
Задания для самостоятельной работы
151. При повышении температуры от 298 до 308 К скорость некото рой реакции увеличилась в 3 раза. Определите численные значения вели чин температурного коэффициента и энергии активации. От каких факто ров они зависят и каков их физический смысл? Ответ: 3; 83,7 кДж.
152. Какие реакции называются гомогенными и гетерогенными? За пишите выражение закона действующих масс для реакций:
Как надо изменить давление в системах, чтобы скорость первой реак ции увеличилась в 36 раз, а скорость второй - в 27 раз? Ответ подтвердите расчетами. Ответ: 6; 3.
153.Вычислите температурный коэффициент реакции, если при 285 К она протекает за 60 с, а при 298 К за 30 с. Каков физический смысл темпе ратурного коэффициента реакции? Ответ: 1, 7.
154.Напишите выражение константы химического равновесия для
реакций:
90
Действием каких факторов можно сместить равновесие систем в сто рону прямой реакции? В чем заключается принцип Ле-Шателье?
155. При некоторой температуре константа равновесия реакции
равна 1. Определите состав равновесной смеси, если для реакции были взяты 1 моль водорода и 2 моль брома. Ответ: [H2] = 0,55 моль; [Br2] = 1,55 моль; [НВr] = 0,90 моль.
156. Реакция идет по уравнению
Исходные концентрации веществ [NO] = 0,4 моль/л, [С1 |
2] = 0,3 моль/л. |
||||
Как изменится скорость реакции, когда прореагирует 50% NO? От каких |
|
||||
факторов зависит численное значение константы скорости реакции? |
От |
||||
вет: уменьшится в 6 раз. |
|
|
|
|
|
157. Определите скорость реакции |
|
|
|
||
при исходной концентрации S0 |
|
3, равной 2,8 моль/л, и в момент времени, |
|||
когда получится 1 моль/л 0 |
2. При данных условиях константа скорости |
|
|||
реакции 0,22 л/(моль*с). Какова концентрация получившегося S0 |
|
2? |
|||
Сформулируйте закон действующих масс |
Ответ: 1,72 моль/л*с; |
|
|||
0,14 моль/л*с; 2 моль/л. |
|
|
|
|
|
158. Реакция протекает по уравнению |
|
|
|
||
Исходные концентрации веществ [А]=4,2 моль/л; [В]=2,0 моль/л. |
|
||||
Константа скорости реакции при данной температуре 0,25 л/(моль*c). |
|
||||
Определите скорость химической реакции в начальный момент и по |
|
||||
истечении времени, когда концентрация вещества А стала равной |
|
||||
1,2 моль/л. Ответ: 37,05; 0,43. |
|
|
|
|
|
159. Определите скорость химической реакции |
|
|
|||
при исходных концентрациях [N |
2] = 2 моль/л и [Н 2] = 8 моль/л и в момент |
||||
времени, когда концентрация азота уменьшилась на 10%. При данных ус91

ловиях константа скорости реакции 0,16 л/(моль*с). |
Ответ: 163,84; |
116,70. |
|
160.Рассчитайте, во сколько раз изменится константа скорости реак ции при увеличении температуры от 500 до 1000 К, если энергия актива
ции процесса равна 95,5 кДж/моль. Каков физический смысл энергии ак тивации? Ответ: 10 5.
161.Напишите выражение константы химического равновесия для
реакций:
Действием каких факторов можно сместить равновесие систем в сто рону прямой реакции? В чем заключается принцип Ле-Шателье?
162. Определите равновесные количества веществ в реакции
если константа равновесия при некоторой температуре равна 1, и для ре акции было взято 1 моль углекислого газа и 3 моль водорода. Ответ: (моль/л) 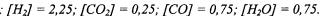
163.При температуре 423 К некоторая реакция заканчивается за 16 мин. Через сколько минут закончится эта реакция при 473 К, если темпе ратурный коэффициент реакции равен 3? Ответ: 3,9 с.
164.Реакция, выраженная уравнением
началась при концентрациях: [А] = 0,03 моль/л, [В] = 0,05 моль/л. Кон станта скорости реакции равна 0,4. Определите начальную скорость реак ции и скорость ее в момент времени, когда [А] уменьшилась на 0,01 моль/л. Каков физический смысл константы скорости и от каких фак торов она зависит? Ответ:3*10-5 ; 7,2*10 -6.
165. При синтезе хлористого сульфурила протекает реакция
Определите исходные концентрации хлора и оксида серы(IV), если равновесные концентрации равны: [С1 2] = 2,5 моль/л; [S0 2] = 1,8 моль/л; [S02C12] = 3,2 моль/л. Чему равна константа равновесия реакции, от каких факторов она зависит? Ответ: [SO2] = 5,0моль/л; [Cl2] = 5,7моль/л; 0,71.
166. Через некоторое время после начала реакции
концентрации веществ составляли: [А] =0,03 моль/л; [В] = 0,01 моль/л; [С] =0,008 моль/л. Каковы исходные концентрации веществ А и В?
Ответ: (моль/л): [А] = 0,042; [В] = 0,014.
167. Средняя скорость протекающей в системе реакции
определена по веществу А и равна 0,02 моль/(л*с). Какова будет концен трация веществ А, В и D через 5 секунд, если исходные концентрации ве ществ [А] = 0,6 моль/л, [В] = 1,2 моль/л. Ответ: (моль/л): [А] = 0,5;
[B]= 1,0;[D] = 0,1.
168.При некоторой температуре равновесие в системе
установилось при следующих концентрациях: [N0 |
2] = 0,006 моль/л; |
|||
[0 2] = 0,01 моль/л, [NO] = 0,024 моль/л. Каковы константа равновесия ре |
||||
акции и исходная концентрация N0 |
2? Ответ: 6,25; 0,03 моль/л. |
|
||
169. Начальная концентрация исходных веществ в системе |
|
|||
была равна 0,3 моль/л СО и 0,2 моль/л С1 |
2. Во сколько раз увеличится |
|||
скорость реакции, если концентрацию СО повысить до 0,9 моль/л, а кон |
||||
центрацию С1 2 до 1,0 моль/л ? Ответ: 15. |
|
|
|
|
170. Для реакции |
|
|
|
|
равновесные концентрации (моль/дм |
3) были: [N |
2] = 0,3; [Н |
2] = 0,9; |
|
[NH 3] = 0,4. Чему равна константа равновесия и исходные концентрации азота и водорода? В каком направлении сместится равновесие если увели чить давление в 5 раз? Ответ:0,73; [N2] = 0,5; [H2] = 1,5.
171. В закрытом сосуде установилось равновесие:
константа равновесия равна единице. Определите: а) сколько процентов С0 2 подвергнется превращению в СО при данной температуре, если сме шать 1 моль С0 2 и 5 молей Н 2? Ответ: 83 %.
92 |
93 |

172. В каком направлении сместятся равновесия систем:
а) при понижении температуры, б) при повышении давления?
173. Определите равновесную концентрацию водорода и в реакции
если исходная концентрация HI составляет 0,55 моль/л, а константа рав новесия равна 0,12. Ответ: 0,11 моль/л.
174.Рассчитайте константу равновесия химической реакции при тем-
пературе 1000 К, если стандартная энергия Гиббса этой реакции равна -191,0 кДж/моль. Ответ: 1010.
175.Константа равновесия реакции
при некоторой температуре равна 0.5 найдите равновесные концентрации СО и С0 2, если начальные концентрации этих веществ составляли:
[СО] = 0,05 моль/л, [С0 |
2] =0,01 моль/л. Ответ: [СО] = 0,04 моль/л, |
[СО2] =0,02 моль/л. |
|
8. ГИДРОЛИЗ СОЛЕЙ
Гидролиз - разложение веществ водой. Гидролизом соли называется обменное взаимодействие ионов соли с молекулами воды, в результате, которого изменяется характер среды (соотношение между ионами водо рода и гидроксила в растворе).
Реакция гидролиза - это реакция обратная реакции нейтрализации.
Гидролиз соли происходит лишь в тех случаях, если ионы соли с ио нами Н + или ОН - молекул воды образуют новые слабые электролиты. Процесс гидролиза - это обратный процесс диссоциации слабого электро-
лита. Возможность и характер протекания реакции гидролиза определяет ся природой кислоты и основания, которые образовали данную соль.
Гидролизу подвергаютсясоли, образованные:
-сильным основанием и слабой кислотой;
-слабым основанием и сильной кислотой;
-слабым основанием и слабой кислотой.
Гидролизу не подвергаютсясоли, образованные сильным основанием и сильной кислотой.
Гидролиз протекает обратимо, ступенчато, продукты гидролиза солей, как правило, определяются первой ступенью.
Рассмотрим возможные случаи гидролиза солей.
1. Гидролиз солей, образованных сильным основанием и слабой кисло той (KCN, NaClO, Na 2C0 3, К 3Р04 и т. д.).
А) гидролиз соли, образованной слабой одноосновной кислотой:
В обеих частях уравнения имеются малодиссоциированные вещества (Н 20, НСlO), но вода является более слабым электролитом, чем хлорнова тистая кислота, поэтому равновесие реакции смещено в сторону обратной реакции. Из уравнения видно, что в результате гидролиза в растворе уве личивается концентрация ионов ОН - , т. е. реакция среды щелочная (рН>7)
Б) Гидролиз соли, образованной слабой многоосновной кислотой:
Гидролиз протекает за счет взаимодействия ионов Р0 4 3- с молекулами Н 20. Запишем сокрашенное ионное уравнение реакции гидролиза, помня, что гидролиз протекает обратимо (при этом равновесие смещено в сторо ну обратной реакции) и ступенчато (к исходному иону присоединяется только один ион водорода):
94 |
95 |

По полученному ионному уравнению дописываем молекулярное уравнение реакции гидролиза.
Таким образом, в результате гидролиза соли, образованной сильным основанием и слабой многоосновной кислотой, образуется кислая соль и
основание.В растворе соли среда - |
щелочная, так в растворе появляется |
избыток ионов ОН - . |
|
2. Гидролиз солей образованных слабыми основаниями и сильными ки слотами(NH 4C1, ZnS0 4, FeCl 3, A12(S04)3 и др.).
Рассмотрим гидролиз сульфата цинка, соли, образованной слабым афотерным основанием и сильной кислотой:
Гидролиз этой соли протекает по катиону, запишем сокращенное ионное уравнение гидролиза, помня, что гидролиз протекает обратимо (равновесие смещено в сторону обратной реакции) и ступенчато (к исход ному иону присоединяется только один гидроксильный ион):
В растворе появляется избыток ионов водорода, следовательно, в рас творе соли среда - кислая (рН< 7).
По полученному ионному уравнению записываем молекулярное уравнение и расставляем коэффициенты:
При гидролизе соли, образованной слабым многокислотным основа нием и сильной кислотой образуется основная соль и кислота.
В холодных и умеренно концентрированных солей гидролиз протека ет по первой ступени. При повышении температуры и разбавлении рас творов гидролиз усиливается, равновесие смещается в сторону прямой ре акции, и тогда могут протекать и вторые ступени гидролиза.
3. Гидролиз солей образованных слабым основанием и слабой кисло
той.
Соли, образованные катионом слабого основания и анионом слабой кислоты, гидролизуются одновременно и по катиону, и по аниону с обра-
96
зованием слабого основания и слабой кислоты. Характер среды в таких растворах будет зависеть от свойств образующихся слабых электролитов, т. е. среда может быть слабокислой, слабощелочной или даже нейтраль ной.
Для того чтобы определить характер среды, необходимо сопоставить константы диссоциации слабой кислоты (К д = 7,9*10 -10) и слабого основа ния (Кд = 1,76* 10 -5). Из сравнения констант диссоциации кислоты и осно вания [Кд(NH40Н) > K д(HCN)] следует, что раствор цианида аммония должен иметь слабощелочную среду.
Особый случай гидролиза солей, образованных слабым многокислот
ным основанием и слабой многоосновной кислотой (A1 2S3, Cr 2S3, Fe2(C0 3)2, А1 2(С03)2 и др.), когда разложение солей под действием воды происходит полностью.
В присутствии воды гидролиз идет и по катиону, и по аниону.
Из образовавшихся ионов Н + и ОН - образуется вода - слабый элек тролит, концентрация ионов уменьшается, и равновесие смещается в сто рону прямой реакции, т. е. гидролиз усиливается, идут вторые ступени гидролиза:
Равновесие полностью смешается в сторону прямой реакции, и гид ролиз идет до конца. В итоге образуется слабое и малорастворимое ос нование, которое выпадает в осадок. Кроме того, образуется второй ела-
97

бый электролит, который является летучей кислотой. Поэтому соли такого типа не могут существовать в присутствии воды. В таблице растворимо сти таких солей стоит прочерк.
Поэтому при сливании растворов сульфата алюминия и сульфида на трия тоже образуется осадок и выделяется газ с неприятным запахом:
А при сливании водных растворов хлорида железа и карбоната натрия реакция гидролиза протекает до конца с образованием коричневого осадка Fe(OH) 3 и выделение газа С0 2:
Эти соли взаимно усиливают гидролиз друг друга. Поскольку гидроксид алюминия амфотерное соединение, то для его получения чаще ис
пользуют раствор соды, а не щелочь. |
|
|
Задания для самостоятельной работы |
|
|
176. Какой процесс называется гидролизом? Определите характер |
|
|
среды в растворах солей (рН < 7, рН > 7 или рН = 7). Составьте молеку |
|
|
лярные и ионно-молекулярные уравнения гидролиза солей: Be(N0 |
3)2, KI, |
|
Na 2S03, FeCl 3. |
|
|
177. Какие соли могут подвергаться гидролизу? Определите характер |
||
среды в растворах солей (рН < 7, рН > 7 или рН = 7). Составьте молеку |
|
|
лярные и ионно-молекулярные уравнения гидролиза солей: MgCl |
2, |
|
Sr(N0 3)2,Na 2Se03,KCN. |
|
|
178. Как протекает процесс гидролиза? Определите характер среды в |
||
растворах солей (рН < 7, рН > 7 или рН = 7). Составьте молекулярные и |
|
|
ионно-молекулярные уравнения гидролиза солей Na |
2Si03, NiS0 |
4, KBr, |
CrCl 3. |
|
|
179. Какие соли могут подвергаться гидролизу? Определите характер среды в растворах солей (рН < 7, рН > 7 или рН = 7). Составьте молеку
лярные и ионно-молекулярные уравнения гидролиза солей: NaI, Cr 2(S04)3, KN0 2, SnCl 2.
180.При сливании водных растворов двух солей хлорида хрома(III) и сульфида калия образуется осадок гидроксида металла и выделяется газ. Почему? Составьте молекулярное и ионно-молекулярное уравнения про исходящих реакций.
181.При сливании водных растворов двух солей сульфата железа(III)
икарбоната натрия образуется осадок гидроксида металла и выделяется газ. Почему? Составьте молекулярное и ионно-молекулярное уравнения происходящих реакций.
182.При сливании водных растворов двух солей сульфата хрома(III)
икарбоната натрия образуется осадок гидроксида металла и выделяется газ. Почему? Составьте молекулярное и ионно-молекулярное уравнения происходящих реакций.
183.Зависит ли окраска индикатора от характера среды? Можно ли
с помощью индикатора различить растворы солей: KN0 3 и KN0 2, А1С13 и LiCl, Na 2S03 и ZnS0 4? Ответ дайте на основании реакций гидролиза.
184. Зависит ли окраска индикатора от характера среды? Можно ли
с помощью индикатора различить растворы солей: NaCH 3COO и NaCl, Pb(N0 3)3 и LiN0 3, NH4Cl и Na 2S? Ответ дайте на основании реакций гид ролиза.
185. Зависит ли окраска индикатора от характера среды? Можно ли |
|
|||
с помощью индикатора различить растворы солей: Na |
2Si0 3 и NaBr, ZnS0 4 |
|||
и Li 2S04, Pb(N0 3)2 и K 2S? Ответ дайте на основании реакций гидролиза. |
|
|||
186. Какое из приведенных веществ: NaOH, NaCl, НС1 или NH |
4C1, |
|||
следует прибавить к раствору соли Na |
3P04, чтобы уменьшить степень |
|
||
гидролиза соли? Почему? |
|
|
|
|
187. Какое из приведенных веществ: H |
2S04, K 2S04, К 2С0 3, КОН сле |
|||
дует прибавить к раствору соли Cr |
2(S04)3, чтобы уменьшить степень гид |
|||
ролиза соли? Почему? |
|
|
|
|
98 |
99 |
