
3. . . .
.pdf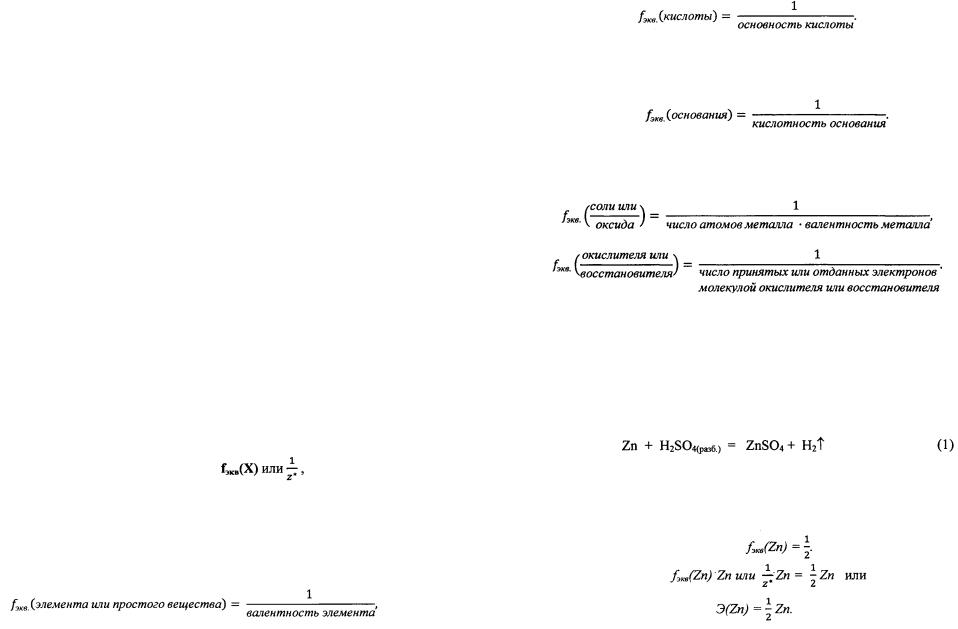
22. |
Какой объем при 17 °С и давлении 100 кПа занимают 12*10 |
23 моле |
кул кислорода? Какова их масса? Ответ: 48,2 л; 64 г. |
|
|
23. |
В колбу вместимостью 3 л при температуре 27 °С, из которой |
|
предварительно был выкачен воздух, ввели 1,5 л водорода и 2,8 л азота,
измеренных при н.у. Чему стало равно давление внутри колбы? |
Ответ: |
159 522 Па. |
|
24.Масса 1 л некоторого газа при нормальных условиях равна 1,52 г, а масса 1 л азота составляет 1,25 г. Вычислите молярную массу газа: по а) его плотности относительно азота; б) по молярно му объему. Ответ: 34,0 г/моль.
25.В стальном баллоне вместимостью 12 л находится при 0 °С кисло
род под давлением 15,2 МПа. Какой объем займет этот кислород при нор мальных условиях? Ответ: 1,8 м 3.
2.ЭКВИВАЛЕНТ
Закон эквивалентов является одним из основных законов химии. Эквивалент - это реальная или условная частица вещества X, которая
в данной кислотно-основной реакции эквивалентна одному иону водорода или в данной окислительно-восстановительной реакции эквивалентна од ному электрону.
Фактор эквивалентности- число, показывающее, какая доля реаль ной частицы вещества X эквивалентна одному иону водорода в данной кислотно-основной реакции или одному электрону в данной окислитель но-восстановительной реакции.
Фактор эквивалентности обозначают где z*- число эквивалентности.
Величина числа эквивалентности зависит от вещества, для которого определяется фактор эквивалентности.
Эквиваленту вещества X соответствует запись: 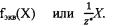 Фактор эквивалентности для веществ определяют:
Фактор эквивалентности для веществ определяют:
Основность кислоты - число атомов водорода в молекуле кислоты, способных замещаться на металл (или замещенных на металл в данной реакции).
Кислотность основания - число гидроксильных групп в молекуле основания, способных замещаться (или замещенных в данной реакции) на кислотный остаток.
Численное значение числа эквивалентности 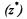 для веществ, участвующих в кислотно-основных реакциях, определяют по числу принятых или отданных протонов (ионов водорода), а в окислительновосстановительных реакциях - по числу принятых или отданных электронов.
для веществ, участвующих в кислотно-основных реакциях, определяют по числу принятых или отданных протонов (ионов водорода), а в окислительновосстановительных реакциях - по числу принятых или отданных электронов.
Например, при взаимодействии цинка с разбавленной серной кислотой протекает реакция:
В данной реакции один атом цинка замещает два иона водорода в кислоте, так как цинк двухвалентен. Поэтому фактор эквивалентности цинка равен 1/2, роль эквивалента цинка будет выполнять частица, соответствующая 1/2 атома цинка, т. е. условная частица.
Фактор эквивалентности цинка:
Эквивалент цинка:
20 |
21 |

При взаимодействии серной кислоты и гидроксида натрия реакция может протекать различно в зависимости от соотношения кислоты и основания:
При соотношении кислоты и основания 1 : 1 фактор эквивалентнос ти серной кислоты равен 1, так как только один ион водорода в кислоте замещается на металл, т. е. кислота ведет себя как одноосновная. Роль
эквивалента кислоты будет выполнять реальная частица - |
молекула серной |
||
кислоты |
|
|
|
Фактор эквивалентности серной кислоты: |
|
|
|
Эквивалент серной кислоты: |
|
|
или |
При соотношении кислоты и основания |
1 : 2 |
фактор эквивалент |
|
ности серной кислоты равен 1/2, поскольку в данной реакции два иона водорода в кислоте замещаются на металл, т. е. кислота ведет себя как двухосновная. Эквивалентом кислоты в данной реакции будет условная
частица -  молекулы кислоты.
молекулы кислоты.
Фактор эквивалентности серной кислоты: 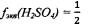 Эквивалент серной кислоты:
Эквивалент серной кислоты: 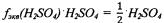 или
или
Фактор эквивалентности гидроксида натрия в обеих реакциях равен единице, так как только одна гидроксильная группа в этом основании может замещаться на кислотный остаток, а роль эквивалента будет выполнять реальная частица - молекула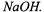
Фактор эквивалентности гидроксида натрия: 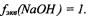 Эквивалент гидроксида натрия:
Эквивалент гидроксида натрия: 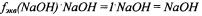
или |
|
|
Если взять порцию вещества, |
содержащую 6,02 *10 |
23 частиц, |
играющих роль эквивалента данного вещества X (или 1 моль |
|
|
эквивалентов вещества X), то их масса будет равна |
молярной массе |
|
эквивалента данного вещества. |
|
|
Молярная масса эквивалента вещества X |
равна произведению |
|
фактора эквивалентности вещества X на молярную массу данного |
||
вещества. |
|
|
Молярная масса эквивалента вещества X выражается в |
г/моль или |
|
кг/моль. |
|
|
Вреакции (1) молярная масса эквивалента цинка и серной кислоты будет иметь следующие значения:
Вреакции (2) молярная масса эквивалента серной кислоты и гидроксида натрия будет иметь следующие значения:
Вреакции (3) молярная масса эквивалента серной кислоты и гидроксида натрия будет иметь значения:
Зная массу вещества и молярную массу эквивалента этого вещества, можно определить количество вещества эквивалента (число моль эквивалентов данного вещества):
Для веществ, находящихся в газообразном состоянии, можно
определить эквивалентный объем |
|
Эквивалентный объем газа X |
равен произведению фактора |
эквивалентности на молярный объем: |
|
22 |
23 |

Эквивалентный объем газаобразного вещества зависит от свойств и состава газа, участвующего в реакции, и измеряется в л/моль.
Для выполнения расчетов, связанных с взаимодействием различных веществ, часто используют закон эквивалентов: вещества реагируют друг с другом и образуются в результате реакции в количествах, пропорциональных их эквивалентам.
Если в системе протекает реакция:
то число частиц-эквивалентов всех веществ, участвующих в реакции, должно быть одинаково
Следовательно, и количество вещества эквивалента для всех веществ, вступающих во взаимодействие и образующихся в результате реакции, должно иметь одинаковые значения
Если в данной реакции нас интересуют два вещества А и В, то тогда закон эквивалентов для этих веществ можно записать:
Если вещество В находится в газообразном состоянии (для газов проще определять объем выделившегося газа, а не массу), то закон эквивалентов можно записать:
24
где |
- объем газа В, приведенный к нормальным условиям; |
|
- эквивалентный объем газа В при нормальных условиях. |
|
Если оба реагирующих вещества находятся в растворе и известны |
концентрации раствора (молярные концентрации эквивалента), то закон эквивалентов можно записать таким образом:
-молярная концентрация эквивалента веществ А и В;
-объем раствора веществ А и В.
Взависимости от условий задачи выбирают форму математической записи закона эквивалентов
Пример 1. При разложении оксида металла массой 0,464 г получен металл массой 0,331 г. Определите молярную массу эквивалента металла. Какой это металл, если его валентность равна 2?
Второй способ.
По известным массам металла и оксида найдем массу кислорода, вступившего в реакцию с кислородом:
Дальше задачу решаем по закону эквивалентов:
25

Третий способ.
Задачу можно решать и по уравнению реакции, если известна степень окисления или валентность металла:
Обозначим: 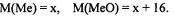 По уравнению реакции можно составить соотношение:
По уравнению реакции можно составить соотношение:
Следовательно, металл - кальций.
Пример 2. При обработке медно-алюминиевого сплава массой 10 г избытком соляной кислоты выделилось 7 л газа (н. у.). Определите состав сплава.
Медь в ряду напряжений металлов стоит после водорода, следовательно, медь не может вытеснять водород из кислот.
Поэтому водород, выделившийся при обработке сплава соляной кислотой, образовался за счет взаимодействия алюминия и соляной кислоты.
Массу прореагировавшего алюминия можно вычислить или по закону эквивалентов, или по уравнению реакции. Запишем закон эквивалентов в виде, удобном для расчета:
Пример 3. Какой объем водорода выделится при взаимодействии 120 г магния с кислотой? Газ измерен при температуре 27 °С и давлении 102.3 кПа.
Для того чтобы определить объем водорода при условиях, указанных в задаче, воспользуемся объединенным газовым законом:
Второй способ.
Закон эквивалентов можно записать и таким образом:
26 |
27 |

Пример 4. Определите массу гидросульфата натрия, образующегося при нейтрализации серной кислотой раствора, содержащего 8 г
Задачу можно решать и по уравнению реакции и по закону эквива лентов. Применим закон эквивалентов:
28
Задания для самостоятельной работы
26.В оксиде свинца содержится 7,18 % кислорода. Определите мо лярную массу эквивалента свинца, его валентность и составьте формулу этого оксида. Ответ:103,4 г/моль.
27.1 г металла двухвалентного метала взаимодействует с 1,74 г серы. Рассчитайте молярную массу эквивалента металла. Какой это металл? Со ставьте уравнение реакции взаимодействия металла с серой.
Ответ:27,84 г/моль.
28.Одна и та же масса металла реагирует с 0,4 г кислорода и с 6,346 г галогена. Определите молярную массу эквивалента галогена. Какой это неметалл? Ответ:126,9 г/моль.
29.3,2 г кальция вытесняют из кислоты столько водорода, сколько вытесняет водорода другой двухвалентный металл, массой 5,23 г. Рассчи тайте молярную массу эквивалента металла и назовите этот металл.
Ответ:32,69 г/моль.
30.Вычислите молярную массу эквивалента металла, если 2,74 г это го металла вытесняют из кислоты 1 л водорода, измеренного при 18 °С и давлении 101,3 кПа. Ответ:32,62 г/моль.
31.После обработки 0,286 г хлорида металла(И) азотнокислым сереб ром образовалось 0,861 г AgCl. Определите молярную массу эквивалента
металла и запишите уравнение реакции. |
Ответ: 12,15 г/моль. |
32.При взаимодействии 5,2 г гидроксида трехвалентного металла с серной кислотой образуется 11,4 г сульфата. Рассчитайте молярную массу эквивалента металла. Определите, какой это металл. Запишите уравнение реакции. Ответ: 9 г/моль.
33.Определите молярную массу эквивалента металла, если при взаи модействии 2,5 г карбоната этого металла при реакции с азотной кислотой образуется 4,1 г нитрата. Определите,какой это металл. Составьте уравне ние реакции. Ответ:20 г/моль.
34.При взаимодействии 3,24 г трехвалентного металла с кислотой выделилось 4,03 л водорода (н. у.). Вычислите молярную массу эквива
лента металла и его молярную массу. Чему равна масса одного атома это го металла? Ответ:9 г/моль, 4,48*10 23г.
29
35.При прокаливании 1,28 г оксида двухвалентного металла в токе водорода выделилось 0,283 г воды. Определите молярные массы эквива лента металла и его оксида. Оксид какого металла был взят? Составьте уравнение реакции. Ответ: 32,7 г,моль, 40,7 г/моль.
36.Какова молярная масса эквивалента металла, если при взаимодей
ствии 0,45 г металла с кислотой выделился водород объемом 0,282 дм |
3? |
|
Газ измерен при температуре 20 °С и давлении |
97 325 Па. |
|
Ответ: 20 г/моль. |
|
|
37. Для растворения металла X массой 2,7 |
г потребовалось 14,7 сер |
|
ной кислоты. Определите молярную массу эквивалента металла. Какой металл растворили в кислоте, если его валентность равна 3? Какой объем водорода выделился при этом (н. у.)? Ответ:9 г/моль, 3,36 л.
38.Какую массу раствора серной кислоты с массовой долей 20 % не обходимо взять для нейтрализации гидроксида алюминия массой 56 г? Напишите уравнение реакции. Ответ: 1524,4 г.
39.Какова молярная масса эквивалента металла, если при взаимодей
ствии 1,60 г металла с кислотой выделился водород объемом 1,53 дм 3? Газ измерен при температуре 10 °С и давлении 102 658 Па. Ответ: 12 г/моль.
40.Оксид металла содержит 28,57% кислорода, а фторид этого метал ла - 48,72% фтора. Вычислите молярные массы эквивалента металла и фтора. Ответ:20 г/моль, 19 г/моль.
41.Определите, какой объем водорода выделится при взаимодейст вии алюминия массой 21 г с кислотой при температуре 17 °С и давлении 99 648 Па. Ответ: 29,09 л.
42.Сульфид мышьяка содержит 39,0 % серы. Молярная масса эквива лента серы 16 г/моль. Вычислите молярную массу эквивалента мышьяка, составьте формулу данного сульфида и реакцию его образования. Ответ:25,02 г/моль.
43.Массовая доля кислорода в первом оксиде олова составляет
21,2 %, во втором - 11,9 %. Определите молярную массу эквивалента и валентность олова в его оксидах. Составьте формулы этих оксидов. Ответ: 29,73 г/моль, 59,2 г/моль.
30
44.Для реакции металла массой 0,44 г потребовался бром массой 3,91 г. Молярная масса эквивалента брома равна 79,9 г/моль. Определите молярную массу эквивалента металла. Какой это металл, если он трехва лентен? Составьте уравнения реакции взаимодействия металла с бромом. Ответ:9 г/моль.
45.При окислении металла массой 4,30 г образовался оксид металла массой 8,12 г. Валентность металла в оксиде 3. Какова молярная масса эк вивалента металла и его оксида? Какой это металл?
Ответ:9 г/моль, 17 г/моль.
46.Определите молярную массу эквивалента гидроксида двухвалент ного металла, если на нейтрализацию 222 г гидроксида пошло 196 г фос форной кислоты. Определите гидроксид металла и составьте уравнение
реакции нейтрализации. Ответ: 37 г/моль.
41. Рассчитайте молярную массу эквивалента алюминия и его оксида, если при сгорании алюминия массой 10,1 г образуется оксид массой 19,1 г. Какой объем кислорода потребуется для окисления этой массы ме
талла при нормальных условиях? |
Ответ:9 г/моль, 6,28 л. |
|
|
48. На нейтрализацию 1,206 г щавелевой кислоты Н |
2С204 потребова |
||
лось 1,502 г КОН. Вычислите молярную массу эквивалента кислоты. За |
|
||
пишите уравнение этой реакции. |
Ответ:44,96 г/моль. |
|
|
49. Какова молярная масса эквивалента металла, если при взаимодей |
3? |
||
ствии 0,45 г металла с кислотой выделился водород объемом 0,282 дм |
|||
Газ измерен при температуре 20 °С и давлении 97 325 Па. |
Ответ: |
|
|
20г/моль.
50.На нейтрализацию 14,7 г ортофосфорной кислоты израсходовано 12,0 г NaOH. Вычислите эквивалентную массу и основность ортофосфор ной кислоты. Напишите уравнение соответствующей реакции.
Ответ: 49 г/моль.
3. ЭЛЕКТРОННАЯ СТРУКТУРА АТОМОВ. ЗАВИСИМОСТЬ СВОЙСТВ ЭЛЕМЕНТОВ ОТ СТРОЕНИЯ ИХ АТОМОВ
Согласно квантово-механическим представлениям состояние ка ждого электрона в атоме химического элемента определяется значе-
31
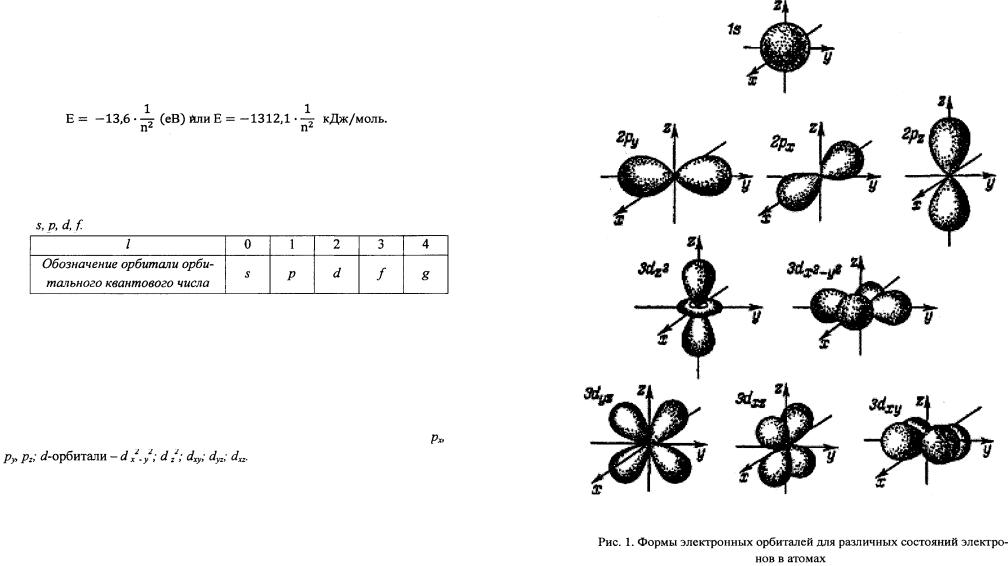
ниями четырех квантовых чисел: главного n |
, орбитального l, магнит |
||
ного ml и спинового числа |
m s (или s) Состояние электрона в атоме, |
||
отвечающее определенным значениям квантовых чисел n |
, l, и ml, на |
||
зывается атомной электронной орбиталью. |
В графических схемах |
||
каждая орбиталь обозначается символом •.
Главное квантовое число n характеризует общую энергию элек трона в атоме на данном энергетическом уровне, а также размер электронного облака. Главное квантовое число принимает целочисленные значения от 1 до 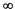
Орбитальное квантовое число l характеризует энергию электрона на подуровне и форму электронного облака. Орбитальное квантовое число принимает целочисленные значения от 0 до (n - 1), где n - главное кван товое число. Различные значения l принято обозначать латинскими бук вами
Форма s-электронных орбиталей - сферическая; p-орбитали
имеют форму, напоминающую гантель; d и f- более сложную форму. Движение электрона вызывает появление магнитного поля (рис. 1).
Магнитное квантовое число ml характеризует ориентацию ор-
битали в пространстве, |
выражая проекцию орбитального момента |
||
импульса на направление магнитного поля. |
Принимает целочисленные |
||
значения от -1 ...0 ... до |
+7, т. е. всего (2l+l) |
значений. |
|
По характеру ориентации в пространстве p-орбитали обозначаются |
|||
Магнитное квантовое число |
m l отражает распределение электро |
||
нов по квантовым ячейкам (орбиталям) в пределах данного энергети |
|||
ческого подуровня. |
|
|
|
Например, на энергетическом подуровне |
р (L = 1) электроны мо |
||
гут располагаться в трех квантовых ячейках, что соответствует ори-
ентации по оси х, у, z. Поскольку магнитное квантовое число ml име ет три значения: -1, 0,+1. При l = 3 (на f-подуровне) магнитное кван товое число может иметь семь значений: -3, -2, —1, 0, +1, +2, +3.
32 |
33 |
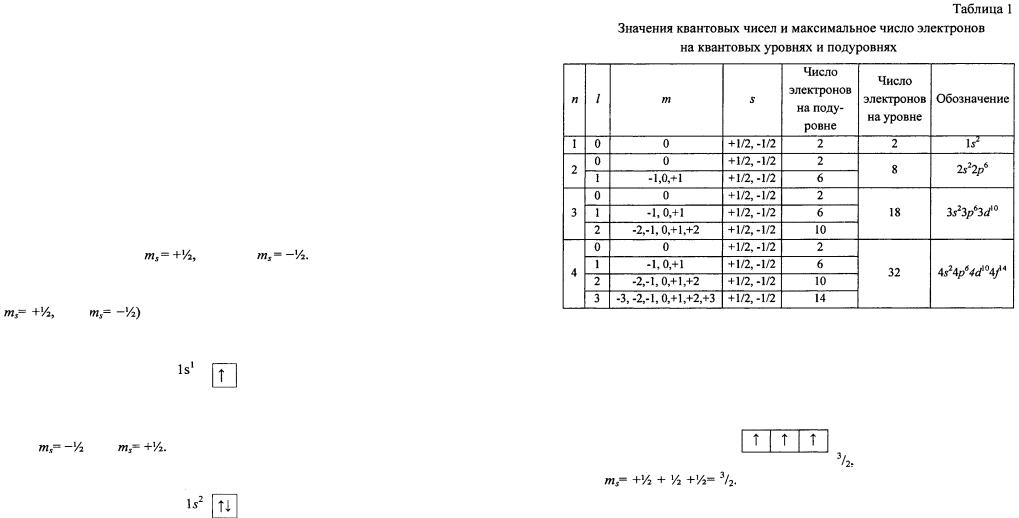
Электрон, занимающий определенную орбиталь, характеризуется тремя квантовыми числами, описывающими эту орбиталь, и четвер тым квантовым числом (спиновым), которое характеризует спин электрона - одно из свойств (наряду с массой и зарядом) этой эле ментарной частицы. Спин - собственный магнитный момент коли чества движения элементарной частицы. Спиновое квантовое число принимает значения 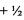 или
или 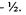
Распределение электронов в атоме подчиняется квантовомеханическим законам: принципам минимальной энергии и Паули, правилам Гунда и Клечковского).
Принцип минимальной энергии - электроны в основном состоя нии заполняют орбитали в порядке повышения уровня энергии.
Принцип Паули — в атоме не может быть двух электронов с оди наковым набором четырех квантовых чисел, т. е. на каждой орбитали (квантовой ячейке) может быть не более двух электронов, различаю
щихся числом |
m s. В атоме могут быть лишь два электрона с одинако- |
||
выми n , l , и ml : один с |
другой с |
|
|
Рассмотрим атом водорода |
]Н. В нем имеется один электрон, и |
||
спин этого электрона может быть направлен произвольно (т. е. |
|||
или |
Остальные квантовые числа электрона: n = 1, |
||
l = 0, и ml= 0. Состояние электрона в атоме водорода можно предста |
|||
вить как 1s 1, или, что то же самое: |
|
|
|
В атоме гелия 2 Hе квантовые числа |
n= 1,l = 0 и ml=0 одинаковы |
||
для обоих его электронов, а квантовое число |
m s отличается, может |
||
быть |
или |
|
|
Строение электронной оболочки атома гелия можно представить |
|||
как 1s 2, или, что то же самое: |
|
|
|
Таким образом, согласно принципу Паули на 1s орбитали может на ходиться не более двух электронов. То же самое относится и к любой дру-
34
гой орбитали. Принцип Паули дает возможность рассчитать емкость энер гетических уровней и подуровней. В табл. 1 приведены значения и обо значения квантовых чисел, а также число электронов на соответствующем энергетическом уровне в подуровне.
Правило Гунда (иногда пишут Хунда) - в пределах подуровня электроны стремятся занять максимальное число свободных орбиталей. При этом суммарный спин электронов должен быть максимален.
Если, например, в трех р-ячейках атома азота необходимо рас пределить три элекрона, то они будут располагаться каждый в от дельной ячейке, т. е. размещаться на трех разных р-орбиталях:
В этом случае суммарный спин равен
равна |
В любом другом случае суммарный спин |
будет меньше. |
|
Правило Клечковского - |
увеличение энергии и заполнение орби- |
талей электронами происходит в порядке возрастания суммы кванто-
35

вых чисел а при их равной сумме - в порядке возрастания чис ла n.
Пример 1. Какой подуровень будет заполняться вслед за подуровнем
Решение.Подуровню |
5s соответствует сумма |
(n + l), |
равная 5 + 0 = 5. |
||
Такой же суммой (n + l) |
характеризуются подуровни Ар и 3d, но заполне |
||||
ние этих подуровней предшествует заполнению подуровня |
5s, так как по |
||||
следнему отвечает большее значение главного квантового числа. Следова |
|||||
тельно, порядок заполнения подуравней, имеющих сумму |
(n + l), |
равную |
|||
5, будет следующий: 3d |
- 4р -5s. |
После заполнения подуровня |
5s будет |
||
заполняться подуровень с суммой |
(n + l) = 6, причем из всех возможных |
||||
комбинаций n + l, соответствующих этой сумме 4 |
d (n = 4, l = 2); |
5р (n = 5, |
|||
l = 1); 6s (n = 6, l = 0), первой будет реализовываться комбинация с наи меньшим значением главного квантового числа, т. е. вслед за подуровнем
5sбудет заполняться подуровень 4 |
d. |
|
|
|
|
|
|
|
||||
Пример 2. Составьте электронную формулу атома элемента с по |
|
|
||||||||||
рядковым номером 16. Определите валентные электроны этого эле |
|
|
||||||||||
мента. Какие свойства будет проявлять этот элемент? |
|
|
|
|||||||||
Решение.Так как число электронов в атоме равно его порядково |
|
|
||||||||||
му номеру в периодической таблице, то для элемента № 16 (S) элек |
|
|
||||||||||
тронная формула имеет вид: |
ls |
2 |
2 |
6 |
2 |
4 |
|
|
|
|||
2s 2p3s 3p. Элемент находится в 6 |
||||||||||||
группе, главной подгруппе, число валентных электронов равно шести |
|
|
||||||||||
2 |
4 |
|
|
|
|
|
|
|
|
|
||
- 3s |
3p. Элемент относится к р-элементам. Поскольку на внешнем |
|
|
|||||||||
слое находится 6 электронов, то элемент будет проявлять свойства |
|
|
||||||||||
неметалла. |
|
|
|
|
|
|
|
|
|
|||
Пример 3. Определите, какими значениями квантовых чисел |
|
|
(n, l |
|||||||||
и ml) |
|
характеризуются внешние p-электроны в атоме элемента, |
2 |
2 |
|
|||||||
имеющего электронную конфигурацию внешнего слоя 4 |
Уста |
|||||||||||
s 4p. |
||||||||||||
новите, что это за элемент.
Решение.Так как главное квантовое число n определяет энерге тический уровень и номер периода, то данный элемент находится в четвертом периоде n = 4. Орбитальное квантовое число характеризу ет энергетический подуровень на данном энергетическом уровне и
36
принимает значения от 0 до n-1 т. е. при n = 4, l = 0, 1, 2, 3 или бук
венные обозначения s, р, d, f. |
|
Магнитное квантовое число |
ml принимает значения от -1 через О |
до +1, т. е. при l =1,ml = -l,0, +1. Оно характеризует число орбиталей на данном подуровне.
Согласно электронной формуле атома, приведенной в условии задачи, этот элемент имеет порядковый номер 32, и его полная элек-
тронная формула имеет вид: |
что соответст- |
вует элементу Ge. Валентные электроны германия |
будут ха |
рактеризоваться набором из четырех квантовых чисел: |
|
Пример 4. Составьте электронные формулы атома хлора и его иона.
Решение.В соответствии с порядковым номером элемента хлора, равным 17, определяющим положительный заряд ядра и суммарное число электронов, нейтральный атом хлора имеет следующую электронную конфигурацию: 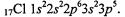
Отрицательно заряженные ионы образуются при присоединении к |
|
|
нейтральному атому электронов. Приобретая один электрон, атом пре- |
|
|
вращается в отрицательно заряженный ион |
|
|
Пример 5. Напишите электронные конфигурации следующих ионов: |
|
|
Решение.Положительно заряженные ионы образуются в том случае, |
|
|
когда от нейтрального атома под действием энергии извне отрываются |
|
|
электроны. Нейтральный атом алюминия имеет следующую электронную |
|
|
конфигурацию: |
Последний застраивающийся слой |
|
В том случае, когда атом алюминия превращается в ион |
то от |
|
нейтрального атома отрываются 3 электрона, имеющие наибольшую |
|
|
|
37 |
|

энергию, т. е. с 3s- и 3pподуровней, вследствие чего ион имеет следующую электронную конфигурацию: 
Нейтральный атом железа имеет следующую электронную
конфигурацию: |
При отрыве от атома двух |
электронов атом превращается в ион |
При |
отрыве от атома трех электронов атом превращается в ион
Задания для самостоятельной работы
51.Что понимают в квантовой механике под орбиталью? Каким кван товым числом определяется положение орбитали в пространстве? Какие значения может принимать это квантовое число? Сколько орбиталей вхо дит в состав третьего энергетического уровня? Почему? Составьте элек тронную формулу элемента, у которого заканчивается заполнение третье го энергетического уровня.
52.Какова последовательность заполнения электронами орбиталей четвертого энергетического уровня? Почему? Сформулируйте правило Клечковского. Запишите электронную формулу атома висмута с учетом принципа наименьшей энергии. К какому семейству принадлежит этот элемент? Какие свойства он должен проявлять?
53.Из каких частиц состоит атом? Атом элемента имеет поряд ковый номер 40 и массовое число 91. Определите общее число элек тронов у атома этого элемента, число протонов и нейтронов, а также число валентных электронов. Напишите электронную формулу этого элемента. Какими квантовыми числами характеризуются валентные электроны атома? Какую валентность может проявлять этот элемент? Почему? Какие свойства должны быть для него характерны?
54.В чем заключается принцип Паули? Составьте электронную формулу атома мышьяка. Охарактеризуйте набором квантовых чисел валентные электроны атома мышьяка, находящегося в невозбужден ном и возбужденном состояниях? Какую валентность и степень окис ления может проявлять этот элемент?
55.В чем суть принципа наименьшей энергии? Правило Клечковско го. Какая из орбиталей каждой из указанных пар имеет низкую энергию в
38
многоэлектронном атоме: а) Зр и 5s; б) 2s и 2р; в) 3d и 3s; г) 5d и 4f? По чему? Составьте электронную формулу атома свинца с учетом принципа наименьшей энергии.
56.В чем заключается правило Гунда ( Хунда)? Составьте электрон ные формулы атомов с порядковыми номерами 33 и 75. Чему равен сум марный спин p-электронов у атома первого элемента и d-электронов у атома второго элемента?
57.В чем суть принципа Паули? Определите полное число электронов
ватоме, имеющих следующие квантовые числа:
58.Что такое «провал» или «проскок» электрона? Для элементов какого семейства может наблюдаться это явление? Приведите при меры двух элементов (желательно разных семейств), у которых про исходит «провал» электрона. Составьте электронные формулы этих элементов.
59.Напишите электронные формулы атомов марганца и мышья
ка. Какое правило используется для определения количества неспаренных электронов у каждого из этих атомов? Исходя из электронной конфигурации атомов, определите возможные степени окисления атомов.
60.Какое квантовое число определяет число орбиталей на подуровне? Из скольких подуровней состоит 4-й энергетический уровень? Сколько ор биталей он содержит? Почему? Составьте электронную формулу элемента,
укоторого заканчивается заполнение 4d-подуровня.
61.У какого атома сильнее выражены металлические свойства, если электронная структура валентного слоя атома может быть записана сле-
дующим образом: |
По- |
чему? Ответ дайте, исходя из полных электронных формул атомов дан |
|
ных элементов. |
|
62. Напишите электронные формулы 43 и 51 элементов. Определи |
|
те количество неспаренных электронов у каждого из этих атомов? Ис |
|
ходя из электронно-графической конфигурации атомов в возбужденном |
|
39 |
|
