
3. . . .
.pdf
По закону эквивалентов:
Для определения массы осадка также воспользуемся законом эквива лентов:
Б) Второй способ(по уравнению реакции).
Составим уравнение реакции взаимодействия хлорида железа(III) и гидроксида натрия:
По условию задачи определим, какое количество вещества хлорида железа(III) содержится в исходном растворе, предварительно определим молярную концентрацию раствора хлорида железа(III):
Из уравнения реакции следует, что:
По данным задачи в реакцию должно вступить 0,15 моль хлорида железа(III), поэтому можно записать следующее соотношение:
60
Для осаждения гидроксида железа(Ш) используется раствор гидроксида натрия с молярной концентрацией 0,25 моль/л. Зная молярную кон центрацию раствора данного основания и количество вещества гидрокси да натрия, необходимого для данного процесса, вычислим объем раствора NaOH:
Из уравнения реакции следует, что:
Следовательно,
Масса выпавшего в осадок гидроксида железа(III) будет равна:
Ответ: 1,8 л, 16 г/моль. |
|
Пример 5. Какая масса гидроксида магния Mg(OH) |
2 может быть ней |
трализована 200 мл раствора соляной кислоты с массовой долей кислоты, |
|
равной 20 %, и плотностью раствора, равной 1,098 г/см |
3? |
В растворе протекает реакция: 2НС1 + Mg(OH) 2 = MgCl 2 + 2Н 20.
По закону эквивалентов - количество веще ства эквивалента кислоты равно количеству ве щества эквивалента основания:
По данным задачи вычислим массу НС1:
По закону эквивалентов определим массу гидроксида магния:
61
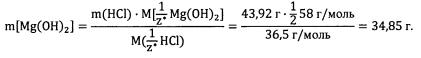
Ответ: 34,85 г.
Задания для самостоятельной работы
101. |
Вычислите молярную концентрацию, молярную концентрацию |
|
эквивалента и моляльность раствора серной кислоты с массовой долей |
||
H2SO4,равной 20 %, и плотностью 1,14 г/мл . |
Ответ: 2,33 г/моль; |
|
4,6 моль/л; 2,55 моль/кг. |
|
|
102. |
В лаборатории находится раствор карбоната натрия Na 2C0 3 с мо |
|
лярной концентрацией, равной 1,45 моль/л, и плотностью раствора, рав ной 1,14 г/см 3. Вычислите молярную концентрацию эквивалента, моляль
ность и массовую долю вещества данного раствора. |
Ответ: 2,9 моль/л; |
|
1,47моль/кг; 13,48% |
|
|
103. В лаборатории находится раствор нитрата натрия NaN0 |
3 |
|
с молярной концентрацией, равной 6,2 моль/л, и плотностью раствора, равной 1,317 г/см 3. Вычислите молярную концентрацию эквивалента, мо ляльность и массовую долю вещества данного раствора.
Ответ: 6, 2моль/л; 7,84моль/кг; 40,0 %.
104.Водный раствор содержит 577 г серной кислоты в 1 литре. Плотность раствора 1,335 г/мл. Вычислите массовую долю, молярную концентрацию, молярную концентрацию эквивалента, молярность в полу ченном растворе. Ответ: 43,22 %; 11,76моль/л; 5,88моль/л; 7,76моль/кг.
105.Вычислите массовую долю азотной кислоты в растворе азотной кислоты с молярной концентрацией эквивалента 8 моль/л и плотностью 1,246 г/мл. Чему равна молярность раствора азотной кислоты? Какова
молярная доля азотной кислоты в этом растворе? |
Ответ: 40,5 %; |
10,8 моль/кг; 0,162. |
|
106.Вычислите молярную массу эквивалента двухосновной кислоты,
в12,5 н растворе которой массовая доля этой кислоты 37 % , а плотность 1,664 г/мл. Какая это кислота? Чему равны молярная концентрация, мо-
лярность и титр раствора этой кислоты? |
Ответ: 49,2 г/моль; |
6,25 моль/л; 5,94моль/кг; 0,6156г/мл. |
|
107. Какой объем фосфорной кислоты с молярной концентрацией 6 моль/л необходимо взять для приготовления 0,5 л раствора кислоты
с молярной концентрацией эквивалента Н 3Р04, равной 0,1 моль/л, считая, что фосфорная кислота используется для получения гидрофосфата на трия? Ответ: 4,17 мл.
108.Определите молярную концентрацию эквивалента, молярность
имассовую долю сульфата железа(III) в растворе с молярной концентра цией сульфата железа(III), равной 8 моль/л, если плотность раствора рав
на 1,00 г/мл. Чему равен титр раствора? |
Ответ: 4,8 моль/л; 1,18 моль/кг; |
|
32 %; 0,3199 г/мл. |
|
|
109. Для проведения титрования необходимо приготовить раствор |
|
|
перманганата калия объемом 2,0 л. Титр этого раствора должен быть |
|
|
0,0054 г/см 3. Какой объем раствора КМn0 |
4 с массовой долей 5 % и плот |
|
ностью 1,025 г/см 3 необходимо взять для приготовления раствора, исполь |
|
|
зуемого для титрования? Ответ: 210,7мл. |
|
|
110. Для проведения титрования необходимо приготовить раствор |
3. |
|
йодида калия объемом 0,5 л. Титр этого раствора должен быть 0,017 г/см |
||
Какой объем раствора KI с массовой долей 15 % и плотностью 1,031 г/см |
3 |
|
|
||
необходимо взять для приготовления раствора, используемого для титро вания? Ответ: 54,96 мл.
111.Какой объем раствора НС1 с массовой долей соляной кислоты 10 % и плотностью 1,049 г/мл надо взять для приготовления раствора объемом 350 мл с молярной концентрацией эквивалента 0,2 моль/л?
Ответ: 24,36 мл.
112.До какого объема следует разбавить раствор НС1 объемом 25 мл
смолярной концентрацией 6 моль/л, чтобы концентрация стала равной
0,2 моль/л? Ответ: 0,75 л.
113. Какой объем раствора серной кислоты с массовой долей серной кислоты 96 % и плотностью 1,835 г/мл нужно взять для приготовления 5 л 0,5 н раствора серной кислоты? Ответ: 0,14 л.
62 |
63 |

114.Какой объем раствора фосфорной кислоты с массовой долей
Н3Р04 36 % и плотностью 1,216 г/мл требуется для приготовления 13 л
0,15 н раствора фосфорной кислоты. Ответ: 0,142 л. |
|
|
|||
115. Смешаны 0,8 л 1,5 н раствора гидроксида натрия и 0,4 л 0,6 н |
|
||||
раствора гидроксида натрия. Какова молярная концентрация эквивалента |
|
||||
и молярная концентрация полученного раствора? |
Ответ: 1,2 моль/л. |
|
|||
116. До какого объема нужно разбавить 30 %-ный раствор нитрата |
|
||||
свинца(И) объемом 25 мл плотностью 1,33 г/мл, чтобы получить раствор |
|
||||
соли с молярной концентрацией 0,2 моль/л и плотностью 1,08 г/мл? |
От |
||||
вет: 150 мл. |
|
|
|
|
|
117. Какая масса гидроксида алюминия А1(ОН) |
3 может быть нейтра |
||||
лизована 500 мл раствора азотной кислоты HN0 |
3 с массовой долей кисло |
||||
ты, равной 50 %, и плотностью раствора, равной 1,310 г/см |
3? Ответ: |
||||
135,16 г. |
|
|
|
|
|
118. Какая масса гидроксида меди(П) Си(ОН |
)2 может быть нейтрали |
||||
зована 350 мл раствора серной кислоты H |
2S04 с массовой долей кислоты, |
||||
равной 15 %, и плотностью раствора, равной 1,102 г/см |
3? Ответ: 57,56 г. |
||||
119. Какой объем раствора гидроксида натрия с массовой долей, рав |
|
||||
ной 30 %, плотностью 1,328 г/см |
3 необходимо взять для нейтрализации |
||||
раствора кислоты азотной кислоты HN0 |
3 объемом, равным 500 мл, |
|
|||
с молярной концентрацией кислоты 2,0 моль/л? |
Ответ: 100,4 мл. |
|
|||
120. Какой объем раствора гидроксида натрия с массовой долей, рав |
|
||||
ной 20 %, плотностью 1,219 г/см |
3 необходимо взять для нейтрализации |
||||
раствора кислоты фосфорной кислоты Н |
3Р04 объемом, равным 300 мл, |
||||
с молярной концентрацией эквивалента кислоты 1,5 моль/л? |
Ответ: |
||||
73,8мл. |
|
|
|
|
|
121. Какой объем раствора гидроксида натрия с массовой долей, рав |
|
||||
ной 24%, плотностью 1,263 г/см |
3 необходимо взять для нейтрализации |
|
|||
раствора кислоты серной кислоты H |
2S04 объемом, равным 200 мл, с мо |
||||
лярной концентрацией эквивалента кислоты 0,5 моль/л. |
Ответ: 13,2 мл. |
||||
122. Какой объем фосфорной кислоты с молярной концентрацией эк |
|
||||
вивалента, равной 2,0 моль/л необходим для нейтрализации раствора гид- |
|
||||
|
64 |
|
|
|
|
роксида Ва(ОН) 2 объемом 400 мл и молярной концентрацией, равной 1.5 моль/л? Какая масса соли получится при этом? Ответ: 0,6л; 120,2 г.
123. Какой объем серной кислоты с молярной концентрацией, равной
1,2 моль/л необходим для нейтрализации раствора гидроксида КОН объе мом 200 мл и молярной концентрацией, равной 2,0 моль/л? Какая масса соли получится при этом? Ответ: 0,167л; 58,8 г.
124. К 600 мл раствора гидроксида калия с молярной концентрацией 2,2 моль/л прибавили 1,4 л раствор КОН с массовой долей 12 % и плотно стью 1,10 г/см 3. Определите молярную концентрацию и молярную кон центрацию эквивалента полученного раствора. Ответ: 2,31 моль/л.
125. К 400 мл раствора хлорида бария с молярной концентрацией 1,2 моль/л прибавили 0,4 л раствора ВаС1 2 с массовой долей 8 % и плот ностью 1,061 г/см 3. Определите молярную концентрацию и молярную
концентрацию эквивалента полученного раствора. |
Ответ: 0,80 моль/л; |
1.6 моль/л. |
|
6 ЭНЕРГЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ. ХИМИКО-ТЕРМОДИНАМИЧЕСКИЕ РАСЧЕТЫ
Науку о взаимных превращениях различных видов энергии называют термодинамикой.Термодинамика устанавливает законы этих превраще ний, а также направление самопроизвольного течения различных процес сов в данных условиях.
Протекание химической реакции сопровождается изменением внут ренней энергии реагирующих систем. Если внутренняя энергия системы
уменьшается 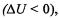 то реакция протекает с выделением энергии (экзотермическиереакции). Если же внутренняя энергия системы возрастает
то реакция протекает с выделением энергии (экзотермическиереакции). Если же внутренняя энергия системы возрастает
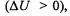 то процесс сопровождается поглощением энергии из внешней среды (эндотермические реакции).
то процесс сопровождается поглощением энергии из внешней среды (эндотермические реакции).
Если в результате протекания химической реакции система поглотила
количество теплоты Q и совершила работу |
А, то изменение внутренней |
|
энергии |
определяется уравнением: |
|
Согласно закону сохранения энергии, |
зависит только от начального |
|
и конечного состояний системы, но не зависит от способа осуществления
65
процесса (реакции). Напротив, Q и А при разных способах осуществления процесса будут различаться: функцией состояния является только раз
ность этих величин, но не каждая из них в отдельности. Функции |
U, Q и A |
обычно выражают в джоулях или в килоджоулях. |
|
Химические реакции чаще осуществляются при постоянном давлении  изобарный процесс). В подобных случаях для характеристики процесса удобнее пользоваться не внутренней энергией U, а энтальпией Н, которая определяется соотношением:
изобарный процесс). В подобных случаях для характеристики процесса удобнее пользоваться не внутренней энергией U, а энтальпией Н, которая определяется соотношением:
Энтальпия имеет ту же размерность, что и внутренняя энергия, и по этому обычно выражается в Дж (джоулях) или кДж (килоджоулях).
При постоянстве давления
т. е. изменение энтальпии равно сумме изменения внутренней энергии
и совершенной системой работы расширения |
Если при этом ни- |
какие другие виды работы не совершаются, то |
где Q p - тепловой |
эффект реакции,протекающей при постоянном давлении. Для экзотерми |
|
ческой реакции Qp < О, для эндотермической |
Qp > 0. |
Изменение внутренней энергии или энтальпии принято относить к тому случаю, когда все исходные вещества и все продукты реакции нахо
дятся в стандартных состояниях. Стандартным состоянием вещества на зывается его состояние в виде чистого вещества при температуре 298 К и давлении (в случае газов - при парциальном давлении данного газа), равном нормальному атмосферному давлению (101,325 кПа, или 760 мм рт. ст.). Условия, при которых все участвующие в реакции вещества находятся в стандартных состояниях, называются стандартными условиями протека ния реакции. Отнесенные к стандартным условиям изменения соответст вующих величин называются стандартными изменениями, и их обозначе-
ния снабжаются верхним индексом °: |
- стандартное изменение внут |
ренней энергии при химической реакции, |
|
тальпии при химической реакции (или, короче, стандартная энтальпия ре акции).
Стандартная энтальпия реакции образования (теплота образования) 1 моля данного вещества из простых веществ, взятых в их устойчивом со
стоянии, называется стандартной энтальпией образования этого вещест ва. Эту величину обычно выражают в кДж/моль. Обычно энтальпии обра зования относят к стандартному состоянию, т. е. 101 325 Па и 25 °С (298 К), и обозначают как 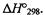
Энтальпия и внутренняя энергия образования простых веществ, со гласно приведенному определению, равны нулю. Если элемент образует несколько простых веществ (графит и алмаз, белый и красный фосфор и т. п.), то стандартным считается состояние элемента в виде наиболее ус тойчивой при данных условиях модификации (например, при обычных ус ловиях - графит в случае углерода, 0 2 в случае кислорода и т. д.); эн тальпия и внутренняя энергия образования этой наиболее устойчивой мо дификации принимаются равными нулю.
Химические уравнения, в которых указаны агрегатные состояния веществ и изменения энтальпии (тепловые эффекты реакций), называют ся термохимическими уравнениями. Например, уравнение
означает, что при восстановлении 1 моля MgO оксидом углерода(П) по глощается количество теплоты, равное 318,5 кДж. Сокращения «к», «ж» и «г» указывают соответственно на кристаллическое, жидкое или газооб разное состояние вещества.
В основе термохимических расчетов лежит следствие закона сохране ния энергии - закон Г. И. Гесса (1840 г .):тепловой эффект химической реакции (т. е. изменение энтальпии или внутренней энергии системы в ре зультате реакции) зависит только от начального и конечного состояний участвующих в реакции веществ и не зависит от промежуточных стадий процесса.
Из закона Гесса следует, в частности, что термохимические уравне ния можно складывать, вычитать и умножать на численные множители.
Пример 1. Исходя из теплоты образования газообразного оксида уг лерода(II) 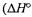 = -110,5 кДж/моль) и термохимического уравнения
= -110,5 кДж/моль) и термохимического уравнения
66 |
67 |

вычислите теплоту образования Н |
20(Г). |
|
Решение.Обозначив искомую величину через |
х, запишем термохи |
|
мическое уравнение образования Н |
20 из простых веществ: |
|
Запишем также термохимическое уравнение реакции образования С0 2(г) из простых веществ:
Из уравнений (2) и (3) можно получить уравнение (1). Для этого вычтем из уравнения (3) уравнение (2). Имеем:
Сравнивая уравнения (1) и (4), находим: -110,5 |
-х = 131,3, |
откуда х = -241,8 кДж/моль. |
|
Ответ: 
Следствие закона Гесса: стандартное изменение энтальпии хими ческой реакции равно сумме стандартных энтальпий образования про дуктов реакции за вычетом суммы стандартных энтальпий образования исходных веществ(с учетом стехиометрических коэффициентов (числа молей) участвующих в реакции веществ):
Пример 2. Пользуясь таблицей стандартных термодинамических ве- |
|
||
личин (Приложение 1) вычислите |
реакции: |
|
|
Решение.Стандартные энтальпии образования |
и |
рав- |
|
ны соответственно -822,2 и -241,84 кДж/моль (стандартные энтальпии |
|
||
образования простых веществ равны нулю). |
|
|
|
Применим следствие из закона Гесса: |
|
|
|
Ответ: 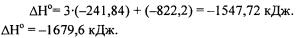
Пример 3. Рассчитайте теплоту сгорания ацетилена и количество те плоты, которое выделится при сгорании 10 дм 3 этого вещества.
Решение.Под теплотой сгорания вещества подразумевают тепловой эффект реакции окисления одного моля этого соединения. В случае орга нического соединения продуктами окисления обычно бывают СО2(г) и Н20(Г).
Реакцию сгорания ацетилена можно представить уравнением:
Используя следствие закона Гесса и стандартные энтальпии образо вания веществ (Приложение 1), определяем изменение энтальпии при протекании реакций:
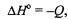 следовательно, при сгорании одного моля ацетилена выде
следовательно, при сгорании одного моля ацетилена выде
ляется 1255,6 кДж теплоты. Общее количество вещества С |
2Н 2: |
|
Количество выделившейся теплоты при сгорании 0,446 моль С |
2Н 2 со |
|
ставит: |
|
|
Ответ: 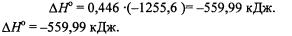
Пример 4. При сгорании алюминия массой 9 г в кислороде выдели лась теплота количеством 279,17 кДж. Составьте термохимическое урав нение реакции.
Решение:
Вычислим количество вещества сожженного алюминия:
Составим уравнение реакции горения алюминия в кислороде:
68 |
69 |

Вычислим количество теплоты, которое выделилось бы при сгорании 4 моль алюминия:
при сгорании 0,33 моль А1 выделяется 279,17 кДж теплоты,
|
а на 4 моль - |
х |
кДж |
Учитывая, что |
запишем термохимическое уравнение реак |
||
ции:
Ответ:
Направление самопроизвольного протекания реакцийНаправ.
ление, в котором самопроизвольно протекает химическая реакция, опре деляется совместным дейтвием двух факторов: во-первых, тенденцией к переходу системы в состояние с наименьшей внутренней энергией (в случае изобарных процессов - с наименьшей энтальпией) и, во-вторых, тенден цией к достижению наиболее вероятного состояния.
Мерой первой из этих тенденций для изобарных процессов служит изменение энтальпии в химической реакции: отрицательный знак указывает на уменьшение, а положительный - на возрастание энтальпии системы.
Мерой вероятности состояния системы в термодинамике принято счи тать энтропию S - величину, пропорциональную логарифму числа равно вероятных микросостояний, которыми может быть реализовано данное макросостояние. Энтропия характеризует тенденцию к беспорядку, име ет размерность Дж/(моль*К).
Энтропия S, так же как внутренняя энергия U, энтальпия Н, объем V и др., является свойством вещества, пропорциональным его количеству.
S, U, Н, V обладают аддитивными свойствами. Энтропия отражает движе ние частиц вещества и является мерой неупорядоченности системы. Она возрастает с увеличением движения частиц: при нагревании, испарении, плавлении, расширении газа, при ослаблении или разрыве связей между атомами, при переходе вещества из кристаллического состояния в жидкое
70
и из жидкого в газообразное, при растворении кристаллов; при химических взаимодействиях, приводящих к увеличению числа частиц, и прежде всего частиц в газообразном состояниии, т. п. Процессы, связанные с упорядо ченностью системы - конденсация, кристаллизация, сжатие, упрочнение связей, уменьшение числа частиц, полимеризация и т. п. - ведут к умень шению энтропии.
Энтропия является функцией состояния, то есть ее изменение зависит только от начального и конечного состояний и не зависит от пути
процесса (подчиняется закону Гесса): |
изменение энтропии системы в ре- |
|
зультате химической реакции |
равно сумме энтропии продуктов ре |
|
акции за вычетом суммы энтропии исходных веществ. |
Суммирование |
|
производят с учетом числа молей участвующих в реакции веществ.
Энтропия простого вещества, даже находящегося в кристаллическом состоянии, не равна нулю (в отличие от энтальпии), так как при темпера туре, отличной от абсолютного нуля, макросостояние кристалла может быть реализовано не единственным микросостоянием, а большим числом равновероятных микросостояний.
Пример 5. Не производя вычислений, определите знак изменения энтропии в следующих реакциях:
Решение.
В реакции
из 3 молей газов образуется 2 моля газов, следовательно, энтропия уменьшается, 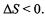
В реакциях
71

уменьшается как общее число молей веществ, участвующих в реакции, так и число молей газообразных веществ, образующихся в результате реакции, так что в обоих случаях энтропия системы уменьшается,
В реакции
общее число молей газов увеличивается с 3 моль до 5 моль, следователь |
|
||
но, энтропия увеличивается |
|
|
|
Так как энтропия растет с повышением температуры, то можно счи |
|
||
тать, что мера беспорядка |
|
|
|
Движущая сила процесса складывается из двух составляющих: |
|
||
стремления к упорядочению (Н) и стремления к беспорядку |
Об |
||
щую движущую силу процесса обозначают |
G и находят по формуле: |
|
|
где Т- абсолютная температура, |
|
|
|
G - изобарно-изотермический потенциал или энергия Гиббса. |
|
||
Для изобарно-изотермических процессов(при Р = const и Т = const) из |
|
||
менение энергии Гиббса равно: |
|
|
|
Мерой химического сродства является убыль энергии Гиббса |
|
||
которая зависит от природы вещества, его количества и от температуры. |
|
||
Энергия Гиббса является функцией состояния, поэтому подчиняется зако |
|
||
ну Гесса. |
|
|
|
Изменение энергии Гиббса |
в результате химической реакции |
||
равно сумме энергии Гиббса образования продуктов реакции за вычетом суммы энергий Гиббса образования исходных веществ; суммирование про изводят с учетом числа молей участвующих в реакции веществ:
Энергию Гиббса образования относят к 1 молю вещества и обычно выражают в кДж/моль; при этом 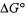 образования наиболее устойчивой модификации простого вещества принимают равной нулю.
образования наиболее устойчивой модификации простого вещества принимают равной нулю.
72
При постоянстве температуры и давления химические реакции могут самопроизвольно протекать только в таком направлении, при котором
энергия Гиббса системы уменьшается |
|
|
Если |
процесс самопроизвольно проходить не может. Чем |
|
меньше |
тем сильнее стремление к протеканию данного процесса и |
|
тем дальше он от состояния равновесия, при котором |
и |
|
В табл. 2 показана возможность (или невозможность) самопроизволь |
||
ного протекания реакции при разных сочетаниях знаков |
и |
|
|
Так, если для какой-либо реакции |
(экзотермическая реакция), |
|
а |
то при всех температурах |
это значит, что реакция может |
|
самопроизвольно протекать при любых температурах. Если |
и |
||
|
то реакция возможна при условии, что член |
в уравнении для |
|
энергии Гиббса больше по абсолютному значению, чем член |
по |
||
скольку абсолютное значение члена |
с ростом множителя Т увеличи- |
||
вается, то указанное условие будет осуществляться при достаточно низких температурах. Иначе говоря, при низких температурах наиболее вероятно самопроизвольное протекание экзотермических реакций, даже если при этом энтропия системы уменьшается.
При высоких температурах, как видно из табл. 2, наиболее вероятно протекание реакций, сопровождающихся возрастанием энтропии, в том числе и эндотермических реакций.
73

Пример 6.
Может ли в стандартных условиях самопроизвольно в прямом на правлении протекать реакция
Как скажется повышение температуры на направление протекания этой реакции? При какой температуре наступит химическое равновесие?
Решение.
Для ответа на вопрос: могут ли в стандартных условиях самопроиз вольно в прямом направлении протекать реакции, нужно найти значения энергии Гиббса при 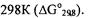
Энергию Гиббса можно расчитать через энтальпийный и энтро пийный факторы:
или как следствие закона Гесса:
Второй путь проще. В таблице 1 Приложения находим значения 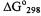 для каждого вещества и подставляем соответственно:
для каждого вещества и подставляем соответственно:
Положительный знак |
означает, что реакция в указанных усло |
|
|||
виях (стандартных) протекать не может. |
|
|
|
||
Ответ на второй вопрос задачи определяется знаком |
реакции. |
||||
В реакции число молей веществ в газообразном состоянии возрастает. |
|
||||
Отсюда следует, что |
т. е. в уравнении |
|
|
||
член - |
- отрицателен. Следовательно, с возрастанием множителя |
Т |
|||
(повышение температуры) значение |
будет уменьшаться (становиться |
|
|||
менее положительным). Это означает, что повышение температуры будет |
|
||||
благоприятствовать протеканию реакции в прямом направлении. |
|
|
|||
Температуру равновесия рассчитывают, учитывая, что в состоянии |
|
||||
равновесия |
Тогда |
|
|
|
|
Пользуясь следствием закона Гесса, рассчитаем энтальпийный и эн тропийный факторы реакции:
При нахождении температуры равновесия необходимо помнить о том, что  выражено в кДж, а
выражено в кДж, а 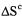 -в Дж/К:
-в Дж/К:
При температуре выше равновесной реакция будет протекать само произвольно в прямом направлении.
Задания для самостоятельной работы
126.При полном сгорании этилена (с образованием жидкой воды) выделилось 6226 кДж. Каков объем вступившего в реакцию кислорода (условия нормальные)? Ответ: 296,5 л.
127.Взятые при одинаковых условиях равные объемы водорода и ацетилена сожжены с образованием паров воды, В каком случае выделит
ся больше теплоты? Во сколько раз? |
Ответ: при сжигании С 2Н 2 выде |
|
лится теплоты в 5,2 раза больше. |
|
|
128. Вычислите энтальпию образования |
при 298 К, пользу |
|
ясь следующими данными: |
|
|
Ответ: -1113 кДж/моль.
129. Вычислите значение 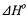 для протекающих в организме реакций превращения глюкозы:
для протекающих в организме реакций превращения глюкозы:
74 |
75 |
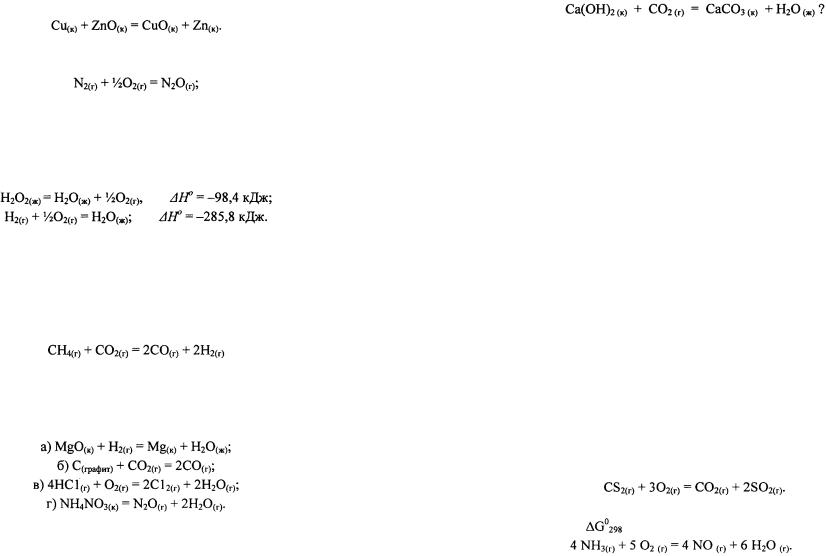
Какая из этих реакций поставляет организму больше энергии?
Ответ: а) -69,2 кДж, б) -2803 кДж.
130. Исходя из значений стандартных теплот образования и абсолют ных стандартных энтропий соответствующих веществ, докажите, что в стандартных условиях при 25 °С невозможна реакция
При какой температуре реакция будет возможна? |
Ответ:24 724 К. |
131. Согласно реакции |
|
при сжигании 100 л азота поглотилось 366,07 кДж тепла. Рассчитайте теп лоту образования оксида азота(I). Возможно ли протекание реакции в стандартных условиях? Ответ: 82 кДж/моль; не возможно.
132. Вычислите удельную энтальпию образования пероксида водоро да, пользуясь следующими термохимическими уравнениями:
Ответ: 187,4 кДж.
133. При соединении 27,2 г бора с кислородом выделилось 1563,0 кДж тепла. Определите энтальпию образования оксида. Идет ли реакция в стандартных условиях при 25 °С? Ответ: -1264,0 кДж/моль; реакция возможна.
134. При какой температуре в системе
наступит химическое равновесие?
Ответ: 965,5 К.
135. Не производя вычислений, укажите, для каких из перечисленных процессов изменение энтропии положительно:
Предположение подтвердите расчетом.
Ответ: б, в, д.
76
136. Исходя из значений стандартных теплот образования и абсолют ных стандартных энтропий соответствующих веществ, определите, воз можно ли в стандартных условиях взаимодействие гашеной извести с уг лекислым газом:
Экзоили эндотермической является данная реакция? |
Ответ: экзо |
термическая; возможно. |
|
137. Для резки и сварки металлов используют высокотемпературное пламя ацетилено-кислородных горелок. Можно ли для этих же целей ис пользовать пламя метано-кислородной горелки? Рассчитайте, в какой из двух типов горелок и во сколько раз выделится больше теплоты при сго рании одинаковых объемов ацетилена и метана, учитывая, что в результа те горения все водяные пары конденсируются и образуют жидкую фазу.
Ответ: При горении С2Н2 тепла выделяется больше в 1,9раза.
138. Термит (смесь А1 и Fe 203) используют для сварки металлических изделий, поскольку при сжигании термита выделяется большое количест во тепла. Рассчитайте минимальную массу смеси, которую нужно взять,
чтобы выделилось 665,3 кДж теплоты в процессе алюмотермии. |
Ответ: |
151,3 г. |
|
139. При восстановлении оксида железа(III) массой 80,0 г алюминием (реакция алюмотермии) выделяется 426,3 кДж тепла. Вычислите энталь пию образования оксида железа(III), если энтальпия образования оксида алюминия -1675,0 кДж/моль. Ответ: -822,4 кДж/моль.
140.Докажите, что процесс расщепления в организме человека саха розы (С12Н22О11 до углекислого газа и жидкой воды - процесс самопроиз вольный. Ответ: -5799,4 кДж.
141.Исходя из значений стандартных теплот образования и абсолют ных стандартных энтропий соответствующих веществ вычислите энергию Гиббса реакции
Сделайте вывод о возможности ее протекания. |
Ответ: -778,39 кДж. |
|
142. Определите |
реакции, протекающей по уравнению |
|
|
77 |
|

Вычисления сделайте на основании стандартных теплот образования и аб солютных стандартных энтропий соответствующих веществ. Возможна ли эта реакция при стандартных условиях? Экзоили эндотермической явля ется данная реакция? Ответ: -957,77 кДж.
143. Исходя из значений стандартных теплот образования и абсолют ных стандартных энтропий соответствующих веществ, вычислите энер гию Гиббса реакции
Сделайте вывод о возможности ее протекания Ответ: -779,31 кДж. 144. При какой температуре наступит равновесие системы
Ответ: 965,5 К.
145. Вычислите стандартную энтальпию реакции
пользуясь следующими данными:
Ответ: -197,8 кДж.
146.При сгорании 1 л ацетилена (н. у.) выделяется 56,053 кДж тепло ты. Напишите термохимическое уравнение реакции, в результате которой образуются пары воды и диоксид углерода. Вычислите теплоту образова ния ацетилена. Ответ: 226,75 кДж/моль.
147.Сколько теплоты потребовалось бы для разложения 1 кг карбо ната натрия, если известны тепловые эффекты реакций:
Ответ:3058,6 кДж.
148. Вычислите удельную энтальпию разложения пероксида водорода, пользуясь следующими термохимическими уравнениями:
Ответ: -96,7 кДж.
78
149. Восстановление Fe |
203 водородом протекает по уравнению |
|
||
Возможна ли эта реакция при стандартных условиях? При какой темпера |
|
|||
туре начинается восстановление оксида железа? |
Ответ: 696 К. |
|
||
150. Тепловой эффект какой реакции сгорания жидкого бензола с об |
||||
разованием паров воды и диоксида углерода равен -3135,58 кДж. Со |
|
|||
ставьте термохимическое уравнение этой реакции и вычислите теплоту |
|
|||
образования бензола. Ответ : +49,03 кДж. |
|
|
||
7. СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ. |
|
|||
ХИМИЧЕСКОЕ РАВНОВЕСИЕ |
|
|||
Раздел химии, изучающий механизм и скорость протекания химиче |
|
|||
ских реакций, называется |
химической кинетикой. |
|
|
|
Реакции, протекающие во всем объеме с участием веществ, находя |
|
|||
щихся в одной фазе, называются |
гомогенными.Реакции между вещества |
|||
ми, находящимися в разных фазах, называются |
гетерогенными. |
|
||
Скорость химической реакции |
измеряется количеством вещества, |
|||
вступающего в реакцию или образующегося в результате реакции в еди |
||||
ницу времени в единице объема системы (для гомогенной реакции) |
или на |
|||
единице площади поверхности раздела фаз (для гетерогенной реакции). |
|
|||
В случае гомогенного процесса, протекающего при постоянном объе |
||||
ме, скорость гомогенной химической реакции измеряется изменением |
|
|||
концентрации какого-либо из реагирующих веществ |
за единицу вре- |
|||
мени |
|
|
|
|
где знак «плюс» относится к изменению концентрации вещества, обра |
|
|||
зующегося в результате реакции |
а знак «минус» - к изменению |
|||
концентрации вещества, вступающего в реакцию |
|
|
||
Скорость реакций зависит от природы реагирующих веществ, кон центрации или парциальных давлений (для газов), температуры, давления, присутствия катализатора, от величины поверхности взаимодействия.
В тех случаях, когда для протекания реакции необходимо столкнове ние двух реагирующих частиц (молекул, атомов), зависимость скорости
79
