
3. . . .
.pdf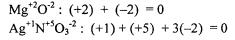
188.Какая из двух приведенных солей (карбонат натрия или силикат натрия) будет подвергаться гидролизу в большей степени? Почему? На пишите уравнение гидролиза этой соли в молекулярной и ионномолекулярной форме. Укажите реакцию среды в растворе соли.
189.Какая из двух приведенных солей (фосфат натрия или силикат натрия) будет подвергаться гидролизу в большей степени? Почему? На пишите уравнение гидролиза этой соли в молекулярной и ионномолекулярной форме. Укажите реакцию среды в растворе соли.
190.Какая из двух приведенных солей - хлорид железа(Ш) или хло рид железа(И) - будет подвергаться гидролизу в большей степени? Почему? Напишите уравнение гидролиза этой соли в молекулярной и ионномолекулярной форме. Укажите реакцию среды в растворе соли.
191.Какая из двух приведенных солей - сульфит натрия или сульфид натрия - будет подвергаться гидролизу в большей степени? Почему? На пишите уравнение гидролиза этой соли в молекулярной и ионномолекулярной форме. Укажите реакцию среды в растворе соли.
192.Можно ли с помощью индикатора различить растворы солей:
а) КС10 и КСlO |
4; б) ВаС12 и MgS0 4; в) А1С13 и Cs 2C03? Ответ дайте на ос |
|
новании реакции гидролиза. |
|
|
193. Можно ли с помощью индикатора различить растворы солей: |
||
а) СаВr 2 и КСН 3СОО; б) CdS0 4 и Ba(N0 3)2; в) Be(N0 3)2 и К 2Те? Ответ |
||
дайте на основании реакции гидролиза. |
|
|
194. Определите характер среды в растворе солей: К |
2Те, Pb(N0 3)2, |
|
Na 2Se04, NiCl |
2. Составьте молекулярные и ионно-молекулярные уравне |
|
ния гидролиза солей. |
|
|
195. Определите характер среды в растворе солей: CoBr |
2, FeS0 4, |
|
Na 3As04, KN0 |
3. Составьте молекулярные и ионно-молекулярные уравне |
|
ния гидролиза солей.
196. Какая из двух приведенных солей - сульфат цинка или сульфат кадмия - будет подвергаться гидролизу в большей степени? Почему? На пишите уравнение гидролиза этой соли в молекулярной и ионномолекулярной форме. Укажите реакцию среды в растворе соли.
197. Можно ли с помощью индикатора различить растворы солей:
a) Na 2S04 и Na 2S03; б) ZnCl 2 и КС1; в) K 2Si03 и MgS0 4? Ответ дайте на основании реакции гидролиза.
198.Запишите уравнения реакций гидролиза и укажите характер сре ды для растворов следующих солей: а) сульфита натрия; б) хлорида меди (II); в) карбоната калия; г) сульфата калия; д) хлорида железа (III).
199.Запишите уравнения реакций гидролиза и укажите характер сре ды для растворов следующих солей : а) хлорида хрома(Ш); б) цианида на трия; в) нитрата меди(И); г) ацетата калия.
200.Как будут действовать на изменение окраски лакмуса растворы
солей K 2S, KI, CuS0 4, Cd (N0 3)2? Ответ подтвердите уравнениями гидро лиза этих солей.
9| ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ.
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
В процессе протекания химических реакций может происходить сме щение или полный переход электронов от одних атомов или ионов к дру гим. В результате этого происходит изменение степени окисления атомов, входящих в состав реагирующих веществ.
Окислительно-восстановительными называют реакции,которые протекают с изменением степени окисления атомов, входящих в состав реагирующих веществ.
Степень окисленияопределяют как заряд атома элемента в соедине нии, который возник бы на данном атоме, если предположить, что все свя зи в соединении ионные.
Поэтому степень окисления представляет собой величину условную, формальную. Степень окисления обозначают арабской цифрой со знаком «+» или «-» перед цифрой. Заряд реальных ионов обозначают так же, но знак ставят после цифры.
При определении степени окисления необходимо знать следующее: 1. Любая молекула электронейтральна, поэтому сумма всех степеней
окисления атомов, входящих в состав молекулы, равна нулю.
100 |
101 |
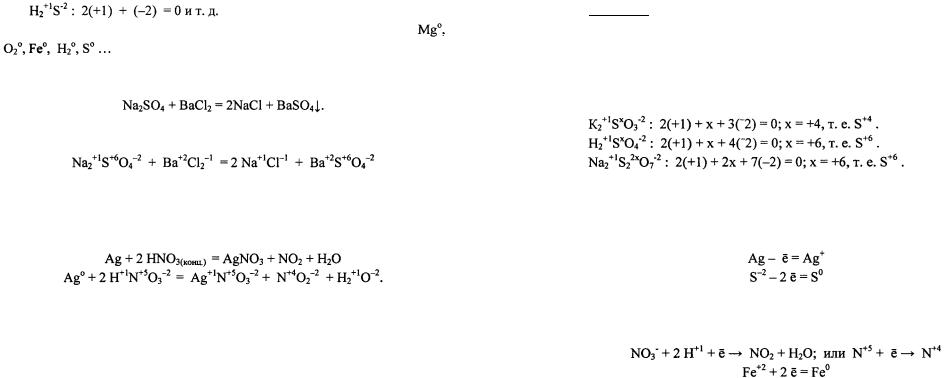
2. В простых веществах степень окисления атомов равна нулю.
Рассмотрим несколько примеров реакций. 1. В системе протекает реакция
Определим степени окисления элементов в соединениях, участвую щих в данной реакции:
Вданной реакции степень окисления каждого из атомов до и после реакции осталась без изменения, следовательно, реакция не является окислительно-восстановительной.
2. В другой системе протекает реакция
Вданной реакции произошло изменение степени окисления атомов серебра и азота, поэтому реакция относится к окислительновосстановительной реакции.
Все элементы делятся на элементы с постоянной и переменной степе нями окисления. Это зависит от электронного строения атомов и от поло жения элемента в периодической таблице. При определении степени
окисления исходят из того, что водород |
в соединениях имеет, как правило, |
|
степень окисления (+1). Исключением являются гидриды активных ме |
||
таллов (LiH, СаН 2), в которых водород имеет степень окисления (-1). Ки |
||
слород, как правило, имеет степень окисления (-2). |
Кроме пероксидов |
|
(Н 202, Ва0 2), содержащих группу -О-О-, где степень окисления кислоро |
||
да равна (-1). Во фториде кислорода (0F |
2) степень окисления кислорода |
|
равна (+2). К элементам с постоянной степенью окисления, равной номе ру группы, относятся элементы I - III групп главных подгрупп. Степень окисления других элементов определяют исходя из того, что алгебраиче ская сумма степеней окисления элементов в молекуле, должна быть равна нулю.
102
Пример 1. Определите степень окисления серы в соединениях: K |
2S03, |
H 2S04, Na 2S207.
Решение.Учитывая, что степень окисления водорода, калия и натрия равна (+1), а кислорода - (-2), составим алгебраические уравнения с уче том числа частиц в молекуле, обозначив степень окисления серы, равной «X».
Основные положения теории окислительно-восстановительных реак
ций:
1.Процесс окисления - процесс отдачи электронов атомом, молекулой или ионом. При окислении степень окисления элемента повышается.
2.Процесс восстановления - процесс присоединения электронов ато мом, молекулой или ионом. При окислении степень окисления эле мента понижается.
3. Вещества, атомы (молекулы или ионы) которых |
отдают электроны, |
|
называются восстановителями.Восстановитель (Ag, S |
-2) электроны |
|
отдает, степень окисления его повышается, а сам он при этом окис |
||
ляется. |
|
|
4. Вещества, атомы (молекулы или ионы) которых |
присоединяютэлек |
|
троны, называются окислителями. Окислитель (N0 |
3- , Fe +2) электро |
|
ны принимает, степень окисления его понижается, а сам он при этом восстанавливается.
5.Число электронов, отданных восстановителем, равно числу электронов присоединенных окислителем.
Примеры распространенных окислителей и восстановителей приве дены в таблице 3.
103
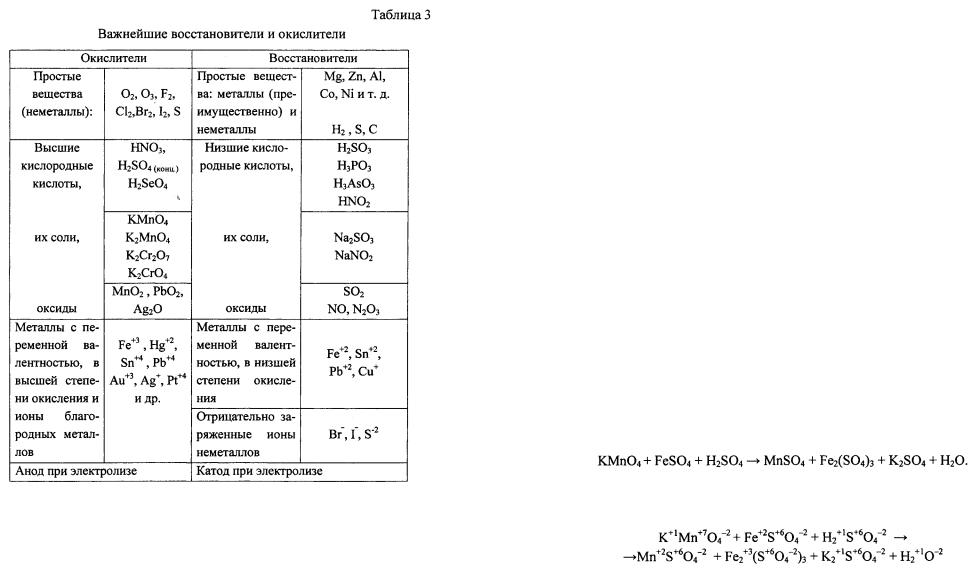
Пример 2. Какие свойства (окислительные или восстановительные) могут проявлять в окислительно-восстановительных реакциях следующие вещества: H 2S , K 2S03, H 2S04 ?
Решение.
H2S - может проявлять в окислительно-восстановительных реакциях только восстановительные свойства, так как сера в этом соединении имеет
низшую степень окисления (S |
-2). Следовательно, сера может только |
отдавать электроны и повышать степень окисления. |
|
K2SO3- в сульфите калия сера имеет промежуточную степень окисления +4 (S +4), которая может или повышаться, или понижаться в
зависимости от условий реакции. Поэтому K |
2S03 может проявлять в |
|
реакциях окислительно-восстановительную двойственность, т. е. быть и |
||
окислителем, и восстановителем. Но наиболее характерны для этого |
||
вещества восстановительные свойства. |
|
+6), поэтому |
H2S04 - содержит серу в высшей степени окисления +6 (S |
||
степень окисления серы может только понижаться, а вещество проявлять свойства окислителя. Серная кислота может проявлять окислительные свойства за счет серы только в концентрированном состоянии.
Для расстановки стехиометрических коэффициентов в окислительновосстановительных реакциях применяют метод электронного баланса и метод полуреакций. Оба метода основаны на равенстве числа отдаваемых и присоединяемых электронов молекулами восстановителя и окислителя.
Рассмотрим метод электронного баланса. В этом методе сравнивают степени окисления атомов в исходных и конечных веществах, при этом число электронов, отданных восстановителем, должно быть равно числу электронов, присоединенных окислителем.
Пример 3. Расставьте коэффициенты, используя метод электронного баланса, укажите окислитель и восстановитель в реакции, протекающей по схеме:
Решение.
Определим степени окисления атомов всех элементов в данной реакции:
Степень окисления изменяется у марганца и железа. Степень окисления марганца понижается, он присоединяет электроны, и при этом восстанавливается, а перманганат калия (КМn0 4) является окислителем.
104 |
105 |

Степень окисления железа повышается, железо отдает электроны, следовательно, происходит процесс окисления. Сульфат железа(П) - FeS04 - играет роль восстановителя в данной реакции.
Составим схемы электронных переходов для марганца и железа. Процесс восстановления:
Процесс окисления:
Коэффициент «2» можно ввести сразу же, так как в правой части уравнения образуется соединение с двумя ионами трехвалентного железа. Либо в дальнейшем полученные коэффициенты придется удваивать, чтобы не было дробных коэффициентов в уравнении реакции.
Для того чтобы уравнять число отданных и присоединенных электронов, находим наименьшее кратное для чисел 2 и 5. Оно равно 10, следовательно, основные коэффициенты будут равны 2 и 5. Составим схему электронного баланса:
Суммарное уравнение получено сложением процессов окисления и восстановления с учетом баланса электронов.
Перенесем основные коэффициенты (2 и 5) в уравнение реакции:
Остальные коэффициенты подбираем таким образом, чтобы число атомов каждого элемента в левой и правой частях уравнения было одинаково. Сначала приводим в соответствие количество катионов (ионов калия), а затем кислотных остатков (S0 42- ), водорода и проверяем по балансу кислорода:
Задания для самостоятельной работы
201. Какие реакции называются окислительно-восстановительными? Определите, являются ли окислительно-восстановительными указанные ниже реакции. Расставьте коэффициенты в уравнениях реакций. Если
106
реакция окислительно-восстановительная, то расставьте коэффициенты на основании электронных уравнений.
202.Какие реакции называются окислительно-восстановительными? Определите, являются ли окислительно-восстановительными указанные ниже реакции. Расставьте коэффициенты в уравнениях реакций. Если реакция окислительно-восстановительная, то расставьте коэффициенты на основании электронных уравнений.
203.Какие реакции называются окислительно-восстановительными? Определите, являются ли окислительно-восстановительными указанные ниже реакции. Расставьте коэффициенты в уравнениях реакций. Если ре акция окислительно-восстановительная, то расставьте коэффициенты на основании электронных уравнений.
204.Что называется степенью окисления элемента? Какие из приве
денных веществ - KN0 2 , Сu , Na 2Cr 207 - могут проявлять: а) окислитель ные свойства; б) восстановительные свойства; в) окислительновосстановительную двойственность? Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции:
205. Что называется степенью окисления элемента? Какие из приведенных веществ - H 2S , NaN0 2 , KMn0 4 - могут проявлять: а) окислительные свойства; б) восстановительные свойства; в) окислительно-восстановительную двойственность? Почему?
107

На основании электронных уравнений расставьте коэффициенты в уравнении реакции:
206. Что называется степенью окисления элемента? Какие из приведенных веществ - Мп0 2 , NaBr , HNO3 - могут проявлять: а) окислительные свойства; б) восстановительные свойства; в) окислительно-восстановительную двойственность? Почему? На
основании электронных уравнений расставьте коэффициенты в уравнении реакции:
207. В чем заключается сущность процесса окисления и восстановления? Укажите, какой процесс - окисление или восстановление - происходит при превращениях: 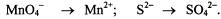 На основании электронных уравнений расставьте коэффициенты в уравнении реакции:
На основании электронных уравнений расставьте коэффициенты в уравнении реакции:
208. В чем заключается сущность процесса окисления и восстановления? Укажите, какой процесс - окисление или восстановление
- происходит при превращениях: 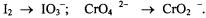 На основании электронных уравнений расставьте коэффициенты в уравнении реакции:
На основании электронных уравнений расставьте коэффициенты в уравнении реакции:
209. В чем заключается сущность процесса окисления и восстановления? Укажите, какой процесс - окисление или восстановление - происходит при превращениях: 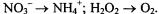 На основании электронных уравнений расставьте коэффициенты в уравнении реакции:
На основании электронных уравнений расставьте коэффициенты в уравнении реакции:
210. В чем заключается сущность процесса окисления и восстановления? Укажите, какой процесс - окисление или восстановление
108
- происходит при превращениях: |
На |
основании электронных уравнений расставьте коэффициенты в |
|
уравнениях реакций: |
|
211.На основании электронных уравнений расставьте коэффициенты
вуравнениях реакций:
Для каждой реакции укажите, какое вещество является окислителем, какое - восстановителем; какое вещество окисляется, какое - восстанав ливается?
212.На основании электронных уравнений расставьте коэффициенты
вуравнениях реакций:
Для каждой реакции укажите, какое вещество является окислителем, какое - восстановителем; какое вещество окисляется, какое - восстанав ливается?
213.На основании электронных уравнений расставьте коэффициенты
вуравнениях реакций:
Для каждой реакции укажите, какое вещество является окислителем, какое - восстановителем; какое вещество окисляется, какое - восстанав ливается?
214. Исходя из степени окисления марганца в соединениях: Мп0 2, MnS0 4, КМnО4, определите, какое из них может быть окислителем, вос становителем, а какое может проявлять как окислительные , так и восста новительные свойства. Почему? На основании электронных уравнений расставьте коэффициенты в уравнениях:
109

215. Исходя из степени окисления хрома в соединениях: Cr |
2(S0 4)3, |
К2СrO4, определите, какое из них может быть только окислителем, только восстановителем. Почему? На основании электронных уравнений рас ставьте коэффициенты в уравнениях:
216. Исходя из степени окисления брома в соединениях: NaBrO, NaBr, определите, какое из них может быть окислителем, а какое - вос становителем. Почему? На основании электронных уравнений расставьте коэффициенты в уравнениях:
217. Исходя из степени окисления азота в соединениях: HN0 |
3, |
NaNO2, определите, какое из них может быть окислителем, а какое - вос |
|
становителем. Почему? На основании электронных уравнений расставьте |
|
коэффициенты в уравнениях: |
|
218. Исходя из степени окисления хрома в соединениях: Na |
2Cr 207, |
СrСl3, определите, какое из них может быть окислителем, а какое - вос становителем. Почему? На основании электронных уравнений расставьте коэффициенты в уравнениях:
219. Исходя из степени окисления кислорода в |
Н2О2, объясните, по |
|
чему пероксид водорода может проявлять как окислительные, так и вос |
||
становительные свойства? На основании электронных уравнений рас |
|
|
ставьте коэффициенты в уравнениях: |
|
|
220. Исходя из степени окисления йода и серы в соединениях |
H2SO3 и |
|
HI, определите, можно ли приготовить раствор, содержащий одновремен-
но эти кислоты или растворы солей этих кислот? Почему? На основании электронных уравнений расставьте коэффициенты в уравнениях:
221.Чему равны высшая и низшая степени окисления азота? Почему? На основании электронных уравнений расставьте коэффициенты в урав нениях:
222.Чему равны высшая и низшая степени окисления хлора? Почему? Какие промежуточные степени окисления устойчивы у хлора? На основа нии электронных уравнений расставьте коэффициенты в уравнениях:
223.Чему равны высшая и низшая степени окисления серы? Почему? Какая промежуточная степень окисления устойчива у серы? На основании электронных уравнений расставьте коэффициенты в уравнениях:
224.Чему равны высшая и низшая степени окисления фосфора? По чему? На основании электронных уравнений расставьте коэффициенты в уравнениях:
225.Чему равны высшая и низшая степени окисления свинца? Поче му? На основании электронных уравнений расставьте коэффициенты в уравнениях:
но |
111 |
10.ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ. ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ
Электрохимическиминазываются процессы прямого превращения химической энергии в электрическую энергию и обратно.
При погружении металла в воду (или в раствор соли данного металла) под действием полярных молекул растворителя ионы металла частично отрываются от поверхности металла и в гидратированном состоянии пе реходят в раствор, оставляя в металле валентные электроны. Металл за ряжается отрицательно, а раствор - положительно.
По мере перехода ионов металла в раствор отрицательный заряд ме талла увеличивается, положительный заряд раствора - растет. Поэтому все чаще ионы металла притягиваются обратно, т. е. в данной системе ус танавливается подвижное равновесие
На границе металл - раствор возникает двойной электрический слой зарядов: один - на металле, другой в виде ионов - у поверхности электро да. Заряд на электроде может возникнуть и за счет внешнего источника тока. Тогда на одном электроде образуется избыток отрицательных заря дов, и около него располагаются катионы раствора, а на другом электроде - образуется избыток положительных зарядов, и около него располагают ся анионы. В любом случае на границе между электродом и раствором об разуется двойной электрический слой. Схематически металлический элек трод можно записать таким образом: 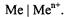
Разность потенциалов, возникающую между металлом и раствором при погружении металла в раствор, называют электродным потенциа
лом и обозначают |
или Е. |
Потенциал, установившийся в условиях равновесия электродной ре |
|
акции, называется |
равновесным потенциалом - |
Величина электродного потенциала количественно характеризует способность металла отдавать электроны, т. е. его восстановительные
112
свойства. Потенциал каждого электрода зависит от природы металла, кон центрации его ионов в растворе и от температуры.
Если металл опустить в раствор его соли с |
моль/л (или |
|
приближенно |
= 1 моль/л), то электродный потенциал будет по |
|
стоянной величиной при данной температуре и давлении. |
= const; если |
|
= 1 моль/л и Т, Р = const). Такой потенциал называется |
нормаль |
|
ным, или стандартным, электродным потенциалом - |
|
|
Зависимость |
от концентрации металла в растворе, температуры и |
|
природы металла выражается уравнением Нернста:
где 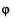 - электродный потенциал при данной концентрации, равновесный потенциал;
- электродный потенциал при данной концентрации, равновесный потенциал; 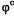 - стандартный электродный потенциал; R - газовая посто янная -8,31 Дж/(моль*К); Т - абсолютная температура; n - количество
- стандартный электродный потенциал; R - газовая посто янная -8,31 Дж/(моль*К); Т - абсолютная температура; n - количество
электронов, участвующих в элементарном процесс (валентные электро ны); F - число Фарадея - 96 500 Кл;  - активность ионов
- активность ионов
Для приближенных расчетов вместо активностей можно пользоваться концентрацией ионов металла:
Абсолютное значение электродного потенциала экспериментально определить невозможно. Однако можно определить разность электродных потенциалов. Поэтому для характеристики электродных процессов поль зуются относительными значениями электродных потенциалов. Для этого находят разность потенциалов измеряемого электрода и электрода срав нения, потенциал которого условно принимают равным нулю.
Электродный потенциал численно равен ЭДС (Е) между измеряемым электродом и электродом сравнения.
Электроды с постоянным устойчивым потенциалом называются стандартными,или электродами сравнения. В качестве электрода срав нения используют водородный электрод, который схематически можно
113

записать таким образом: |
В системе |
устанавливается |
равновесие: |
|
|
Разность потенциалов, возникающую в данной системе, принимают равной нулю. Хотя абсолютное значение потенциала водородного элек трода неизвестно. Поэтому определение потенциала любого электрода с помощью стандартно водородного электрода имеет относительный харак тер.
Потенциал этого газового электрода |
зависит от концентра |
ции ионов водорода и определяется выражением: |
|
Если соединить водородный электрод и электрод, потенциал которого необходимо измерить, то получится система, которая называется гальва ническим элементом (ГЭ):
Разность потенциалов этого гальванического элемента будет опреде лять величину электродного потенциала измеряемого электрода
Если расположить металлы в порядке возрастания алгебраических ве
личин их стандартных потенциалов, то получится ряд, называемый |
рядом |
стандартных потенциалов, или рядом напряжений металлов, |
или элек |
трохимический ряд металлов. |
|
Электрохимический ряд металлов характеризует химические свойства
металлов 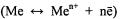 в окислительно-восстановительных реакциях, протекающих в водных растворах.
в окислительно-восстановительных реакциях, протекающих в водных растворах.
1. Величина 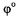 - количественно характеризует восстановительную способность атомов металла и окислительную способность их ионов. Чем левее стоит металл в ряду (чем меньше
- количественно характеризует восстановительную способность атомов металла и окислительную способность их ионов. Чем левее стоит металл в ряду (чем меньше 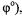 тем легче он окисляется, т. е. является более сильным восстановителем:
тем легче он окисляется, т. е. является более сильным восстановителем:
Чем правее (т. е. чем больше  - тем легче его ионы присоединяют электроны, т. е. являются более сильными окислителями:
- тем легче его ионы присоединяют электроны, т. е. являются более сильными окислителями:
2.Металлы, стоящие в ряду левее водорода, вытесняют водород из разбавленных кислот (анионы которых не проявляют окислительных свойств), правее водорода не вытесняют его из кислот. Наиболее активные металлы вытесняют водород из воды, амфотерные металлы - из растворов щелочей.
3.Чем дальше расположены металлы друг от друга в электрохимиче ском ряду, тем большую ЭДС будет иметь построенный из них гальвани ческий элемент.
Гальванический элемент- о устройство, с помощью которого хи мическая энергия окислительно-восстановительного процесса может быть преобразована в электрическую энергию. Гальванический элемент состо ит из двух электродов, соединенных между собой проводником первого рода (металлическим проводником) и второго рода (электролитическим ключом).
Если кусочек цинка бросить в пробирку с раствором сульфата меди,
то цинковая гранула покроется налетом меди, но тока при этом мы не |
ПО |
ЛУЧИМ: |
|
Эту реакцию мы можем провести и другим путем. Для этого необхо димо составить гальванический элемент цинк - медь. Схема гальваниче ского элемента записывается следующим образом:
-граница между электродом и раствором;
-граница между растворами.
Для гальванического элемента цинк - медь схему можно записать следующим образом:
Электрод, на котором протекает процесс окисления металла, называ ется анодом (А):
114 |
115 |

Электрод, на котором протекает процесс восстановления, называется
катодом (К):
Избыток сульфат-ионов из раствора CuS0 |
4 по электролитическому |
ключу переходит в раствор ZnS0 4: |
|
Электрический ток в гальваническом элементе возникает за счет окислительно-восстановительной реакции, протекающей так, что окисли тельные и восстановительные процессы оказываются пространственно разделенными, на положительном электроде протекает процесс восста новления, отрицательном электроде - процесс окисления.
Максимальная разность потенциалов электродов, которая может быть получена при работе ГЭ, называется электродвижущей силой элемента (ЭДС).
ЭДС равна разности равновесных потенциалов катода и анода гальва нического элемента:
Если активность ионов |
(или молярная |
концентрация ионов |
|
При других концентрациях электролитов равновесный электродный потенциал  вычисляется по уравнению Нернста.
вычисляется по уравнению Нернста.
Например, если 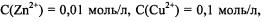 чему бу дет равна ЭДС?
чему бу дет равна ЭДС?
Сначала по уравнению Нернста рассчитывают потенциалы анода и катода:
А затем ЭДС:
Максимальная электрическая работа гальванического элемента при превращении 1 моль вещества равна:
Максимальная полезная работа, которую может совершить система при протекании реакции при Р = const, равна энергии Гиббса:
Так как
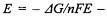 это уравнение превращения химической энергии в электрическую и обратно.
это уравнение превращения химической энергии в электрическую и обратно.
Для гальванического элемента Zn - Сu в стандартных условиях
Гальванические элементы могут быть получены не только из двух различных электродов, но и из двух одинаковых электродов, если они по мещены в растворы с различной концентрацией.
Такие гальванические элементы получили название концентрацион ных гальванических элементов. Работают они за счет выравнивания кон центрации растворов.
Электрод, помещенный в более разбавленный раствор, выполняет роль анода, в более концентрированный - роль катода.
Главным критерием возможности самопроизвольного протекания окислительно-восстановительной реакции в данном направлении может служить ЭДС.
Так для реакции
116 |
117 |
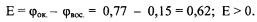
Следовательно, такая реакция может протекать в прямом направле нии в стандартных условиях.
Задания для самостоятельной работы
226. Уменьшится, увеличится или останется без изменения масса кадмиевой пластинки при погружении ее в раствор: а) соли СаС1 2, б) соли CuSO4? Почему? Составьте молекулярные и электронные уравнения про текающих реакций. Каким образом химическую энергию протекающей реакции можно превратить в электрическую энергию? Составьте схему гальванического элемента и рассчитайте стандартную ЭДС данного галь ванического элемента. Ответ: 0,74 В.
227.Уменьшится, увеличится или останется без изменения масса цинковой пластинки при погружении ее в раствор: а) соли AgNO3, б) соли MgCl 2,? Почему? Составьте молекулярные и электронные уравнения про текающих реакций. Каким образом химическую энергию протекающей реакции можно превратить в электрическую энергию? Составьте схему гальванического элемента и рассчитайте стандартную ЭДС данного галь ванического элемента. Ответ: 1,56 В.
228.Что такое электродный потенциал? От каких факторов он зави сит? Электродный потенциал марганца в растворе его соли равен -1,27 В. Вычислите активность (концентрацию) ионов марганца в этом растворе. Запишите электрохимическую схему гальванического элемента, ЭДС ко торого равняется стандартному электродному потенциалу магния. Запи
шите уравнения анодного и катодного процессов. Ответ: 0,001 моль/л. 229. Что такое электродный потенциал? От каких факторов зависит
величина электродного потенциала? Вычислите величину равновесного потенциала никеля в растворе NiCl 2 с молярной концентрацией 0,0001 и 0,1 моль/л. Будет ли работать гальванический элемент, составленный из двух никелевых электродов? Если будет, то составьте схему такого галь
ванического элемента и рассчитайте его ЭДС. |
Ответ: -0,37 В; -0,28 В; |
0,09 В. |
|
230. Что такое электродный потенциал? От каких факторов он зави сит? Равновесный электродный потенциал серебряного электрода в рас-
118
творе его соли при 25 °С равен 0,68 B. Вычислите активность (концентра цию) ионов этого металла в растворе. Запишите электрохимическую схе му гальванического элемента, ЭДС которого равняется стандартному электродному потенциалу серебра. Запишите уравнения анодного и ка тодного процессов. Ответ: 0,01 моль/л.
231.Что такое электродный потенциал? От каких факторов он зави сит? Равновесный электродный потенциал кадмиевого электрода в рас творе его соли при 25 °С равен -0,52 В. Вычислите активность (концен трацию) ионов этого металла в растворе. Запишите электрохимическую схему гальванического элемента, ЭДС которого равняется стандартному электродному потенциалу кадмия. Запишите уравнения анодного и катод ного процессов. Ответ: 0,0001 моль/л.
232.Что такое электродный потенциал? От каких факторов он зави
сит? При какой молярной концентрации ионов Zn 2+ потенциал цинкового электрода будет на 0,015 В меньше его стандартного электродного потен циала? Запишите электрохимическую схему гальванического элемента, ЭДС которого равняется стандартному электродному потенциалу цинка.
Запишите уравнения анодного и катодного процессов. |
Ответ: |
0,31 моль/л. |
|
233. Какие электроды называются электродами сравнения? От каких факторов будет зависеть потенциал водородного электрода? Рассчитайте потенциал водородного электрода при стандартном давлении водорода и при а) С(Н + ) = 10 -11 моль/л; б) рН = 4. Давление водорода равно 101,3 кПа. Можно ли составить гальванический элемент из двух водородных элек тродов и получить ток. Запишите схему такого гальванического элемента
и вычислите ЭДС (используя условия а и б). |
Ответ: -0,649 В; -0,236 В; |
0,413 В. |
|
234. Какие электроды называются электродами сравнения? От каких факторов будет зависеть потенциал водородного электрода? Рассчитайте потенциал водородного электрода при стандартном давлении водорода и при а) С(Н + ) = 10 -4 моль/л; б) рН = 10. Давление водорода равно 101,3 кПа. Можно ли составить гальванический элемент из двух водородных элек тродов и получить ток. Запишите схему такого гальванического элемента
119
