
3. . . .
.pdf
275. Серебро не вытесняет водород из разбавленных кислот (НС1, H 2S04, СН3СООН и т. д.). Почему? Однако, если к этому металлу, погру женному в раствор, например, соляной кислоты, прикоснуться палочкой из цинка, то на серебре начинается выделение водорода. Объясните это явление. Составьте уравнения анодного и катодного процессов коррозии. Какая реакция при этом происходит?
12. ЭЛЕКТРОЛИЗ
Электролизом называются химические процессы восстановления и окисления, протекающие на электродах, под действием электрического тока.
При электролизе происходит превращение электрической энергии в химическую энергию. Электролитическая ячейка состоит из ванны с рас твором электролита и двух электродов, опущенных в электролит.
Электрод, подключенный к отрицательному полюсу источника тока, называется катодом. Катод имеет избыток электронов и на нем протекает процесс восстановления. Электрод, подключенный к положительному по люсу источника тока, называется анодом,на нем протекает процесс окис ления. Оба процесса протекают одновременно, и невозможны один без другого, но они пространственно разделены.
Взависимости от материала электрода (анода) различают электролиз
синертными и активными электродами.
Инертные электроды (нерастворимые электроды) не имеют собст венных ионов в растворе, при электролизе они не разрушаются и служат лишь для передачи электронов. Обычно они изготавливаются из графита, платины, иридия, диоксида свинца и некоторых других веществ. В опре деленных условиях нерастворимыми становятся аноды из золота, железа и никеля (в щелочном растворе), свинца (в серной кислоте) и других метал лов.
Активный электрод (анод) сам может окисляться в процессе элек тролиза.
Процессы, протекающие на электродах.
На катоде протекает процесс восстановления, т. е. процесс присое динения электронов окислителем. Поэтому на катоде первым разряжается
тот ион, который характеризуется наиболее высокой величиной электрод ного потенциала, т. е. самый сильный окислитель.
В растворе или в расплаве к катоду движутся положительно заряжен ные ионы, независимо от материала катода на нем всегда происходит раз рядка ионов с выделением каких-либо веществ.
Катод:  На катоде первым разряжается самый сильный окислитель, т. е. сис
На катоде первым разряжается самый сильный окислитель, т. е. сис
тема, имеющая самое высокое значение электродного потенциала. Характер катодного процесса при электролизе водных растворов со
лей определяется, прежде всего, положением соответствующего металла в ряду напряжений, т. е. от относительных значений электродных потен циалов. В ряде случаев большое значение имеет концентрация ионов ме талла в растворе, рН раствора и другие условия электролиза.
Потенциал восстановления ионов водорода зависит от концентрации ионов водорода, т. е. от рН раствора:
Для нейтральных растворов рН = 7, и, следовательно,
Поэтому при электролизе водных растворов солей порядок разрядки ионов будет следующий:
а) при электролизе водных растворов соединений щелочных и щелоч ноземельных металлов, а также магния и алюминия, электродный потен циал которых меньше -0,83 В, восстанавливаются не ионы металла, а мо лекулы воды с выделением водорода.
В ряду напряжений эти металлы находятся от начала ряда и до алю миния включительно;
б) при электролизе водных растворов соединений металлов со сред ними значениями нормальных электродных потенциалов, стоящих в ряду напряжений между алюминием и водородом, одновременно могут восста навливаться катионы металла и молекулы воды.
140 |
141 |
|

Причем, чем выше положительный потенциал металла, тем большая доля электрического тока пойдет на восстановление его ионов;
в) при электролизе водных растворов соединений металлов с положи тельными значениями нормальных электродных потенциалов, стоящих в ряду напряжений правее водорода, восстанавливаются, как правило, только их ионы.
Материал катода не влияет на процесс электролиза.
протекает процесс окисления, т. е. отдача электронов вос становителем. В растворе к аноду движутся анионы, отрицательно заря женные ионы и происходит процесс окисления, процесс отдачи электро нов восстановителем.
На аноде первым разряжается самый сильный восстановитель, т. е. система, имеющая самое низкое значение электродного потенциала.
Анодный процесс зависит от материала анода, так как анод в ходе электролиза может окисляться. В связи с этим различают электролиз с инертным анодом и активным анодом. Инертный анод - материал, кото
рого не претерпевает окисления в ходе электролиза. Активный анод - ма териал, которого может окисляться в ходе электролиза.
На аноде при электролизе водных растворов могут протекать сле дующие процессы:
1)окисление (растворение) металла:
2)окисление воды:
3) окисление других веществ (как правило, анионов), присутствую щих в растворе:
При электролизе с инертным анодом (нерастворимым анодом) на электроде может окисляться вода или ионы - восстановители, присутст вующие в растворе (процесс 2 или 3).
При электролизе с активным (растворимым) анодом происходит пре имущественно процесс растворения металла (процесс 1).
В нейтральных и кислых растворах на аноде может протекать процесс выделения кислорода из воды:
стандартный окислительно-восстановительный потенциал этого процесса равен+1,23 В.
Для щелочных растворов, с большим содержанием ионов ОН - , реак ция окисления на аноде идет по уравнению:
Равновесный потенциал кислородного электрода зависит от рН, в нейтральной среде он будет иметь значение:
В щелочной среде стандартный потенциал кислородного электрода равен:
|
Однако практически процесс выделения кислорода из воды протекает |
|
при более высоком потенциале, равном 1,6-1,7 В. |
|
|
|
Если потенциал аниона меньше чем 1,6-1,7 В |
то |
на аноде разряжается анион. |
|
|
|
Поэтому первыми на аноде, как правило, разряжаются анионы бески |
|
слородных кислот |
|
|
|
На аноде происходит разрядка воды с выделением кислорода, если |
|
анион образован элементом в высшей степени окисления |
|
|
|
и т. д.) и не может окисляться, либо может окислять |
|
ся |
но для этого требуется довольно высокое значение элек |
|
тродного потенциала. То есть если потенциал аниона больше чем |
|
|
142 |
143 |

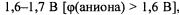 то в этих случаях на аноде происходит раз
то в этих случаях на аноде происходит раз
рядка воды с выделением кислорода.
Рассмотрим примеры процессов, протекающих при электролизе.
Количественные законы электролиза |
|
С количественной стороны процессы электролиза подчиняются |
зако |
нам Фарадея. |
|
144
Первый закон. Массы веществ, выделившихся на электродах при электролизе, прямо пропорциональны количеству электричества, про шедшего через раствор электролита.
где Q - количество прошедшего через раствор электричества;
к - коэффициент пропорциональности или электрохимический эквивалент вещества.
где I - сила тока, А;
t - время электролиза, с или ч.
Второй закон. При электролизе различных химических соединений равные количества электричества выделяют на электродах массы ве ществ, прямо пропорциональные молярным массам эквивалентов этих веществ.
Или одинаковые количества электричества выделяют на электродах эквивалентные массы различных веществ.
Из законов Фарадея вытекает уравнение:
где F - постоянная Фарадея, 96 500 А/с или 26,8 А/ч.
На практике при электролизе во многих случаях выделяется на элек тродах вещества меньше, чем следовало бы по закону Фарадея. Это объ ясняется тем, что наряду с основными электродными процессами окисле ния и восстановления всегда идут побочные или параллельные процессы. Например, реакции взаимодействия образовавшегося вещества с материа лом электрода или электролитом, выделение водорода совместно с метал лом и другие процессы, на которые тоже расходуется электричество. Для характеристики этого дополнительного расхода электричества введено понятие выход по току:
145

Пример 1. Через последовательно включенные в цепь постоянного тока растворы AgN0 3 и CuS0 4 пропускали ток силой 5 А в течение 10 мин. Какая масса каждого металлы выделится при этом на катодах? Какой объем газа выделится на анодах?
Решение.
Запишем процессы на электродах:
Пример 2. При электролизе раствора, содержащего 76 г FeS0 |
4 , до |
полного разложения соли на катоде выделилось железо массой 13,44 г, а |
|
на аноде - кислород объемом 4,48 л (н. у.), найдите выход по току для же |
|
леза и кислорода. |
|
По закону эквивалентов:
146
Задания для самостоятельной работы
276.Влияет ли материал электрода на процесс электролиза? Какие электроды называются инертными и активными? Напишите уравнения электродных процессов, протекающих при электролизе водных растворов А1С13 и КОН с инертными электродами.
277.Влияет ли материал электрода на процесс электролиза? Какие электроды называются инертными и активными? Напишите уравнения электродных процессов, протекающих при электролизе водных растворов СаВr2 и Bi 2(S04)3 с инертными электродами.
278.Влияет ли материал анода на процесс электролиза? Что значит «инертный» и «активный» анод? Составьте схему электролиза водного
раствора соли NiS0 4, если: а) анод - никелевый, б) анод - инертный (угольный). Рассчитайте массу вещества, выделившегося на катоде и ано де в случае « б» при прохождении тока 26,8 А в течение 10 часов.
Ответ: 289 г; 80 г.
279. Составьте уравнения реакций, происходящих при электролизе: а) раствора бромида натрия; б) расплава этого же вещества. Рассчитайте массу вещества, выделившегося на катоде в случаях а и б при прохожде нии тока 13,4 А в течение 2 часов. Ответ: 1 г; 23 г.
280. Вычислите массу веществ, выделившихся на инертных электро дах при пропускании тока силой 5А через раствор хлорида магния в тече ние 50 минут. Если в результате электролиза на электродах выделяются газы, то вычислите объем газа при нормальных условиях. Составьте урав
нения реакций, происходящих при электролизе. |
Ответ: 0,15 г; 5,52 г; |
1,74 л; 1,74 л. |
|
281. Вычислите массу веществ, выделившихся на инертных электро дах при пропускании тока силой 6 А через раствор нитрата серебра в те чение 60 минут. Если в результате электролиза на электродах выделяются газы, то вычислите объем газа при нормальных условиях. Составьте урав
нения реакций, происходящих при электролизе. |
Ответ: 24,16 г; 1,79 г; |
1,25 л. |
|
282. Вычислите массу веществ, выделившихся на инертных электро дах при пропускании тока силой 10 А через раствор хлорида кальция в те-
147
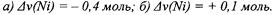
чение времени 30 минут. Если в результате электролиза на электродах вы деляются газы, то вычислите объем газа при нормальных условиях. Со ставьте уравнения реакций, происходящих при электролизе.
Ответ: 0,19 г; 6,62 г; 2,09 л; 2,09 л.
283. Вычислите массу веществ, выделившихся на инертных электро дах при пропускании тока силой 10А через раствор нитрата меди(П) в те чение 45 минут. Если в результате электролиза на электродах выделяются газы, то вычислите объем газа при нормальных условиях. Составьте урав нения реакций, происходящих при электролизе. Ответ: 8,88г; 2,24 г; 1,57л.
284.При электролизе водного раствора хлорида натрия с инертными электродами на катоде выделился водород, объем которого при нормаль ных условиях равен 2,24 л. Какой объем вещества выделился на аноде?
Какова масса этого вещества? Составьте уравнения реакций, происходя щих при электролизе. Ответ: 2,24 л; 7,1 г.
285.Ток последовательно проходит через ряд электролизеров, в кото
рых содержатся водные растворы электролитов Ва(NOз)2 - PdCl |
2. Какие |
|
массы веществ выделятся на катодах, если известно, что у анода послед |
||
него электролизера выделилось 1,12 л хлора (0°С и 101,3 кПа). Составьте |
||
уравнения реакций, происходящих при электролизе. |
Ответ: 0,1 г; 5,32 г. |
|
286. Ток последовательно проходит через ряд электролизеров, в кото |
||
рых содержатся водные растворы электролитов Ni |
(N03 )2 - КС1. Какие |
|
массы веществ выделятся на катодах, если известно, что у анода послед |
||
него электролизера выделилось 2,24 л хлора (0°С и 101,3 кПа). Составьте |
||
уравнения реакций, происходящих при электролизе. |
Ответ: 5,87 г; 0,2 г. |
|
287.При прохождении через раствор соли двухвалентного металла X тока силой 3,28 А в течение 30 минут на катоде выделился металл массой 2 г. Определите молярную массу эквивалента этого металла. Какой это металл? Составьте уравнения реакций, происходящих при электролизе.
Ответ: 32,7 г/моль.
288.При прохождении через раствор соли трехвалентного металла X тока силой 1,54 А в течение 30 минут на катоде выделился металл массой 2 г. Определите молярную массу эквивалента этого металла. Какой это
148
металл? Составьте уравнения реакций, происходящих при электролизе.
Ответ: 69,6 г/моль.
289. При какой силе тока из водного раствора Н |
3Р04 можно выделить |
|||
кислород объемом 3,8 л в течение 3 часов? Газ измерен при температуре |
||||
17°С и давлении 100 кПа. Напишите уравнения электродных процессов, |
||||
протекающих на инертных электродах. |
Ответ: 2,81 А. |
|
||
290. При какой силе тока можно из водного раствора Co(N0 |
3)2 выде |
|||
лить кислород объемом 7,5 л в течение 3 часов? Газ измерен при темпера |
||||
туре 17°С и давлении 100 кПа. Напишите уравнения электродных процес |
||||
сов, протекающих на инертных электродах. |
Ответ: 5,56 А. |
|
||
291. Электролиз раствора соли Hg(N0 |
|
3)2 проводили с нерастворимым |
||
анодом в течение 3,2 часов. В результате электролиза на аноде выделился газ объемом 3,13 л, измеренный при нормальных условиях. Выход по току газа считать равным 100%. Вычислите силу тока и массу осажденного ме талла при выходе его по току 92%. Составьте уравнения реакций, проис ходящих при электролизе. Ответ: 4,68 А; 51,67 г.
292. При электролизе водного раствора NaOH с инертными электро дами на катоде выделился водород, объем которого при нормальных ус ловиях 0,224 л. Какой объем вещества выделился на аноде? Составьте
уравнения реакций, происходящих при электролизе. |
Ответ: 0,112 л. |
|
293. Электролиз раствора соли SnS0 |
4 проводили с нерастворимым |
|
анодом в течение 0,6 часа. В результате электролиза на аноде выделился газ объемом 3,36 л, измеренный при нормальных условиях. Выход по току газа считать равным 100%. Вычислите силу тока и массу осажденного ме
талла при выходе его по току 60%. |
Ответ: 26,8 А; 21,37 г. |
294. Напишите уравнения реакций, протекающих на электродах при |
|
электролизе водного раствора NiCl |
2: а) с графитовым анодом; б) с актив |
ным анодом. Если через раствор прошло 48 250 Кл электричества, то как изменилось количество металла (число моль эквивалентов этого металла) в растворе в обоих случаях при выходе по току металла на катоде 80%, на
аноде -100%. Ответ: |
|
295. При какой силе тока можно из водного раствора MgS0 |
4 выделить |
кислород объемом, равным 10 л, в течение 3 часов? Газ измерен при тем-
149
пературе 17 °С и давлении 100 кПа. Напишите уравнения электродных |
|
||
процессов, протекающих на инертных электродах. |
Ответ: 14,84 А. |
|
|
296. При какой силе тока можно из водного раствора Са(NO3 |
)2 выде |
||
лить кислород объемом, равным 6 л, в течение 2 часов. Газ измерен при |
|||
температуре 17 °С и давлении 100 кПа. Напишите уравнения электродных |
|||
процессов, протекающих на инертных электродах. |
Ответ: 13,35 А. |
|
|
297. Рассчитайте выход по току металла, если при электролизе рас |
|||
твора нитрата свинца в течение 1 часа на катоде выделился металл мас |
|||
сой, равной 33,67 граммов. Сила тока при этом была равна 13,4 А. Со |
|
||
ставьте уравнения реакций, происходящих при электролизе. |
Ответ: 65 %. |
||
298. Рассчитайте выход по току металла, если при электролизе рас твора хлорида олова(П) в течение 2 часа на катоде выделился металл мас сой, равной 47,3 граммов. Сила тока при этом была равна 13,4 А. Составь те уравнения реакций, происходящих при электролизе. Ответ: 79,7 %.
299.Электролиз раствора соли нитрата никеля(П) проводили в тече ние 10,5 часов с инертными электродами. В результате электролиза на аноде выделился газ объемом, равным 33,6 литров. Газ измерен при нор мальных условиях. Выход по току газа считать равным 100%. Вычислите силу тока и массу осажденного металла при выходе его по току, равному 70%. Составьте уравнения реакций, происходящих при электролизе. Ответ: 15,31 А; 123,3 г.
300.Электролиз раствора соли хлорида олова(П) проводили в течение 1,5 часов с инертными электродами. В результате электролиза на аноде
выделился газ объемом, равным 1,67 литров. Газ измерен при нормальных условиях. Выход по току газа считать равным 100%. Вычислите силу тока и массу осажденного металла при выходе его по току, равному 75%. Со ставьте уравнения реакций, происходящих при электролизе.
Ответ: 2,66 А; 6,62 г.
ЗАКЛЮЧЕНИЕ
В настоящее время химия развивается стремительно. Являясь общетеоре тической дисциплиной, химия призвана дать студентам современное представ ление о веществе как одном из видов движущейся. Химия знакомит будущего специалиста с конкретными проявлениями вещества, дает возможность узнать его свойства.
Особенностью химии как дисциплины для студентов нехимических специ альностей является то, что в небольшом по объему курсе необходимо иметь сведения практически из всех отраслей химии, оформившихся как самостоя тельные науки и изучаемые химиками и химиками-технологами в специальных дисциплинах.
Авторы при написании пособия, подбирали материал таким образом, что бы помочь студенту-заочнику разобраться в материи, о путях, механизмах и способах превращения одних веществ в другие. Знание основных химических законов, владение техникой химических расчетов, понимание возможностей, предоставляемых химией, значительно ускоряют получение нужного результа та в различных сферах инженерной и научной деятельностишироком спектре основных понятий и законов химии. Учитывая учебную программу по химии, авторы старались, чтобы примеры решения задач были типичны для каждой темы, а текст заданий для самостоятельного решения был интересен будущим инженерам.
Соединения, составы и материалы, создаваемые химией, играют важней шую роль в повышении производительности труда, снижении энергетических затрат на производство необходимой продукции, освоении новых технологий и техники. Существует множество направлений развития прикладной химии, призванной решать конкретные задачи практической деятельности человека.
Знание химии является необходимой базой для принятия технических решений на производстве, и рациональной организации обычной, повсе дневной жизни, где каждый окружен множеством объектов из материалов, созданных химией.
150 |
151 |
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Активаторы коррозии 129 Анод 115, 140
-активный (растворимый) 140,142,143
-инертный 140, 142
анодный процесс 126,127,140 атом 10 Вещество
-простое 10
-сложное 10 восстановитель 103-106,126 восстановительные свойства 45 восстановление 103,126-127 выход потоку 145
Гальванический элемент 114, 115, 135
-концентрационный 117
-коррозионный 128,130-131, 136 гетерогенная система 80, 82 гетерогенная реакция 79 гидролиз 94-97 гомогенная система 82 гомогенная реакция 79 группа элементов 41, 42 Закон
-Авогадро 12, 15
-Бойля-Мариотта и ГейЛюссака (объединенный газо вый закон)14
-Гесса Г. И. 67-68, 71, 75
-Дальтона 15
-действующих масс 80, 86
-объемных отношений 54
-Фарадея 145
-эквивалентов 24-27, 59-61
-электролиза количественные
законы 144-145 Ингибиторы коррозии 133 Катод 124, 128, 140-1 42
катодный процесс 127, 130, 131 квантовое число
-главное 32, 35
-магнитное 32, 33, 35, 37
-орбитальное 32, 35
-спиновое 34, 35 кинетика химическая 79 кислотность основания 21 константа равновесия 87-89 коррозия
-металлов 123-125, 128-129, 132
-химическая 124-126
-электрохимическая 126-130
-методы защиты 132-136 Массовая доля 51-52, 57 мера неупорядоченности системы 70 металлические свойства 45
метод электронного баланса 105 моль 10 мольная доля 16
моляльность 53, 56 молярная доля 51-52, 57 молярная концентрация 52-55
молярная концентрация эквивалента 52-55, 58
молярная масса 10, 23 молярная масса эквивалента 23 молярный объем газа 12 Объемная доля 52 окисление 103, 106, 126-128 окислитель 103-104, 124-128
окислительно-восстановительная ре акция 101-104, 117 основность кислоты 21 относительная
-атомная масса 10, 11
-молекулярная масса 10, 11
152
-плотность газа 12,13
-электроотрицательность 44 Парциальное давление 16 период элементов 41-42
периодическая система элементов
Д.И. Менделеева 11,41
периодический закон Д. И. Менделеева 4 подгруппа элементов 41 порядок реакции 80 постоянная
-Авогадро 10
-Фарадея 145 потенциал ионизации 43 правило
-Вант-Гоффа81, 84
-Гунда 34-35
-Клечковского 34-35 принцип
-ЛеШателье88
-минимальной энергии 34
-Паули 34
процесс
-восстановления 126-127
-окисления 126-127 Равновесная концентрация 86 радиус атома 42 раствор 50 растворитель 50
растворенное вещество 51 ряд напряжений металлов 114, 141
ряд стандартных потенциалов 114
Скорость реакции 79, 82-83 следствие закона Гесса 68 спин 34, 35 сродство к электрону 43
стандартное состояние вещества 66 стандартные условия 66, 74 стандартная энтальпия образования 67 степень окисления 44, 102-104, 106
153
Тепловой эффект реакции 66 теплота сгорания 69 температурный коэффициент 81 термодинамика 65 термохимическое уравнение 67 титр 53, 57
Универсальная газовая постоянная 15 уравнение
-Аррениуса81
-Вант-Гоффа 81, 83-84
-Менделеева-Клапейрона 15, 87
-Нернста 113
Фактор эквивалентности 20-23 Химическое равновесие 73, 86 Число эквивалентности 21 Эквивалент 20 эквивалентный объем 23
экзотермическая реакция 73,88 электронная структура атома 31, 48 электрод ИЗ, 140, 142 электродный потенциал 113
электродвижущая сила элемента (ЭДС) 117 электролиз 140-142
электронные аналоги 44 электроотрицательность 43 электрохимический ряд металлов 114 эндотермическая реакция 73,88 энтальпия 66, 68, 70, 74-75 энтропия 70-75,124 энергия
-активации 81
-Гиббса 72-74, 117, 124
-ионизации 42
154 |
155 |
156 |
157 |
158 |
159 |
