
3. . . .
.pdfи невозбужденном состояниях, определите возможные степени окисле ния атомов.
63. Напишите электронные формулы элементов с порядковыми но мерами 40, 50, 82. В возбужденном состоянии данные элементы обра зуют с кислородом соединения типа Э0 2, напишите электроннографические формулы элементов, находящихся в соответствующем воз бужденном состоянии.
65.Напишите электронные формулы атомов элементов с поряд ковыми номерами 24 и 51, учитывая, что у первого элемента проис ходит «провал» одного 4s-электрона на Зd-подуровень. Чему равен максимальный спин d-электронов у атомов первого и p-электронов у атомов второго элемента?
66.Запишите электронные формулы элементов с порядковыми номерами 25 и 35. К каким семействам элементов они относятся и почему? Какие свойства должны быть характерны для этих элемен тов? Объясните сходство и различие в их свойствах.
67.Главное квантовое число n = 4. Запишите значения остальных квантовых чисел. Укажите элемент, у которого заканчивается запол нение электронами 4 dподуровня и запишите его электронную фор
мулу. Сколько электронов находится на 4 |
s и 4 р орбиталях? |
68.В атоме элемента на пятом энергетическом уровне находится 4 валентных электрона. Какими квантовыми числами они характери зуются? Укажите этот элемент, определите номер периода, группы. Определите возможные степени окисления этого элемента. Приведи те примеры соединений, с указанной степенью окисления.
69.Сколько электронов находится на энергетических уровнях, если главное квантовое число равно 2 и 4? Почему? Напишите электронные формулы атомов элементов, у которых заканчивается заполнение второго
ичетвертого энергетических уровней.
70. Какие элементы в периодической системе называются s -,p-, d-,f- элементами? Приведите примеры. Составьте электронные формулы (по одному представителю от каждого семейства). Сколько d-элементов мо
жет быть в одном периоде? Почему?
40
71.Что в атоме называют энергетическим уровнем и энергетиче ским подуровнем? Из какого числа подуровней состоит четвертый энер гетический уровень и какое число орбиталей он содержит? Почему? Со ставьте электронную формулу атома, у которого заканчивается заполне ние 4р- и 4 d- подуровней.
72.Назовите квантовые числа, характеризующие состояние электро на в атоме. Какие значения может принимать магнитное квантовое число
ичто оно характеризует? Составьте электронную формулу атома бария. Какими значениями квантовых чисел характеризуются валентные элек троны атома бария?
73.Как формулируется принцип Паули? Что такое энергетический уровень? Объясните, почему на втором энергетическом уровне не может быть больше восьми электронов, а на четвертом - тридцати двух электро нов? Составьте электронную формулу элемента, у которого заканчивается заполнение второго и четвертого энергетических уровней.
74.Какое квантовое число определяет форму орбиталей? Из скольких подуровней состоит четвертый энергетический уровень? Сколько орбиталей он содержит? Почему? Составьте электронную формулу элемента, у которо го заканчивается заполнение четвертого энергетического уровня.
75.В каком периоде и группе стоит элемент, имеющий три элек
трона на внешнем энергетическом уровне, для каждого из которых n = 5 и l= 1? Какие значения для них имеет магнитное квантовое число ml? Составьте электронную формулу этого элемента. Чему равно их суммарное спиновое число в основном и возбужденном со стояниях?
4.ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ
Д.И. МЕНДЕЛЕЕВА
Периодическая система элементов отражает периодический закон
Д. И. Менделеева:свойства элементов, а также формы и свойства их соединений находятся в периодической зависимости от заряда ядра их атома.
Периодическая таблица элементов состоит из периодов, групп и под групп.
41
Номер периодаопределяется главным квантовым числом |
п. Каждый |
период начинается элементом с электронной конфигурацией |
nsl и закан |
чивается элементом с конфигурацией ns2 (первый период) или ns лые периоды (1-3) содержат 2 и 8 элементов, большие периоды - 18 и 32 элемента, седьмой период - незавершенный.
Номер группы (всего восемь групп) определяется суммарным числом электронов во внешнем слое или во внешнем и предвнешнем слоях.
Группы делятся на главные подгруппы, у которых электроны заполня ют внешние s- и p-оболочки: s- и p-семейства элементов; и побочные под группы, у которых электроны заполняют предвнешние (n - 1) d-оболочки: d-семейства элементов и (n - 2)f-оболочки f-семейства элементов.
Вряду атомов с последовательно возрастающим порядковым номе ром (и соответственно зарядом ядра) также последовательно увеличивает ся число электронов в них. Это приводит к периодическому повторению подобных конфигураций их электронных оболочек и подоболочек. Боль шинство физико-химических и химических свойств элементов находятся в зависимости от строения внешних электронных подоболочек.
Так как электронное строение атомов элементов изменяется периоди чески, то соответственно периодически изменяются и свойства элементов: энергия ионизации, сродство к электрону, электроотрицательность и раз меры атомов.
Радиус атома r выражают в нанометрах (нм) или пикометрах (пм). По периоду слева направо атомный радиус уменьшается. Поскольку заряд ядра увеличивается, электроны притягиваются с большей силой, что и уменьшает радиус. Для d- и f-элементов вдоль периода радиусы умень шаются незначительно, так как происходит заполнение глубинных подо болочек.
Вгруппах сверху вниз растет число электронных оболочек, увеличи вается главное квантовое число, поэтому радиус увеличивается.
Энергия ионизации Е- это энергия, необходимая для удаления одного моля электронов от одного моля атомов с превращением их в положи тельно заряженные ионы. Энергию ионизации выражают в килоджоулях на моль (кДж/моль) или в электрон-вольтах (эВ). Она возрастает по пе-
42
риоду и уменьшается в группах с увеличением порядкового номера эле мента и характеризует восстановительную способность элемента (способ ность «отдавать» электроны).
Энергию ионизации можно определять, бомбардируя атомы электро нами, ускоренными в электрическом поле. Наименьшую разность потен циалов, при которой скорость электрона становится достаточной для ио низации атомов, называют потенциалом ионизации атомов данного эле мента. Потенциал ионизации (I), выраженный в вольтах (В), численно ра вен энергии ионизации (Е), выраженной в электрон-вольтах.
При затрате достаточной энергии можно удалить из атома два, три и более электрона. Первый потенциал ионизации соответствует энергии от рыва первого электрона, второй - энергии отрыва второго электрона и т. д.
По мере последовательного отрыва электронов от атома положитель ный заряд образующегося иона возрастает. Поэтому для удаления каждого последующего электрона требуется большая затрата энергии, так что по следовательные потенциалы ионизации атома I1, I2, I3 возрастают.
Сродство к электрону - энергетический эффект присоединения моля электронов к молю нейтральных атомов с превращением их в отрицатель но заряженные ионы. Сродство к электрону выражается в килоджоулях на моль (кДж/моль) или в электрон-вольтах (эВ). Сродство к электрону уве личивается по периоду и уменьшается в группах с увеличением порядко вого номера элемента. Характеризует окислительную способность эле мента (способность «присоединять» электроны).
Электроотрицательность (ЭО) - полусумма энергий ионизации и сродства к электрону (по Р. Малликену, США). Понятие электроотрица тельности введено для характеристики способности атомов притягивать к себе электронную плотность. Имеется несколько шкал электроотрицательностей. Л. Полинг ввел относительную шкалу электроотрицатель ности (ОЭО), приняв ЭО лития равной 1. ОЭО возрастает по периоду и несколько убывает в группах с возрастанием порядкового номера элемен та, хотя эта зависимость носит сложный характер (табл. 2).
43

Электронными аналогаминазывают элементы, у которых валентные электроны расположены на орбиталях, описываемых общей для всех эле ментов формулой. В периодической системе элементов электронные ана логи входят в состав одной подгруппы.
Пример 1. На каком основании хлор и марганец помещают в одной группе периодической системы элементов? Почему их помещают в раз ных подгруппах?
Решение.Электронные конфигурации атомов:
Валентные электроны хлора а марганца таким обра зом, эти элементы не являются электронными аналогами и не должны размещаться в одной и той же подгруппе. Но на валентных орбиталях атомов этих элементов находится одинаковое число электронов - 7. На этом основании оба элемента помещают в одну и ту же седьмую группу периодической системы, но в разные подгруппы.
Пример 2. Какую высшую и низшую степень окисления проявляют мышьяк, селен и бром? Составьте формулы соединений данных элемен тов, отвечающих этим степеням окисления.
Решение.Высшую степень окисления элемента определяет номер |
|
|
группы периодической системы Д. И. Менделеева, в которой он находит |
|
|
ся. Низшая степень окисления определяется тем условным зарядом, кото |
|
|
рый приобретает атом при присоединении того количества электронов, |
|
|
которое необходимо для образования устойчивой восьмиэлектронной |
|
|
оболочки (ns 2np6). |
|
|
Данные элементы находятся соответственно в главных подгруппах V, |
s2p3, |
|
VI, VII групп и имеют структуру внешнего энергетического уровня |
||
s2p4 ,s2p5. Следовательно, степени окисления мышьяка, селена, брома в со |
|
|
единениях таковы: |
|
|
As +5 (высшая), -3 (низшая); AS2O5, AsH 3; |
|
|
Se +6 (высшая), -2 (низшая); SеОз, Na |
2Se; |
|
Br +7 (высшая), -1 (низшая); КВrO |
4, КВr. |
|
Пример 3. У какого из элементов четвертого периода - марганца или брома - сильнее выражены металлические свойства?
Решение.Электронные формулы данных элементов:
Марганец - d-элемент VII группы побочной подгруппы, а бром - p-элемент VII группы главной подгруппы. На внешнем энергетическом уровне у атома марганца два электрона, а у атома брома - семь.
Атомы типичных металлов характеризуются наличием небольшого числа электронов на внешнем энергетическом уровне, а следовательно, тенденцией терять эти электроны. Они обладают только восстановитель ными свойствами и не образуют отрицательных ионов. Элементы, атомы которых на внешнем энергетическом уровне содержат более трех элек тронов, обладают определенным сродством к электрону, а следовательно, приобретают отрицательную степень окисления и образуют отрицатель ные ионы. Таким образом, марганец, как и все металлы, обладает только восстановительными свойствами, тогда как для брома, проявляющего сла бые восстановительные свойства более свойственны окислительные
44 |
45 |
|

функции. Следовательно, металлические свойства более выражены у мар ганца.
Пример 4: Опишите химические свойства элемента с порядковым но мером 23 по его положению в периодической системе.
Решение.По периодической системе определяем, что элемент с по рядковым номером 23 находится в четвертом периоде и в побочной под
группе V группы. Этот элемент - ванадий V. Электронная формула V: ls22s22p63s23p64s23d3.
Следовательно, V - d-элемент. Элемент может легко отдавать 2 элек трона с 4-го уровня, проявляя степень окисления +2. При этом он образует оксид V0 и гидроксид V(OH) 2, проявляющие основные свойства. Газооб разных водородных соединений ванадий не образует, так как расположен в побочной подгруппе. Атом ванадия может также отдавать электроны с d-подуровня предпоследнего энергетического уровня (3 электрона) и, та ким образом, проявлять высшую степень окисления +5 (численно равную номеру группы, в которой расположен элемент). Оксид, соответствующий высшей степени окисления, V 205. Этот оксид обладает кислотными свой ствами. В качестве гидроксида ему соответствует неустойчивая метаванадиевая кислота HV0 3 (соли ее - ванадаты - устойчивые соединения).
Задания для самостоятельной работы
76. Как изменяются кислотно-основные свойства соединений в пе риодах и группах? Исходя из положения элемента в периодической таб лице дайте мотивированный ответ на вопрос: какое из каждой пары со
единений является более сильной кислотой: НСlO 4 или H2SO4; Н3РО4или H 3As04; НС1 или HI? Приведите пример реакций, подтверждающих ки слотные свойства Н3РО4.
77. Исходя из положения калия и фосфора в периодической таблице, составьте формулы оксидов, мета- и ортофосфорной кислот, дигидрофосфата калия. Изобразите графические формулы этих соединений. Одинако выми ли свойствами характеризуются оксиды этих элементов? Приведите примеры реакций, подтверждающие свойства оксидов этих элементов.
78.Дайте определение энергии ионизации атома. В каких едини цах она измеряется? Как изменяется эта величина в периодах и груп пах? Почему? Как можно объяснить тот факт, что энергия ионизации
убериллия больше, чем у бора?
79.Составьте формулы оксидов и гидроксидов элементов третьего периода периодической таблицы, отвечающих их высшей степени окисле ния. Как изменяется химический характер этих соединений при переходе от натрия к хлору? Приведите примеры реакций, подтверждающих свой ства оксида алюминия.
80.Какую низшую степень окисления проявляют хлор, сера и азот? Почему? Составьте формулы соединений алюминия с данными элемента ми в этой степени окисления. Дайте название этих соединений.
81.Как изменяются кислотно-основные свойства соединений в пе риодах и группах? Исходя из положения металла в периодической табли це дайте мотивированный ответ на вопрос: какое из каждой пары гидро
ксидов более сильное основание: Ве(ОН) 2 или Mg(OH) 2; Са(ОН) 2 или Fe(OH) 2; Cd(OH) 2 или Sr(OH) 2? Какими свойствами характеризуется Ве(ОН) 2? Приведите примеры реакций.
82.Что понимают под возбужденным состоянием атома? Напишите электронные формулы атома фосфора, находящегося в нормальном и воз бужденном состояниях. Представьте графические электронные формулы для этих двух состояний. Какие валентности и степени окисления может проявлять фосфор в этих состояниях? Приведите примеры соединений фосфора, в которых он находится в нормальном и возбужденном состоя ниях.
83.Что характеризует относительная электроотрицательность эле мента? Исходя из величин электроотрицательности, укажите, как в приве денном ряду F, Cl, Br, I изменяется способность атомов принимать элек троны? Какой галоген будет: а) более сильным окислителем, б) более сильным восстановителем? Закончите уравнение реакции
С12 + Вr 2 + Н 2 0= ...
84. Из двух элементов один образует ион Э 3+, а другой - Э 3- . Оба иона имеют одинаковую электронную конфигурацию, которая выражается
46 |
47 |
формулой: 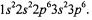 Определите период, группу, подгруппу и порядковый номер каждого элемента.
Определите период, группу, подгруппу и порядковый номер каждого элемента.
85.Какая пара в каждой из указанных ниже совокупностей элементов обладает наиболее сходными химическими и физическими свойствами?
а) Са; Р; Si; I; Sr; Ag; Ni; б) Na; Mo; As; Br; Sb; N.
Ответ поясните на основании электронного строения атомов.
86.Какие закономерности наблюдаются в изменении атомных радиу сов в периодах и группах? Почему? Напишите электронную формулу эле мента пятого периода с самым большим и самым маленьким радиусами.
Что является более сильным восстановителем: Сl |
- или I - ; более сильным |
окислителем: С1 2 или I 2? Почему? |
|
87.На каком основании хром и сера расположены в одной группе пе риодической системы? Почему их помещают в разных подгруппах? Ответ поясните на основании электронного строения атомов. Одинаковые ли свойства проявляют хром и сера? С кислотой или щелочью будут реаги ровать эти вещества?
88.Напишите электронную конфигурацию атома олова. Назовите элементы, являющиеся электронными аналогами этого элемента. Как изменяются свойства электронных аналогов (энергия ионизации, энергия сродства к электрону, электроотрицательность) с увеличени ем номера периода? Обоснуйте ответ с позиции теории строения атома.
89.Дайте определение энергии ионизации атома. В каких единицах она измеряется? Энергии ионизации атомов благородных газов со ставляют (в эВ): Не - 24,6; Ne - 21,6; Аr - 15,8; Кr - 14,0; Хе - 12,1;
Rn - 10,8. Объясните ход изменения энергии ионизации в этой под группе.
90.Значения первых потенциалов ионизации элементов I группы периодической системы элементов соответственно равны (в эВ):
Li - 5,4; Cs - 3,9; Сu - 7,7; Ag - 9,2. Укажите, у элементов какой под группы I группы металлические свойства выражены более резко?
48
Почему? Чем объяснить различный ход изменения значений потен |
|
|
||||||
циалов ионизации в подгруппах? |
|
|
|
|
|
|||
91. Из элементов: F; Кr; Са; Cs; W; Sb; S; Sn выберите такой, кото |
|
|
||||||
рый: а) должен образовывать ион с зарядом -2; б) иметь наименьшую ре |
|
|
||||||
акционную способность; в) должен образовывать ион с зарядом +1; |
|
|
||||||
г) является амфотерным элементом. Составьте электронные формулы этих |
|
|||||||
элементов. Подтвердите реакциями амфотерные свойства выбранного |
|
|
||||||
элемента. |
|
|
|
|
|
|
|
|
92. Что такое энергия ионизации? Как изменяется с ростом по |
|
|
|
|||||
рядкового номера значение первого потенциала ионизации у элемен |
|
|
||||||
тов второго периода и второй группы? Чем объяснить, что первый |
|
|
|
|||||
потенциал ионизации атома Be больше, чем атомов Li и В? |
|
|
|
|||||
93. Как изменяются окислительные свойства у элементов: а) одной |
|
|
||||||
группы, б) одного периода? Почему? У какого атома окислительные |
|
|
||||||
свойства выражены сильнее: a) 2s2 2р4 ; б) |
5s2 5р4 ; в) 2s2 2р5 ; г) |
5s2 5р5 ? От |
||||||
вет поясните. Приведите пример реакции, в которой атомы этого элемен |
|
|
||||||
та проявляют окислительные свойства? |
|
|
|
|
|
|||
94. Как изменяются восстановительные свойства у элементов: а) од |
|
|
||||||
ной группы, б) одного периода? Почему? У какого иона восстановитель |
|
|
||||||
ные свойства выражены сильнее: a) |
[...2s |
22p6]- ; б) |
[..3s |
23p6] |
- ; |
|||
2 6 - |
; г) [...5s |
2 6 - |
? Ответ поясните. Приведите пример реакции, |
|
||||
в) [..4s 4p ] |
5p ] |
|
||||||
вкоторой атомы этого элемента проявляют восстановительные свойства.
95.Какой высший оксид и гидроксид образуют химические эле менты с порядковыми номерами 31, 53? Почему? Какие свойства бу дут проявлять эти соединения? Приведите примеры реакций.
96.Какой элемент пятого периода периодической системы
Д. И. Менделеева является наиболее типичным неметаллом, а какой - наиболее типичным металлом? Почему? Составьте электронные формулы этих элементов. Приведите примеры реакций, подтвер ждающих свойства этих элементов.
97. Конфигурация валентных электронов в атомах двух элемен-
тов выражается формулами: a) 3s 2 Зр 2 и 4s 2 3d2 ; б) 4s 2 3d 3 и 4s 2 4р3 . В каких периодах и группах находятся эти элементы? Должны ли они
49
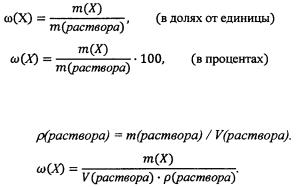
отличаться по своим свойствам, имея одинаковое число валентных электронов?
98. Какой из двух оксидов обладает более выраженным кислот
ным характером: a) FeO или Fe |
203; б) МnО или Мn0 |
3? Ответ обос |
нуйте. Приведите примеры реакций, подтверждающие свойства ок |
||
сидов МnО и Мn0 3.
99. Назовите элемент: а) IV периода, который образует высший оксид Э2О7и газообразное соединение с водородом НЭ; б) V периода,
который образует высший оксид Э0 |
2, газообразное соединение с во |
|
дородом не образует; в) IV периода, который образует высший оксид |
||
ЭО и газообразное соединение с водородом ЭН |
2. |
|
100. У какого из элементов VII группы - хлора или йода - силь нее выражены неметаллические свойства? Почему? Какой из них об разует более сильную галогеноводородную кислоту? Каковы форму лы их высших кислородсодержащих кислот?
5.СПОСОБЫ ВЫРАЖЕНИЯ СОСТАВА РАСТВОРОВ
Растворомназывается гомогенная система, состоящая из двух или более независимых компонентов, соотношение между которыми может изменяться.
Компонент, количественно преобладающий в системе и не изменяю щий своего агрегатного состояния при приготовлении раствора, называет ся растворителем.Остальные компоненты, входящие в состав раствора, называются растворенными веществами.Однако это деление носит ус ловный характер.
Растворы, которые содержат большое количество растворенного ве
щества, называют |
концентрированными, а с малым содержанием раство |
ренного вещества - |
разбавленными. |
Концентрированные растворы могут образовывать только хорошо растворимые вещества, а разбавленные растворы - вещества с любой рас творимостью.
Важнейшей характеристикой растворов, влияющей на их свойства, является состав раствора, т. е. содержание растворенного вещества в оп ределенной массе или объеме раствора или растворителя. Существуют
различные способы выражения состава растворов. Состав раствора может быть выражен безразмерными (доли, отношения) и размерными величи нами (молярная концентрация, массовая концентрация, моляльность, титр и т. д.).
Термин «концентрация» потерял в настоящее время прежнее слиш ком широкое значение.
Концентрациейназывают отношение массы или количества веще ства к объему системы (раствора).
Рассмотрим некоторые широко распространенные способы выраже ния состава растворов.
1. Массовая доля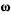 - отношение массы растворенного вещества к массе раствораВыражается. в долях от единицы или процентах.
- отношение массы растворенного вещества к массе раствораВыражается. в долях от единицы или процентах.
Для растворов проще измерить объем, а не массу. Массу и объем раствора связывает между собой плотность раствора 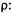
Этот способ выражения состава растворов часто используют в быту, на производстве, в медицине.
С изменением содержания растворенного вещества в растворе изме няется и плотность раствора. Используя таблицы, для раствора с опреде ленной массовой долей можно определить плотность раствора и, наобо рот, по плотности можно определить массовую долю вещества в растворе.
2. Молярная доля 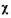 - отношение количества вещества данного компонента, содержащегося в системе, к общему количеству вещества этой системы.
- отношение количества вещества данного компонента, содержащегося в системе, к общему количеству вещества этой системы.
Если система состоит из двух компонентов - веществ А и В, то мо лярная доля веществ А и В будет равна:
50 |
51 |
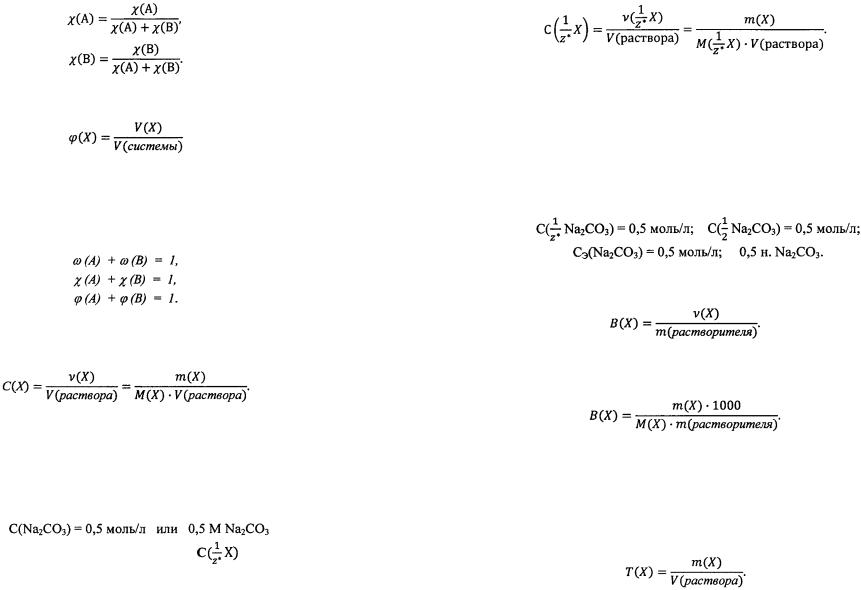
3. Объемная доля - отношение объема данного компонента, со держащегося в системе, к объему всей системы.
- отношение объема данного компонента, со держащегося в системе, к объему всей системы.
Массовая доля, молярная доля, объемная доля - относительные |
без |
размерные величины. |
|
Выражать их можно в долях от единицы или в про |
|
центах. |
|
Для раствора, состоящего из двух компонентов А и В, сумма массо |
|
вых, молярных и объемных долей компонентов системы равна единице: |
|
4. Молярная концентрация С(Х) -отношение количества вещест ва X, содержащегося в растворе, к объему этого раствора. Выражается моль/л или моль/дм3.
Молярная концентрация показывает, какое количество растворенно го вещества (число моль) содержится в одном литре данного раствора.
Для более краткого обозначения этой концентрации используют условное обозначение «М».
Например, для раствора с молярной концентрацией карбоната натрия
0,5 моль/л можно сделать запись: |
|
5. Молярная концентрация эквивалента |
- отношение ко |
личества вещества эквивалента данного вещества X, содержащегося в |
|
растворе, к объему этого раствора. |
3 |
Выражается в моль/л или моль/дм .
52
Молярная концентрация эквивалента вещества X показывает, какое количество вещества эквивалента (число моль эквивалентов данного ве щества X) содержится в одном литре раствора.
Для обозначения молярной концентрации эквивалента раньше ис пользовали термины «эквивалентная концентрация», «нормальная кон центрация» и символы: С н , С э , N или н.
Например, для раствора карбоната натрия с молярной концентрацией эквивалента 0,5 моль/л можно встретить такие формы записи:
6.Моляльность В — отношение количества растворенного вещества
кмассе растворителя.Выражается в моль/кг.
Если массу растворенного вещества и растворителя выражать |
в грам |
|
мах, то выражение моляльности можно записать в виде, более удобном |
|
|
для расчетов: |
|
|
Моляльность показывает, какое количество растворенного вещества |
||
приходится на один килограмм растворителя. |
|
|
Например, B(Na |
2C03) = 0,5 моль/кг означает, что на 1 кг растворителя |
|
(воды) в данном растворе приходится 0,5 моль карбоната натрия. |
|
|
7. Титр раствора - |
масса растворенного вещества, содержащегося |
|
в 1 см 3 или 1мл раствора. Выражается в г/см 3 или г/мл. |
|
|
Различные способы выражения состава раствора связаны между со бой. Например, молярная концентрация и молярная концентрация эквива лента связаны между собой соотношением:
53

Титр раствора связан с молярной концентрацией и с молярной кон центрацией эквивалента:
Для реакций, протекающих в растворах, при проведении вычислений часто используют закон эквивалентов, который в этом случае может быть выражен следующим образом:
т. е. количества вещества эквивалента или число частиц, играющих роль эквивалента, для веществ X и Y, вступающих во взаимодействие, должно быть равно.
По закону эквивалентов объемы реагирующих растворов обратно пропорциональны их молярным концентрациям эквивалентов.
Закон эквивалентов, записанный в таком виде, называют |
законом |
объемных отношений. |
|
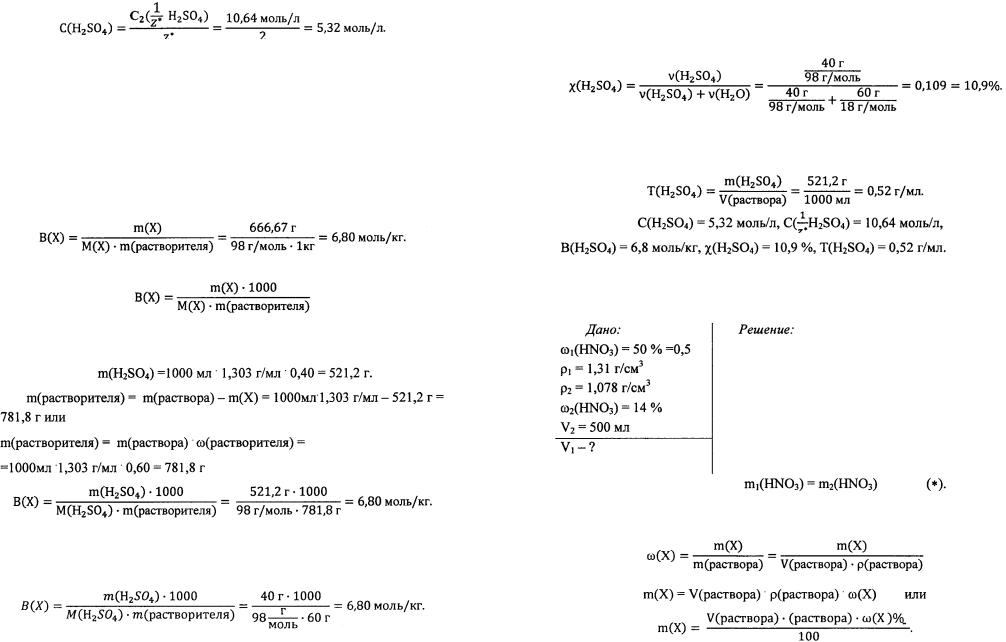
Пример 1. Определите молярную концентрацию, молярную концен трацию эквивалента, моляльность, молярную долю и титр серной кислоты в растворе с массовой долей соли, равной 40 %. Плотность этого раствора 1,303 г/см 3.
Для определения молярной концен трации и молярной концентрации эквива лента найдем массу кислоты, которая со держится в 1 л данного раствора:
Определим с помощью периодической таблицы молярную массу и молярную массу эквивалента серной кислоты:
Зная массу кислоты в 1 л рассматриваемого раствора, молярную мас су и молярную массу эквивалента кислоты H 2S04, вычислим молярную концентрацию и молярную концентрацию эквивалента данного раствора:
Молярная концентрация и молярная концентрация эквивалента связа ны между собой соотношением:
Поэтому переход от молярной концентрации к молярной концентра ции эквивалента и обратно можно выполнять с учетом этой зависимости, если известна одна из концентраций.
Для серной кислоты число эквивалентности (z*) равно 2, так как серная кислота - двухосновная кислота. Следовательно, если
C(H 2S04) = 5,32 моль/л, то
И, наоборот, если известна молярная концентрация эквивалента рас твора, то молярную концентрацию этого раствора можно определить, ис пользуя вышеприведенную зависимость:
54 |
55 |
Для того чтобы вычислить моляльность раствора H 2S04, необходимо найти массу и количество вещества кислоты, приходящееся на 1 кг рас творителя (воды). Из условий задачи следует, что для 40 %-ного раствора в каждых 100 г раствора содержится 40 г серной кислоты и 60 г воды. Следовательно, чтобы найти массу соли, приходящейся на 1 кг воды, можно составить пропорцию:
1000:60 = х:40 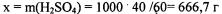 (масса кислоты, приходящаяся
(масса кислоты, приходящаяся
на 1000 г или 1 кг растворителя)
Моляльность раствора можно вычислить и по формуле
Если взять 1 л раствора серной кислоты, то масса кислоты и раство рителя может быть определена таким образом:
Для раствора с массовой долей, равной 40 %, независимо от того, ка кой объем раствора был взят соотношение между H2SO4 и водой будет 40 : 60, поэтому моляльность можно вычислить и таким образом:
Для определения молярной доли серной кислоты в 40 %-ном раство ре, возьмем 100 г раствора данной кислоты, в котором на 40 г кислоты приходится 60 г воды:
Титр раствора показывает массу растворенного вещества, содержаще гося в 1 см 3 или 1 мл раствора. В данном случае в 1 л раствора содержится 521,2 г кислоты, следовательно, титр раствора будет равен:
Ответ:
Пример 2. Какой объем раствора азотной кислоты с массовой долей 50% 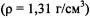 необходимо взять для приготовления 500 мл раствора с массовой долей 14 %
необходимо взять для приготовления 500 мл раствора с массовой долей 14 % 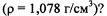
По условию задачи из более концентри рованного раствора необходимо приготовить менее концентрированный раствор. В этом случае расчет проще всего вести с учетом то го, что масса азотной кислоты в исходном рас творе и полученном растворе должна быть одинакова:
Выразим массу растворенного вещества исходя из определения и вы ражения массовой доли вещества в растворе:
56 |
57 |

Следовательно, для вышеприведенного равенства (*), мы можем за писать:
Ответ:115,2 мл.
V
Пример 3. Какой объем раствора серной кислоты с массовой долей 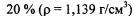 надо взять для приготовления 2 л раствора с моляр-
надо взять для приготовления 2 л раствора с моляр-
ной концентрацией эквивалента кислоты 0,5 моль/л?
По условию задачи из более концен трированного раствора H 2S04, для которого указана массовая доля кислоты в растворе, необходимо приготовить менее концентри рованный раствор, с заданной молярной концентрацией эквивалента.
Вэтом случае расчет проще всего вести с учетом того, что масса соли
висходном растворе и полученном растворе должна быть одинакова:
Выразим массу растворенного вещества исходя из определения и вы ражения массовой доли вещества в растворе (ml) и молярной концентра ции эквивалента (m 2):
Предварительно вычислим молярную массу эквивалента серной ки слоты:
Подставим значения ml и m 2 в равенство (*) и выразим V1(раствора):
Ответ:215,1 мл.
Пример 4. Какой объем раствора гидроксида натрия с молярной кон центрацией 0,25 моль/л необходимо взять, чтобы осадить в виде Fe(OH) 3 все железо, содержащееся в 300 мл раствора хлорида железа(III) с моляр
ной концентрацией эквивалента 1,5 моль/л? Какова масса выпавшего осадка?
Если в задаче речь идет о взаимодействии веществ, то вычисления можно вести:
а) по закону эквивалентов, б) по уравнению реакции.
А) Первый способ (по закону эквивалентов).
Очень широко этот способ решения задач применяется в аналитиче ской химии. Этот метод не требует составления уравнений реакций, про текающих в системах, но для лучшего понимания сути задачи необходимо представлять, какие процессы протекают при взаимодействии реагирую
щих веществ. По закону эквивалентов - количество вещества эквивален та для всех веществ, участвующих в реакции, должно быть равно.
В растворе протекает реакция:
58 |
59 |
