
- •ВВЕДЕНИЕ
- •§1. Краткие сведения по квантовой механике
- •§2. Уравнение Шредингера
- •§3. Энергетические состояния электронов в водородоподобных системах
- •РАЗДЕЛ 1. ОСНОВЫ ФИЗИКИ ПОЛУПРОВОДНИКОВ
- •1.1. Полупроводники
- •Энергетические (зонные) диаграммы полупроводников.
- •Уровень Ферми
- •Физические процессы в полупроводниках
- •Беспримесный полупроводник.
- •Процесс генерации пар зарядов.
- •Примеси в полупроводниках.
- •Дырочный полупроводник (р-типа).
- •1.2 Типы рекомбинации
- •1.3. Электронно-дырочный переход.
- •§1. Классификация. Методы изготовления.
- •§2. Свойства р-n-перехода.
- •Р-n-переход при прямом включении.
- •P-n-переход при обратном включении
- •Учет дополнительных факторов, влияющих на вольт-амперную характеристику диода. Пробой.
- •РАЗДЕЛ 2. ПОЛУПРОВОДНИКОВЫЕ ПРИБОРЫ
- •2.1. Полупроводниковые диоды
- •§ 1. ВЫПРЯМИТЕЛЬНЫЕ ДИОДЫ.
- •§2. ВЫСОКОЧАСТОТНЫЕ ДИОДЫ.
- •§ 3. ИМПУЛЬСНЫЕ ДИОДЫ.
- •§ 4. СВЕРХВЫСОКОЧАСТОТНЫЕ ДИОДЫ.
- •§ 5. СТАБИЛИТРОНЫ.
- •§ 6. ВАРИКАПЫ.
- •§ 8. ОБРАЩЕННЫЕ ДИОДЫ.
- •§ 9. РАБОЧИЙ РЕЖИМ ДИОДА.
- •2.2. Биполярные транзисторы
- •§ 1. Общие сведения. Устройство.
- •§ 2. Физические процессы, протекающие в VT. Токи VT.
- •§3. Основные схемы включения транзисторов.
- •§4 Влияние температуры на статические характеристики VTа.
- •§5 Эквивалентные схемы замещения транзистора.
- •§6 Представление транзистора в виде четырехполюсника и системы статистических параметров.
- •§7 Эл. пар-ры, классификация и система обозначений VTов.
- •2.3 Полевые транзисторы
- •§1. Полевые транзисторы с управляющим переходом.
- •§2. Статические характеристики полевого транзистора с управляющим p-n-переходом.
- •§3. Полевые транзисторы с изолированным затвором.
- •2.4. Тиристоры (VS)
- •§ 1. Принцип действия.
- •§ 2. Математический анализ работы тиристора (не нужно).
- •§ 3. Вольт – амперная характеристика тиристора.
- •§ 4. Типы тиристоров.
- •§ 5. Особенности работы и параметры тиристоров.
- •2.5. Оптоэлектронные полупроводниковые приоры.
- •Полупроводниковые излучатели
- •Фотоприемники (общие сведения)
- •Фоторезисторы
- •Фотодиоды
- •Фотоэлементы
- •Фототранзисторы
- •Фототиристоры
- •Оптроны
- •2.6. Интегральные микросхемы
- •РАЗДЕЛ 3. УСИЛИТЕЛИ
- •§1. Анализ процесса усиления электрических сигналов
- •§2. Работа УЭ с нагрузкой.
- •Динамические х-ки.
- •Нагруз. линии У и их построение.
- •Сквозная характеристика У на биполярном VT.
- •§3. Стр - рная схема У. Классификация У.
- •Общие сведения.
- •Классификация У.
- •§4 Основные параметры и характеристики усилителей.
- •§5 Обратная связь в усилителях.
- •Режимы работы УЭ.
- •РАЗДЕЛ 4. ОПЕРАЦИОННЫЕ УСИЛИТЕЛИ
- •Общие сведения
- •Инвертирующий усилитель
- •Интегратор
- •Содержание

известно, что если некоторое количество волн образуют, так называемый волновой пакет, |
|||||||||
то за счет взаимной интерференции эти волны гасят друг друга во всем пространстве за |
|||||||||
исключением некоторой ограниченной области тем |
меньше, |
чем шире диапазон |
λ |
||||||
значений длин волн, составляющий волной пакет. |
|
|
|
|
|||||
Следовательно, |
если предположить, |
что волновые свойства микрочастицы |
|||||||
отражает не одна волна де Бройля, а волновой пакет составленный из волн де Бройля, |
|||||||||
положение микрочастицы в пространстве можно локализовать в пределах некоторой |
|||||||||
ограниченной области. |
Правда при этом мы не сможем указать точное значение импульса |
||||||||
микрочастицы, т.к. набору волн |
λ соответствует набор |
р значений импульса. |
|
||||||
Если признавать наличие у микрочастицы волновых свойств, то нужно признать и |
|||||||||
принципиальную невозможность одновременного задания (измерения) ее координат и |
|||||||||
импульса. В тоже время можно одновременно указать некоторую область |
|||||||||
пространства с размерами |
x, |
y, z, в которых находится микрочастица и некоторый |
|||||||
диапазон значений импульса |
рх, рy, |
рz, которым она (микрочастица) обладает. |
|
||||||
Связь между размерами пространственной области и диапазоном значений |
|||||||||
импульса была открыта Гейзенбергом в 1925г. |
|
|
|
|
|
||||
x · pх ≥ h ; |
|
y · |
py ≥ h |
; |
z · |
pz |
≥ h |
(12) |
|
x · vх ≥ h/m ; |
|
y · |
vy ≥ h/m ; |
z · |
vz |
≥ h/m |
|
|
|
Данные соотношения называют соотношениями неопределенностей Гейзенберга. |
|||||||||
Из этих соотношений следует, |
что чем точнее определяются координаты микрочастицы, |
||||||||
тем неопределеннее становятся составляющие импульса и наоборот. |
|
||||||||
/Сказать, почему из за ошибки Гейзенберга не сделали атомную бомбу немцы./ |
|
||||||||
Ясно, что отказ от основного постулата классической теории (механики) делает |
|||||||||
невозможным ее использование для описания поведения микрочастиц. Следовательно, |
ее |
||||||||
необходимо заменить другой теорией, которая бы базировалась на вероятностном |
|||||||||
представлении о поведении микрочастиц. Такая теория была создана и получила название |
|||||||||
квантовой механики. В 1925г. Ее сформулировал 24 |
летний студент Гейзенберг, а в 1926г. |
||||||||
Независимую формулировку дал австрийский физик Шредингер. |
|
|
|||||||
§2. Уравнение Шредингера
Мы уже разобрались, |
что состояние микрочастицы не может быть |
|||||||||||||
охарактеризовано совокупностью координат и проекцией импульса, как в классической |
||||||||||||||
механике. |
Так что же тогда отражает состояние микрочастицы? Шредингер предположил, |
|||||||||||||
что существует некоторая функция координат пространства |
и времени |
, |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||
которая и является искомой характеристикой состояния микрочастицы. Он назвал ее |
||||||||||||||
волновой функцией и предложил уравнение для ее отыскания: |
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
, |
(13) |
|
||||
где |
- квант; действия; |
|
||||||||||||
|
|
|
|
|
|
|
||||||||
|
m – масса покоя микрочастицы; |
|
|
|
||||||||||
|
’2 - оператор Лапласа; |
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
; |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||

|
W(x,y,z,t) – потенциальная энергия микрочастицы во внешнем силовом поле; если |
|||||||||||||||
микрочастица свободна, то |
W(x,y,z,t)=0. |
|
|
|
|
|
|
|||||||||
|
Отметим особенности уравнения Шредингера: |
|
|
|||||||||||||
1. |
Это уравнение – |
дифференциальное уравнение частных производных, хорошо |
||||||||||||||
известное как волновое уравнение; его решением являются функции, описывающие |
||||||||||||||||
процесс распространения волн в пространстве. |
|
|
|
|||||||||||||
2. |
Уравнению |
() |
могут удовлетворять |
только комплексные значения. Поскольку |
||||||||||||
комплексные числа – |
это математическая абстракция, не имеющая физического смысла, |
|||||||||||||||
то и волновая функция |
\ тожже не имеет физического смысла и значит, сама по себе не |
|||||||||||||||
характеризует состояние микрочастицы. |
|
|
|
|
|
|
||||||||||
|
Но оказывается, |
что физический смысл имеет произведение волновой функции \ и |
||||||||||||||
комплексно сопряженной с ней функции |
: |
|
|
|
||||||||||||
|
|
\ \*= |
|
|
|
|
. |
|
|
|
|
|
(14) |
|||
|
|
|
|
|
|
|
|
|
|
|
||||||
|
Физический смысл произведения |
\\* заключается в следующем: |
||||||||||||||
|
Это произведение есть действительная функция, численное значение которой для |
|||||||||||||||
данной точки пространства в данный момент времени, равно вероятности нахождения |
||||||||||||||||
микрочастицы в единичном пространстве окружающем данную точку. |
||||||||||||||||
|
Эту вероятность обозначают W(x,y,z,t). |
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(15) |
|
|
или сокращенно |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
. |
|
|
|
|
(16) |
|
|
|
В соответствии с таким физическим смыслом волновая функция должна быть |
|||||||||||||||
непрерывной и иметь непрерывную первую производную, |
однозначной и конечной во |
|||||||||||||||
всех точках пространства, |
т.к. |
вероятность нахождения микрочастицы не может быть |
||||||||||||||
величиной неоднозначной, |
бесконечной или скачкообразно изменяться от точки к точке. |
|||||||||||||||
|
Отметим, что если мы рассматриваем поведение не одной, |
а совокупности (или |
||||||||||||||
системы) |
микрочастиц, |
то оно описывается их общей волновой функцией, зависящей от |
||||||||||||||
координат всех частиц. |
Например, для ситстемы из двух микрочастиц волновая функция |
|||||||||||||||
имеет вид: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
где |
x1, y1, z1 |
– |
координаты первой микрочастицы,; |
|
(17) |
||||||||||
|
|
x2, y2, z2 |
- |
координаты второй микрочастицы. |
|
|
||||||||||
|
Произведение |
|
|
|
|
|
|
|
|
|
имеет смысл вероятности того события, что в |
|||||
момент времени t одна из микрочастиц находится в единичном объеме, окружающем |
||||||||||||||||
точку с координатами |
x1, y1, z1 |
, а другая – в единичном объеме, |
окружающем точку с |
|||||||||||||
координатами x2, y2, z2. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
Потенциальная |
|
энергия, |
входящая в уравнение Шредингера, является в общем |
||||||||||||
случае функцией координат и времени. |
Однако во многих практически важных задачах |
|||||||||||||||
потенциальная энергия является функцией только координат и не зависит от времени. Для |
||||||||||||||||
таких задач волновую функцию можно представить в виде: |
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
, |
(18) |
|
где |
Е – полная энергия микрочастицы. |
||||||||||||||
|
|
|
||||||||||||||
|
|
Функция |
|
|
|
, зависящая только от координат, называется амплитудой |
||||||||||
волновой функции. Ее можно найти из уравнения |
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
, |
|
|
(19) |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
которое называется амплитудным уравнением Шредингера. |
|
||||||||||||||
Силовое поле, в котором потенциальная энергия микрочастицы не зависит от времени, называется стационарным. Состояния микрочастиц в стационарном поле называются стационарными состояниями. Т.е. амплитудное уравнение Шредингера описывает стационарные уравнения микрочастиц.
Каждое состояние микрочастицы описывается одной волновой функцией. Если уравнение Шредингера допускает решение в виде нескольких волновых функций, то это означает, что микрочастица может находиться в нескольких различных состояниях.
§3. Энергетические состояния электронов в водородоподобных системах
|
Водородоподобной называют систему, |
в которой вокруг ядра с зарядом Z |
|||||||||||||
движется единственный электрон. |
Строго говоря, отыскание возможных энергетических |
||||||||||||||
состояний такой системы является задачей о движении двух частиц около неподвижного |
|||||||||||||||
центра |
масс. |
Однако в силу того, что масса ядра значительно превосходит массу |
|||||||||||||
электрона, то можно считать, что ядро неподвижно и движение электрона происходит в |
|||||||||||||||
его стационарном электрическом поле. |
При этом сила, действующая на электрон, |
является |
|||||||||||||
кулоновской силой взаимодействия электрических зарядов. |
|
|
|
||||||||||||
|
Если принять за ноль потенциальной энергии энергию свободного электрона, т.е. |
||||||||||||||
электрона бесконечно удаленного от ядра, |
то на расстоянии r от ядра электрон обладает |
||||||||||||||
потенциальной энергией, равной: |
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
, |
|
|
|
|
(20) |
|
|
|
|
|
где |
|
Z |
– |
порядковый |
|
номер |
|
химического |
|
… |
||||
|
|
|
|
|
Е3 |
|
|||||||||
элемента; |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
е – |
заряд электрона; |
|
|
|
|
|
|
|
|
Е |
|
|||
среды. H0 |
– |
удельная диэлектрическая |
проницаемость |
|
|
||||||||||
|
2 |
|
|||||||||||||
|
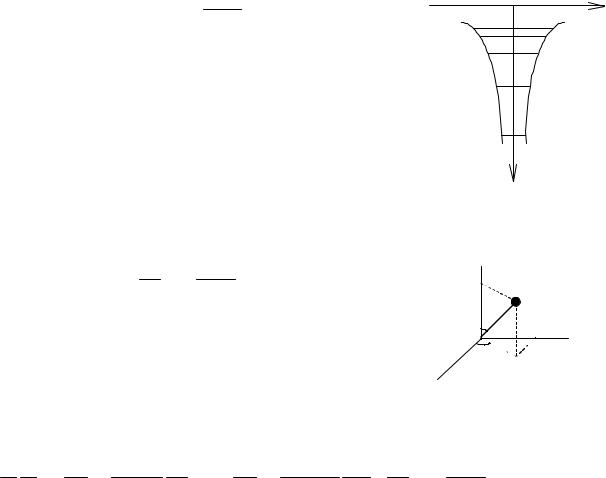
На рис.3 |
показана кривая W(r). |
Из этого рисунка |
|
Е1 |
|
|||||||||
видно, |
|
что |
|
водородоподобную |
|
систему |
можно |
|
|
|
|||||
рассматривать |
как |
своеобразную |
|
потенциальную |
яму |
|
W( r ) |
||||||||
(потенциальную воронку). Электрон, находящийся в этой |
|
||||||||||||||
|
|
|
|||||||||||||
яме, обладает отрицательной потенциальной энергией. |
|
Рис.3. |
|
||||||||||||
|
Запишем амплитудное уравнение Шредингера для |
|
|
||||||||||||
|
|
|
|
||||||||||||
электрона в водородоподобном атоме: |
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
. |
|
|
(21) |
|
|
|
|
|
В силу сферической симметрии потенциальной |
|
r |
y |
|||||||||||
энергии можно ожидать, что решение рассматриваемой |
|
||||||||||||||
задачи окажется наиболее простым в сферической |
|
|
|
||||||||||||
системе координат |
(рис.4 ), в которойположение частицы |
x |
|
|
|||||||||||
задается расстоянием r от начала координат и углами 4 и |
Рис.4. |
|
|||||||||||||
M. Записав оператор Лапласа в сферической системе |
|
|
|||||||||||||
|
|
|
|||||||||||||
координат, получим в этой же системе и уравнение |
|
|
|
||||||||||||
Шредингера: |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
. |
(22) |
|
|
Следует |
сказать, |
что даже в сферической системе координат полное |
|||||||||||||||||||||
решение данной задачи оказывается чрезвычайно громоздким. Поэтому в дальнейшем мы |
|||||||||||||||||||||||||
рассмотрим лишь некоторые частные решения, а также выводы, |
вытекающин из полного |
||||||||||||||||||||||||
решения. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Первый вывод состоит в том, |
|
|
что электрон в водородоподобном атоме может |
||||||||||||||||||||||
находиться только в определенных состояниях, |
которым соответствует дискретный ряд |
||||||||||||||||||||||||
значений его энергии Е, определяемых из уравнения |
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(23) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
подстановкой в него значений главного квантового числа |
n=1, 2, 3,.. |
|
|||||||||||||||||||||||
Второй |
вывод: |
орбитальный момент количества движения L электрона может |
|||||||||||||||||||||||
принимать лишь следующий ряд дискретных значений |
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
, |
|
|
|
|
|
|
|
|
|
|
(24) |
|
|
|
|
|
|
где |
|
- орбитальное квантовое |
число, |
которое может принимать любое значение |
|||||||||||||||||||||
из следующего ряда |
|
|
|
|
|
|
|
. |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Третий |
вывод: |
вектор орбитального момента количества движения может |
|||||||||||||||||||||||
ориентироваться относительно вектора напряженности внешнего магнитного поля |
|
||||||||||||||||||||||||
лишь так, |
что его проекция на направление |
вектора |
может быть только кратной |
||||||||||||||||||||||
величине |
|
, т.е. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
. |
|
|
|
|
|
|
|
|
|
|
|
(25) |
|
|
|
|
|
||
Число |
называется магнитным квантовым числом. |
Оно может принимать все |
|||||||||||||||||||||||
целочисленные значения от |
до |
, включая |
0: |
|
|
|
|
|
|
|
|
||||||||||||||
всего |
|
значений. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
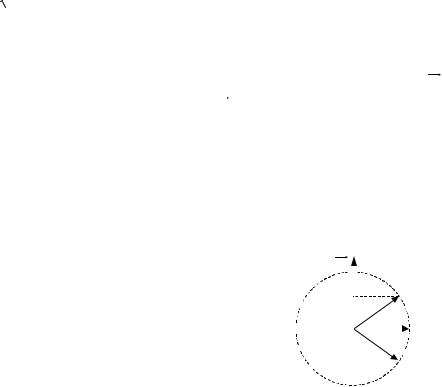
Пусть |
, |
тогда |
|
|
|
, |
|
т.е. имеет три значения, |
|
|
|
|
|
||||||||||||
тогда вектор орбитального момента количества движения |
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|||||||||||||||||||||
ориентирован так, как показано на рис.5. |
|
|
|
|
|
|
|
|
|
|
|
|
1 |
||||||||||||
Таким |
образом, |
состояние |
|
электрона |
в |
|
|
|
|
||||||||||||||||
|
|
0 |
|
|
0 |
||||||||||||||||||||
водородоподобном атоме определяется тремя квантовыми |
|
|
|
||||||||||||||||||||||
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|||||||||||||||||||||
числами |
– |
главным квантовым числом |
|
n, |
характеризующим |
|
|
|
|
-1 |
|||||||||||||||
энергию |
Еn , |
орбитальным |
- |
характеризующим величину |
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|||||||||||||||||||||
орбитального |
момента |
количества |
|
движения |
электрона, |
и |
|
|
|
|
|
||||||||||||||
|
|
Рис.5 |
|
||||||||||||||||||||||
магнитным |
|
- |
характеризующим |
|
|
|
ориентацию |
вектора |
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||
орбитального момента количества движения относительно направления внешнего |
|||||||||||||||||||||||||
магнитного поля. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Однако не все экспериментальные данные согласуются с приведенной выше |
|||||||||||||||||||||||||
теорией. |
Так, |
например, |
в спектрах щелочных металлов существуют так называемые |
||||||||||||||||||||||
дублеты |
– |
группы из двух близко расположенных спектральных линий, существование |
|||||||||||||||||||||||
которых не вытекает из решения уравнения Шредингера. |
|
|
|
|
|
|
|||||||||||||||||||
Для объяснения этого явления в 1925 |
году Гаудсмитом и Уленбеком была |
||||||||||||||||||||||||
выдвинута гипотеза о существовании у электрона собственного момента количества |
|||||||||||||||||||||||||
движения. |
Первоначально предполагалось, |
что этот момент существует благодаря |
|||||||||||||||||||||||
вращению электрона вокруг собственной оси. |
Поэтому он получил название спина (от |
||||||||||||||||||||||||
английского «spin» - вращение, |
веретено). Однако с точки зрения квантовой механики |
||||||||||||||||||||||||
такое представление о спине неверно. |
Подобно массе и заряду, спин является первичным, |
||||||||||||||||||||||||
неотъемленным свойством электрона |
|
(и других частиц), |
не |
имеющий аналогов |
в |
||||||||||||||||||||
макромире. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||

|
|
На основании экспериментальных результатов доказано, что спин электрона по |
||||||||||||||||||||||||||||||||
абсолютной величине равен: |
, |
|
|
|
|
|
|
|
|
(26) |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
а его проекция на направление внешнегомагнитного |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
поля |
|
(рис.6) может иметь лишь два значения |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(27) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
или |
|
|
, |
|
|
|
|
где |
|
|
называется спиновым |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
квантовым числом, |
которое у |
|
электрона может принимать |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
лишь два значения: |
|
и |
- |
|
|
. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
Итак, с учетом |
|
наличия у электрона |
|
спина |
его |
|
|
|
|
|
|
|
|
|
Рис.6. |
|
||||||||||||||||
состояние в водородоподобном атоме задается четырьмя |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
квантовыми |
числами: |
|
|
главным |
|
, |
орбитальным |
, |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
магнитным |
и спиновым |
|
. Энергия же электрона, зависит лишь от значения . |
|
||||||||||||||||||||||||||||||
|
|
Если одному и тому же значению энергии |
(энергетическому уровню) |
соответствует |
||||||||||||||||||||||||||||||
несколько независимых решений волнового уравнения, |
то говорят, |
что имеется |
||||||||||||||||||||||||||||||||
вырождение |
этого энергетического уровня. Кратность вырождения определяют числом |
|||||||||||||||||||||||||||||||||
таких решений. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
В 1925 году Паули установил |
квантовомеханический закон, |
|
названный принципом |
|||||||||||||||||||||||||||||
Паули или принципом исключения. |
|
Он гласит: в любом атоме не может быть двух |
||||||||||||||||||||||||||||||||
электронов, находящихся в двух одинаковых стационарных состояниях, определяемых |
||||||||||||||||||||||||||||||||||
набором четырех квантовых чисел: главного |
|
|
, |
орбитального |
|
|
, магнитного |
и |
||||||||||||||||||||||||||
спинового . |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
Применительно к системе электронов в атоме принцип Паули можно записать |
||||||||||||||||||||||||||||||||
следующим образом: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
или |
1, |
|
|
|
|
|
|
(28) |
|
|
|
|||||||
|
|
где |
|
|
|
|
|
- |
|
число электронов находящихся в состоянии, |
описываемом |
|||||||||||||||||||||||
набором квантовых чисел |
|
|
|
|
|
. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
Пользуясь |
принципом Паули, |
можно найти максимальное число электронов в |
||||||||||||||||||||||||||||||
атоме, имеющих заданные значения трех |
( |
|
|
), |
двух |
( |
) и одного ( |
) квантовых |
||||||||||||||||||||||||||
чисел. |
Найдем максимальное число |
|
|
|
|
электронов, находящихся в состояниях, |
||||||||||||||||||||||||||||
определяемых набором трех квантовых чисел |
|
( |
), |
т.е. |
|
|
отличающихся лишь |
|||||||||||||||||||||||||||
ориентацией спинов электронов. Так как число |
|
|
может принимать лишь два значения, |
|||||||||||||||||||||||||||||||
т.е. |
|
|
, то имеем |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(29) |
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
Вычислим |
далее |
максимальное |
число |
|
электронов |
|
|
|
|
|
|
|
, |
|
находящихся |
в |
||||||||||||||||
состояниях, |
определяемых двумя квантовыми числами: |
и |
. |
|
Так |
|
как при заданном |
|||||||||||||||||||||||||||
числовом значении |
вектор орбитального момента количества движения |
может иметь |
||||||||||||||||||||||||||||||||
( |
|
|
) различных ориентаций в пространстве, |
то число электронов равно |
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
. |
|
|
|
|
|
|
|
|
|
(30) |
|
|
|
|||||
|
|
|
|
Значения |
|
|
|
|
|
|
для разных |
приведены в таблице 1. |
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 1 |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
Значения орбитальногоквантового числа |
|
|
|
0 |
|
1 |
|
|
2 |
|
3 |
4 |
|
|
|
|
||||||||||||||
|
|
Символ соответствующегосостояния электронов |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
Максимальное число электронов |
|
|
|
|
|
|
2 |
|
6 |
|
|
10 |
|
14 |
18 |
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
Наконец, |
найдем, |
пользуясь принципом Паули, |
максимальное |
число |
|
|||||||||||||||||||||||||
электронов, находящихся в состояниях, определяемых значением |
|
главного квантового |
||||||||||||||||||||||||||||||
числа (или кратность вырождения). Так как |
при заданном |
|
изменяется от |
0 до |
, то |
|||||||||||||||||||||||||||
суммируя |
|
по от 0 до |
, получим |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(31) |
|
||
|
|
В |
таблице |
2, |
составленной на основе предыдущих формул, |
приведены |
||||||||||||||||||||||||||
максимальные числа электронов, обладающих в атоме заданными значениями квантовых |
||||||||||||||||||||||||||||||||
чисел. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 2 |
|
|||
|
Заданные квантовыечисла |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
Максимальное число электронов |
|
|
|
1 |
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
В таблице |
3 |
приведены максимальные числа электронов, находящихся в |
||||||||||||||||||||||||||
состояниях, характеризуемых данными значениями |
и . |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 3 |
|
|||
|
|
|
|
Слой |
|
Число электронов в состояниях |
|
|
Максимальное число |
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
электронов |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
K |
|
2 |
|
|
- |
|
- |
|
- |
|
- |
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
||
|
|
|
|
L |
|
2 |
|
|
6 |
|
- |
|
- |
|
- |
|
|
|
|
|
|
|
|
8 |
|
|
|
|
|
|
||
|
|
|
|
M |
|
2 |
|
|
6 |
|
10 |
|
- |
|
- |
|
|
|
|
|
|
|
|
18 |
|
|
|
|
|
|
||
|
|
|
|
N |
|
2 |
|
|
6 |
|
10 |
|
14 |
|
- |
|
|
|
|
|
|
|
|
32 |
|
|
|
|
|
|
||
|
|
|
|
O |
|
2 |
|
|
6 |
|
10 |
|
14 |
|
18 |
|
|
|
|
|
|
|
|
50 |
|
|
|
|
|
|
||
|
|
|
|
Принцип Паули сыграл выдающуюся роль в развитии современной атомной |
||||||||||||||||||||||||||||
и ядерной физики. |
Так, |
например, |
удалось теоретически обосновать периодическую |
|||||||||||||||||||||||||||||
систему элементов |
Менделеева. |
Без принципа Паули невозможно было бы создать |
||||||||||||||||||||||||||||||
квантовые статистики и современную теорию твердых тел. |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
