
- •ВВЕДЕНИЕ
- •1. ХИМИЧЕСКАЯ КИНЕТИКА
- •1.1. Основные понятия и определения
- •1.2. Основной постулат химической кинетики
- •1.3. Формальная кинетика
- •1.4. Некоторые методы определения порядка реакции
- •1.5. Влияние температуры на скорость химической реакции
- •1.6. Методы расчета энергии активации
- •2. КАТАЛИЗ
- •2.1. Основные понятия и определения
- •2.2. Теория промежуточных соединений в катализе
- •2.3. Термодинамические и кинетические аспекты каталитических процессов
- •2.4. Гомогенный катализ. Простейшие механизмы гомогенных каталитических реакций
- •2.5. Гетерогенный катализ
- •3. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
- •5. ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
- •ЛИТЕРАТУРА
- •ОГЛАВЛЕНИЕ
лической решетки катализатора, и находящиеся в соответствии с геометрией реагирующих молекул, называют мультиплетами. В
зависимости от строения мультиплета он может ослаблять те или иные связи в различной степени, чем объясняется высокая специфичность катализатора.
Общим для всех существующих теорий является представление об активных центрах — активных участках на поверхности катализатора. Различие теорий заключается во взглядах на природу поверхностных соединений и на природу активных центров поверхности катализатора, участвующих в образовании поверхностных соединений. Рассмотрение основных положений перечисленных теорий выходит за рамки данного пособия, так же, как и рассмотрение формальной кинетики сложных реакций.
3.ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
3.1.Лабораторная работа «Кинетика разложения комплексного иона
триоксалата марганца»
Цели работы: 1) определить среднее значение константы скорости реакции двумя методами при различных значениях температуры; 2) рассчитать энергию активации реакции графическим и аналитическим методами; 3) определить время полупревращения при трех значениях температуры.
Уравнение реакции разложения комплексного иона триоксалата марганца имеет вид
[Mn(C2O4)3]3− = Mn+2 +2,5(C2O4)3− +CO2
Так как комплексный ион триоксалата марганца окрашен, а продукты реакции бесцветны, для изучения скорости реакции применяют фотометрический метод, основанный на использовании закона Бугера — Ламберта — Бера:
I = I0е−εCl |
(50) |
|||
или |
|
|
|
|
lg |
I0 |
= εCl, |
(51) |
|
I |
||||
|
|
|
||
34
где I0 и I — интенсивность соответственно падающего и прошедшего через раствор света; C — молярная концентрация раствора; l — толщина слоя; ε — молярный коэффициент поглощения света.
Оптическая плотность раствора |
|
||
D = lg |
I0 |
. |
(52) |
|
|||
|
I |
|
|
Подставив уравнение (52) в уравнение (51), получим соотношение
D = εCl, |
(53) |
из которого следует, что при постоянной толщине слоя оптическая плотность прямо пропорциональна концентрации раствора. Молярный коэффициент поглощения ε равен оптической плотности раствора при значениях C = 1 M и l = 1 см.
Изучаемая реакция, несмотря на сложный механизм, является реакцией первого порядка (А → В +С), скорость которой равна
dCA |
|
|
|
(54) |
|||
− |
|
|
|
= kCA. |
|||
dt |
|||||||
Интегрируя уравнение (54), получаем |
|
||||||
k = |
1 |
ln |
C0A |
, |
(55) |
||
|
|
||||||
|
|
t |
|
CA |
|
||
где C0A и CA — начальная и текущая концентрации комплексного триоксалата марганца.
Используя уравнение (53) и заменяя в уравнении (55) концентрации соответствующими величинами оптической плотности,
преобразуем уравнение (55) к виду |
|
|
|
||
k = |
1 |
ln |
D0 |
, |
(56) |
|
D |
||||
|
t |
|
|
||
где D0 и D — оптическая плотность раствора комплексного иона триоксалата марганца соответственно в начальный момент времени и в момент времени t. Следовательно, для вычисления константы скорости реакции при данной температуре необходимо измерить оптическую плотность исходного раствора и найти ее изменение во времени.
Константу скорости реакции при различных значениях температуры можно рассчитать двумя методами.
35
Аналитический метод. Берут значения оптической плотности D для трех-пяти моментов времени при данной температуре и по уравнению (56) определяют константу скорости реакции, а затем рассчитывают ее среднее значение.
Графический метод. Строят график в координатах lnD = f(t). Уравнение (56) можно представить в виде
lnD = lnD0 −kt. |
(57) |
Это уравнение прямой линии, которое применяют для расчета константы скорости реакции по тангенсу угла наклона прямой k = −tg ϕ (см. рис. 3).
Константу скорости реакции при данной температуре определяют для трех-пяти моментов времени, а затем рассчитывают среднее ее значение. Полученные значения констант скорости реакции при трех значениях температуры используют для определения энергии активации Ea по уравнению Аррениуса (см. подразд. 1.6).
Затем рассчитывают время полупревращения t1/2 для каждого
значения температуры по формуле |
|
|||||
t |
= |
ln2 |
= |
0,693 |
. |
(58) |
|
|
|||||
1/2 |
|
k |
|
k |
|
|
|
|
|
|
|||
3.1.1.Порядок выполнения работы
Вэкспериментальной части лабораторной работы используется измерительная система «L-микро», которая представляет собой комплект датчиков, подключенных к компьютеру через измерительный блок. Датчики обеспечивают cбор количественной информации и преобразуют измеряемые параметры в напряжение. Компьютерный измерительный блок преобразует напряжение на выходе датчика в сигнал, который может быть прочитан компьютером. Компьютер пересчитывает сигнал, поступивший с измерительного блока, в значение измеряемого параметра по заданной программе, которая разбита на сценарии в зависимости от используемого набора датчиков.
При выполнении лабораторной работы используют датчик оптической плотности с синим светофильтром ( λ = 475 нм). Что-
36
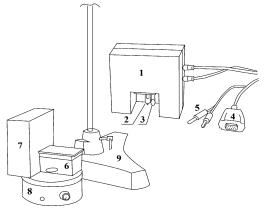
бы изучить кинетику реакции при различных значениях температуры, применяют термостатирующее устройство для оптической кюветы с блоком питания, подключаемое к измерительному блоку компьютера.
Оборудование: компьютер с измерительным блоком, датчик оптической плотности (λ = 475 нм) с синим светофильтром, термостатирующее устройство с блоком питания, кювета, магнитная мешалка, мерные цилиндры на 100 мл и 10 мл, шприц на 5 мл.
Реактивы: 0,01 М раствор KMnO4; 0,1 M раствор MnSO4; 0,1 M раствор H2C2O4.
1. Собрать установку (рис. 12). Для этого к первому разъему измерительного блока подключить датчик оптической плотности, а к третьему разъему — термостатирующее устройство.
Рис. 12. Схема установки:
1 — термостатирующее устройство; 2 — нагреватель; 3 — термочувствительный элемент; 4 — pазъем для подключения к компьютерному блоку; 5 — штекеры для подключения к блоку питания; 6 — оптическая кювета; 7 — датчик оптической плотности; 8 — магнитная мешалка; 9 — штатив
2.Поставить оптическую кювету на магнитную мешалку, надеть на нее термостатирующее устройство и датчик оптической плотности.
3.В меню программы «L — Химия — Практикум» выбрать сценарий «РМС Кинетика 2» → «Зависимость скорости реакции от
37
температуры» (по оптической плотности) →«Датчики» → «Oптическая плотность» (один датчик).
4.Произвести настройку датчика оптической плотности. Для этого в кювету налить 80 мл дистиллированной воды и включить магнитную мешалку. Войти в меню «Настройка оборудования». Программа предложит измерить уровень фоновой засветки приемника излучения. Для этого нужно перекрыть источник света, введя через щель в задней стенке полоску непрозрачной черной бумаги, и через 2...3 с нажать экранную кнопку «Далее». Затем программа предложит ввести значение напряжения на чувствительном элементе при полном пропускании (отсутствии поглощения) света. Нужно снова нажать экранную кнопку «Далее», после чего в окне появится значение напряжения при полном пропускании света. Если это значение лежит в диапазоне 3...7 В, следует опять нажать экранную кнопку «Далее», после чего настройка оборудования будет закончена.
5.Войти в окно «Проведение измерений». В окне появится экран с системой координат. По оси ординат отложить значения оптической плотности раствора, по оси абсцисс — время. Таким образом, в процессе разложении комплексного иона на экране отображается полученная экспериментально кинетическая кривая
D = f(t). Регистрация данных и вывод их на график производят с момента включения кнопки «Пуск» и останавливают кнопкой «Стоп».
6. Кинетические кривые снимают при трех значениях температуры: 25, 35, 45 ◦С. Первый опыт следует провести при комнатной температуре, предварительно выключив блок питания термостата. Для этого нужно вылить из оптической кюветы дистиллированную воду и налить в нее 70 мл 0,1 М раствора щавелевой кислоты Н2С2О4 и 10 мл 0,1 М раствора MnSO4, затем включить магнитную мешалку. Далее нужно отобрать шприцом 2,5 мл 0,01 М раствора KMnO4, вылить раствор в кювету и одновременно включить процесс измерений, нажав экранную кнопку «Пуск».
Когда оптическая плотность раствора достигнет значений, близких к 0,1, oпыт следует прекратить. После окончания опыта необходимо остановить измерения, нажав экранную кнопку «Х», затем кнопку «Стоп», затем кнопку «Архив». После этого появит-
38
ся стандартное окно сохранения файлов Windows. Данные нужно сохранить на диске D, присвоив файлу соответствующее имя.
7.Вылить содержимое кюветы. Ополоснуть кювету и якорь для магнитной мешалки дистиллированной водой и протереть стенки кюветы фильтровальной бумагой.
8.Провести второй опыт при температуре 35 ◦С. Налить в кювету 70 мл 0,1 М раствора Н2С2О4, 10 мл 0,1 М раствора MnSO4
ивключить магнитную мешалку. Настроить термостат на нужный диапазон значений температуры, включить блок питания термостата, установить напряжение 10 В и перейти в окно измерений. При этом лампа термостата включается (загорается лампа-нагреватель). Когда раствор нагреется до нужной температуры, лампа выключится. Тогда нужно набрать в шприц 2,5 мл 0,01 М раствора KMnO4, вылить его в кювету и одновременно нажать экранную кнопку «Пуск». После этого нужно переключить напряжение на блоке питания термостата на 4,5 В, чтобы свет от лампы не мешал измерению оптической плотности раствора. По окончании измерений питание термостата выключить.
9.Аналогично провести третий опыт при температуре 45 ◦С.
3.1.2. Обработка результатов
Обработка результатов проводится по любой стандартной программе, например c использованием Microsoft Excel.
1.Открыть файлы с результатами измерений. В них содержатся три столбца значений: 1) время; 2) оптическая плотность раствора;
3)температура.
2.В каждом файле, используя программу «Мастер диаграмм», построить кинетическую кривую — зависимость оптической плотности раствора от времени при всех исследуемых значениях температуры: D = f(t).
3.По формуле (56) рассчитать константу скорости реакции k при каждом значении температуры для трех—пяти моментов времени, а затем определить среднее значение константы.
4.Рассчитать константу скорости реакции графическим методом. Для этого построить график в координатах lnD = f(t) и по тангенсу угла наклона полученной прямой определить константу
39

скорости реакции: k = −tg(ϕ) при данной температуре для трех— пяти моментов времени, затем определить среднее значение константы.
5.Построить график в координатах Аррениуса lnk = f(1/Т). Рассчитать энергию активации Eа и предэкспоненциальный множитель Z, используя уравнение (43) (см. подразд. 1.6).
6.Определить энергию активации аналитическим методом по формуле (46) (см. подразд. 1.6). Сравнить результаты, полученные двумя методами.
3.2. Лабораторная работа «Кинетика каталитического разложения
пероксида водорода»
Цели работы: 1) используя метод графического дифференцирования, рассчитать начальные скорости реакции каталитического разложения пероксида водорода; 2) определить порядок реакции по Н2О2 и по катализатору (дихромат калия K2Cr2O7).
Пероксид водорода в водных растворах самопроизвольно медленно разлагается на воду и кислород:
1 H2O2 = H2O+ 2O2
Энергия активации этой реакции составляет 75,6 кДж/моль. В присутствии катализатора (K2Cr2O7) скорость разложения резко увеличивается. Процесс разложения пероксида водорода упрощенно можно описать следующим образом. На первой стадии при взаимодействии K2Cr2O7 с H2O2 обратимо образуется промежуточное соединение:
2H2O2 +K2Cr2O7 K2Cr2O9 +2H2O
или в ионно-молекулярном виде:
2H2O2 +Cr2O27− Cr2O29− +2H2O
Образовавшийся на первой стадии ион Cr2O29− (промежуточное соединение) медленно распадается:
K2Cr2O9 → K2Cr2O7 +O2
40

или в ионно-молекулярном виде:
Cr2O29− → Cr2O27− +O2
В результате выделяется кислород и освобождается катализатор. Таким образом, дихромат калия K2Cr2O7 отвечает двум важнейшим требованиям к катализатору. Он ускоряет процесс распада пероксида водорода и в то же время после окончания процесса возвращается в исходное состояние и присутствует в растворе в той же концентрации.
Скорость реакции в целом определяется скоростью самой медленной (лимитирующей) стадии последовательных реакций. В данном случае вторая стадия процесса более медленная. Следовательно, она лимитирует процесс. Cкорость всего процесса разложения пероксида водорода в присутствии катализатора K2Cr2O7 прямо пропорциональна концентрации промежуточного соединения:
r = −d[Hdt2O2] = k[K2Cr2O9],
где k — константа скорости реакции (условно квадратными скобками обозначена концентрация веществ). Чтобы найти концен-
трацию промежуточного вещества, запишем выражение константы равновесия для первой стадии в виде
[K2Cr2O9]
K = [H2O2]2 ([K2Cr2O7]0 −[K2Cr2O9]),
где [K2Cr2O7]0 — начальная концентрация катализатора; ([K2Cr2O7]0 — [K2Cr2O9]) — концентрация катализатора после установления химического равновесия. Вода находится в большом избытке, поэтому в выражение для константы равновесия не входит. Из уравнения определяем концентрацию K2Cr2O9:
[K2Cr2O9] = |
K[H2O2]2 |
[K2Cr2O7]0 |
|||||
2 |
|||||||
|
|
|
|
1+K[H2O2] |
|||
Для скорости процесса разложения H2O2 получаем следующее |
|||||||
выражение: |
|
|
|
|
|
|
|
r = − |
d[H2O2 |
] |
= k |
K[H2O2]2 |
|||
|
|
|
[K2Cr2O7]0, |
||||
dt |
|
1+K[H2O2]2 |
|||||
41

где [H2O2] — концентрация неразложившегося пероксида водорода в данный момент времени; k — константа скорости реакции разложения промежуточного соединения; [K2Cr2O7]0 — начальная концентрация катализатора.
Из последнего уравнения следует, что скорость процесса при гомогенном катализе прямо пропорциональна первоначальной концентрации катализатора, а порядок реакции по пероксиду водорода может изменяться от нуля до двух в зависимости от условий проведения эксперимента. Возможны следующие предельные случаи.
1. Если K[H2O2]2 1, получаем
r= −d[Hdt2O2] = k[K2Cr2O7]0,
т.е. имеем нулевой порядок по H2O2.
2.Если K[H2O2]2 1, получаем
r = −d[Hdt2O2] = kK[H2O2]2[K2Cr2O7]0,
что соответствует второму порядку по H2O2.
3.2.1. Порядок выполнения работы
Оборудование: компьютер с измерительным блоком, датчик объема газа, двухколенная реакционная пробирка, мерные пипетки на 2 мл — 2 шт., мерная пипетка на 10 мл — 1 шт., химический стакан на 1 л.
Реактивы: 4,5 — 5,0 М раствор Н2О2, 1/6 М раствор K2Cr2O7. Работа выполняется на установке (рис. 13) с датчиком объема
газа и компьютерным измерительным блоком.
1.Подключить датчик объема газа к первому разъему компьютерного измерительного блока.
2.В меню программы «L — Химия — Практикум» выбрать сценарий «Кинетика 1 (газовая)» → «Кинетика выделения газа»
→«Без контроля температуры реакции». Войти в окно запуска эксперимента.
3.В большой химический стакан налить воду (cтакан с водой играет роль термостата).
42
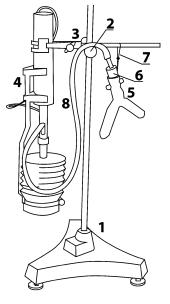
Рис. 13. Схема установки:
1 — штатив; 2 — муфта; 3 — лапка; 4 — датчик объема газа; 5 — двухколенная пробирка; 6 — пробка; 7 — проволочная петля; 8 — соединительный шланг
4.Для проведения первого опыта в одно колено двухколенной пробирки налить 3,2 мл раствора 5 М раствора Н2О2, в другое колено — 0,2 мл 1/6 М раствора дихромата калия K2Cr2O7.
5.Сжать датчик объема, чтобы объем газа был минимальным. Закрыть пробирку пробкой с трубкой, к которой подсоединен датчик объема газа. Нажать экранную кнопку «Настройка оборудования» и привести к нулю текущее значение объема.
6.Нажать экранную кнопку «Проведение измерений» и перейти в окно измерений.
7.Нажать экранную кнопку «Пуск» и одновременно опрокинуть пробирку, переливая раствор Н2О2 в колено с раствором K2Cr2O7 и обратно. Тщательно смешать растворы и сразу погрузить двухколенную пробирку с реакционной смесью в стакан с водой.
8.Проводить измерения до тех пор, пока объем выделяющегося газа не перестанет заметно изменяться.
43

9.Чтобы остановить измерения, нажать последовательно экранные кнопки «Х», «Стоп», «Архив». Появится стандартное окно сохранения файлов Windows. Данные нужно сохранить на диске D, присвоив файлу соответствующее имя.
10.Провести второй опыт, взяв 0,4 мл раствора K2Cr2O7 и 3 мл раствора 5 М раствора Н2О2.
11.Провести третий опыт, добавив к 1,5 мл раствора Н2О2 1,5 мл дистиллированной воды и взяв 0,4 мл раствора K2Cr2O7.
12.Обработать результаты измерений с использованием программы Microsoft Excel.
3.2.2. Обработка результатов
После проведения экспериментов результаты измерений записать в виде текстовых документов.
1.Открыть файл с экспериментальными данными. В нем в
первом столбце — время, с; во втором — объем выделившегося газа, см3; в третьем — температура, ◦С.
2.Используя программу «Мастер диаграмм», построить зависимость объема выделившегося кислорода от времени; распечатать графики.
3.Рассчитать начальную скорость реакции методом графического дифференцирования (см. рис. 1). Для этого провести касательную к начальному участку кинетической кривой. Тангенс угла наклона касательной равен скорости реакции по выделяющемуся кислороду. (Обратить внимание на то, что тангенс угла наклона прямой рассчитывается как отношение отрезков.)
4.Используя метод Вант-Гоффа (см. подразд. 1.4), определить
порядок реакции n по пероксиду водорода, сравнивая начальные скорости реакции при различных концентрациях Н2О2 (опыты 2
и3). Для расчета воспользоваться формулой
n = lgr2/r3 . lgC2/C3
(При расчете необходимо знать отношение концентраций, а не сами концентрации.)
5. Определить порядок реакции m по катализатору K2Cr2O7, сравнивая начальные скорости реакции при различных концентра-
44
циях катализатора (опыты 1 и 2). Расчет провести по формуле
m = |
lgr2 |
/r1 |
. |
lgCК2 |
|
||
|
/CК1 |
||
6. Проанализировать полученные результаты, используя теоретические данные.
4. ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ Пример 1. Для реакции между оксидом азота и водородом
2NO+2H2 → N2 +2H2O
при температуре 700 ◦С были получены следующие кинетические данные:
№ п/п |
Начальные концентрации, моль/л |
Начальные скорости, |
||
|
|
моль/(л·с) ×10−6 |
||
CNO0 |
CH20 |
|||
|
||||
1 |
0,025 |
0,01 |
2,4 |
|
|
|
|
|
|
2 |
0,025 |
0,005 |
1,2 |
|
|
|
|
|
|
3 |
0,0125 |
0,01 |
0,6 |
|
|
|
|
|
|
Вычислить порядок реакции по каждому реагенту и константу скорости реакции.
Решение 1. Для расчета порядка реакции по NO применим метод Вант-Гоффа. Воспользуемся данными опытов 1 и 3, когда начальные концентрации водорода одинаковы. Тогда можем записать:
nNO = |
lg(r01/r03) |
|
= |
lg(2,4/0,6) |
|
= |
lg4 |
|
= |
0,6 |
= 2. |
|
lg(CNO01/CNO03) |
lg(0,025/0,0125) |
lg2 |
0,8 |
|||||||||
|
|
|
|
|
||||||||
2. Для расчета порядка реакции по водороду воспользуемся аналогичным методом и данными опытов 1 и 2, когда концентрация NO постоянна. Тогда имеем
n |
= |
lg(r01 |
/r02) |
|
= |
lg(2,4/1,2) |
= |
lg2 |
|
= 1. |
|||
lg(C |
|
|
/C |
|
|
lg(0,01/0,005) |
lg2 |
||||||
H2 |
|
H2 |
01 |
02 |
) |
|
|
||||||
|
|
|
H2 |
|
|
|
|
|
|
|
|||
45

Таким образом, кинетическое уравнение имеет вид
r = kCNO2 CH2.
Чтобы рассчитать константу скорости реакции, можно восполь-
зоваться результатами одного из опытов, например первого. Пример 2. Для элементарной реакции A + B = D + F при на-
чальных концентрациях реагентов С0А = С0В = 0,6 моль/л через 20 мин после начала реакции концентрация вещества А уменьшилась до значения СА1 = 0,4 моль/л. Определить константу скорости
и концентрацию вещества А через 60 мин после начала реакции. Решение. Поскольку данная реакция элементарная, то это реак-
ция второго порядка. При равных начальных концентрациях реагентов для реакции второго порядка решение дифференциального
уравнения |
|
|
|
|
|
|
|
|
|
dCA |
|
||||
|
− |
|
|
|
= kCA2 |
||
|
dt |
||||||
приводит к следующему результату: |
|
||||||
1 |
|
1 |
|
|
|||
|
|
− |
|
|
= kt. |
||
|
CA |
C0A |
|||||
Выразим из этого уравнения константу скорости и текущую концентрацию:
k = |
1 |
C0A −CA |
; CA = |
C0A |
. |
|
|
||||
|
t C0ACA |
1+C0Akt |
|||
Вычислим константу скорости по заданным условиям:
k = |
1 |
0,6−0,4 |
= 0,0417 |
л |
. |
|
моль ·мин |
||||
|
20 0,6·0,4 |
|
|
||
Далее вычисляем концентрацию вещества А через 60 мин после начала реакции:
CA2 = |
0,6 |
= 0,24 |
моль |
|
|
|
. |
||
1+0,6·0,0417·60 |
л |
|||
Пример 3. Применение катализатора при температуре T1 = = 400 ◦С позволяет уменьшить энергию активации химической реакции A → B от Еа1 = 140 кДж/моль до Еа2 = 90 кДж/моль. Задание: а) оценить, во сколько раз увеличится константа скорости каталитической реакции по сравнению с константой скорости
46

некаталитической реакции при данной температуре в предположении равенства предэкспоненциальных множителей; б) рассчитать, при какой температуре некаталитическая реакция протекала бы с той же скоростью, что и каталитическая реакция при температуре 400 ◦С.
Решение. а) Запишем уравнение Аррениуса для констант скоростей обеих реакций:
k1 = k01e−Ea1/RT1, k2 = k02e−Ea2/RT1.
Если пренебречь влиянием катализаторов на предэкспоненциальный множитель (k01 = k02), то отношение констант скоростей можно представить в виде
k2 |
|
k02 e−Ea2 |
/RT |
|
e−Ea2 |
/RT |
|||||||
|
= |
|
|
|
|
|
|
≈ |
|
|
|
|
≈ e(Ea1−Ea2)/RT . |
k |
k |
|
e |
− |
Ea1 |
/RT |
e |
− |
Ea1 |
/RT |
|||
1 |
01 |
|
|
|
|
|
|
|
|
|
|||
Вычисления приводят к следующему результату:
k2 |
|
140000−90000 |
8,94 |
|
|
≈ e |
8,314·298 ≈ e |
|
≈ 7601. |
k1 |
|
б) Найдeм температуру, при которой k1 = k2. Запишем выражения для констант скоростей:
k01e−Ea1/RT1 = k02e−Ea2/RT2.
Учитывая, что k01 = k02 и основания степенных выражений равны, получим
Ea1 = Ea2 .
RT1 RT2
Рассчитываем температуру T2:
T2 = Ea2T1 ;
Ea1
T2 = 90000·673 = 432,6 K(159,6◦C). 140000
47
