
- •ВВЕДЕНИЕ
- •1. ХИМИЧЕСКАЯ КИНЕТИКА
- •1.1. Основные понятия и определения
- •1.2. Основной постулат химической кинетики
- •1.3. Формальная кинетика
- •1.4. Некоторые методы определения порядка реакции
- •1.5. Влияние температуры на скорость химической реакции
- •1.6. Методы расчета энергии активации
- •2. КАТАЛИЗ
- •2.1. Основные понятия и определения
- •2.2. Теория промежуточных соединений в катализе
- •2.3. Термодинамические и кинетические аспекты каталитических процессов
- •2.4. Гомогенный катализ. Простейшие механизмы гомогенных каталитических реакций
- •2.5. Гетерогенный катализ
- •3. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
- •5. ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
- •ЛИТЕРАТУРА
- •ОГЛАВЛЕНИЕ
2.4. Гомогенный катализ. Простейшие механизмы гомогенных каталитических реакций
Основным положением теории каталитических процессов является представление об образовании неустойчивых промежуточных соединений катализатора с реагирующими веществами. Для описания механизма каталитических реакций в настоящее время используют два подхода. Один из них соответствует слитной (одностадийной) схеме катализа, другой — стадийной (раздельной)
схеме катализа.
Согласно слитной схеме катализа некаталитическая реакция типа
А+В → Р
вприсутствии катализатора К проходит по схеме
А+В +К → (АВК)= → Р +К
Здесь (АВК)= — активированный комплекс исходных веществ и катализатора. В присутствии катализатора этот процесс проходит в одну стадию, и скорость его описывается кинетическим уравнением
r = kCACBCК.
Энергетическая диаграмма каталитической реакции, протекающей по слитному механизму, представлена на рис. 9. Из рисунка следует, что в присутствии катализатора процесс протекает с мень-
шей энергией активации.
Чаще каталитические реакции протекают по стадийной схеме. В соответствии с этой схемой вещества (реагенты) последовательно взаимодействуют с катализатором, образуя на каждой стадии соответствующий активированный комплекс:
1)А +К (АК)= → АК
2)АК +В → (АВК)= → Р +К
Согласно записанным уравнениям промежуточное соединение АК может превратиться в исходное вещество и катализатор по обратной реакции с константой скорости k−1 или в продукт реакции Р по второй реакции (с константой скорости k2). Соответствующая энергетическая диаграмма представлена на рис. 10. Она характеризуется несколькими максимумами и минимумами.
28
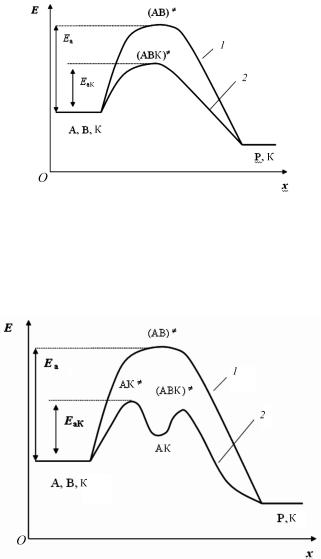
Рис. 9. Энергетическая диаграмма гомогенной каталитической реакции, протекающей по слитному механизму:
1 — некаталитический процесс; (АВ)= — активированный комплекс некаталитической реакции; Еa — энергия активации некаталитической реакции; 2 — каталитический процесс; (АВК)= — активированный комплекс каталитической реакции; ЕaК — энергия активации каталитической реакции; x — координата реакции
Рис. 10. Энергетическая диаграмма гомогенной каталитической реакции, протекающей по стадийному механизму:
1 — некаталитическая реакция; 2 — каталитическая реакция; AВ= — активированный комплекс некаталитической реакции; АК=, AВК= — активированные комплексы каталитической реакции
29

Для вывода уравнения скорости реакции предположим, что
концентрация промежуточного вещества (АК) быстро достигает нужного постоянного значения (метод квазистационарных концентраций), поэтому суммарную скорость образования вещества
АК можно принять равной нулю. Таким образом, имеем
dCdtAК = k1CACК −k−1CAК −k2CAКCB = 0;
|
CAК = |
|
k1CACК |
|
; |
|
|
|||
|
k |
−1 |
+k C |
|
|
|||||
|
|
B |
|
|||||||
|
|
|
2 |
|
||||||
dCP |
= k2CAКCB = |
k1k2CACBCК |
. |
(47) |
||||||
dt |
|
|||||||||
|
|
|
|
k |
−1 |
+k C |
|
|||
|
|
|
|
|
|
|
2 B |
|
||
Уравнение (47) характеризует скорость реакции в любой момент времени, выраженную через текущие значения концентрации веществ. Как и для процесса, протекающего по слитному механизму, скорость каталитической реакции, протекающей по стадийной схеме, прямо пропорциональна концентрации катализатора, что согласуется с результатами эксперимента.
Обычно рассматривают два варианта анализа, к которым при-
водит уравнение (47).
Вариант Аррениуса. Этот вариант отвечает условию, когда константа скорости распада активированного комплекса (АК)= на исходные вещества значительно больше константы скорости обра-
зования продуктов реакции (k−1 k2): |
|
||||
|
dCP |
= |
k1k2CACBCК |
= k2KCCA ·CBCК, |
(48) |
|
dt |
k−1 |
|||
где KC = k1/k−1 — константа равновесия. Таким образом, ско-
рость реакции определяется скоростью второй стадии процесса. Вариант Вант-Гоффа. В этом случае скорость распада акти-
вированного комплекса (АК)= на исходные вещества значительно меньше константы скорости второй стадии образования продуктов реакции (k−1 k2), что соответствует образованию непрочного активированного комплекса. Тогда общее уравнение скорости каталитической реакции переходит в следующее:
dCP |
= k1CACК, |
(49) |
|
dt |
|||
|
|
30
т. е. скорость реакции определяется скоростью первой стадии процесса.
Отметим, что обычно механизмы каталитических процессов значительно сложнее рассмотренных.
Обе приведенные схемы отражают общую и характерную особенность механизма каталитических реакций, а именно — его цикличность. В каталитических реакциях один и тот же активный центр или одна и та же молекула катализатора может многократно (103 −1011 раз) вступать в химическое взаимодействие с молекулой реагента.
2.5.Гетерогенный катализ
Вгетерогенном катализе реагирующие вещества и катализатор находятся в разных фазах. Наиболее часто катализатор представляет собой твердое вещество, а реагенты являются газами или жидкостями. Реакция протекает на поверхности катализатора. Следовательно, активность катализатора зависит от свойств его поверхности (площадь, химический состав поверхностного слоя, его структура).
Гетерогенные каталитические процессы очень сложны. В общем случае как минимум можно выделить шесть стадий каталитического процесса.
1. Диффузия реагирующих веществ к поверхности катализатора (внешняя диффузия).
2. Диффузия реагирующих веществ в поры катализатора (внутренняя диффузия).
3. Адсорбция по крайней мере одного из реагентов на поверхности катализатора.
4. Химическое превращение на поверхности катализатора (которое может происходить в несколько стадий).
5. Десорбция продуктов реакции с поверхности катализатора.
6. Диффузия продуктов реакции от поверхности катализатора
вобъем системы.
Стадией, лимитирующей скорость каталитической реакции, может быть любая стадия. Однако чаще, особенно при использовании пористых катализаторов, наиболее медленной стадией является диффузия реагентов к поверхности катализатора или
31
диффузия продуктов реакции от поверхности катализатора в объем системы.
Гетерогенный катализ является одним из важнейших разделов физической химии. Успехи в его развитии зависят от прогресса не только в химической кинетике, но и в других областях, в частности в теории поверхностных явлений, теории диффузии, физике твердого тела, гидродинамике и т. д. Многие практически важные процессы идут только в условиях гетерогенного катализа (например, синтез аммиака из водорода и азота на железном катализаторе, крекинг углеводородов на алюмосиликатных катализаторах и т. д.).
Врезультате взаимодействия реагентов с гетерогенным катализатором на его поверхности образуются реакционноспособные промежуточные соединения. Например, на металлических поверхностях образуются соединения типа Ni–H, Pt–H и т. д. Катализатор активирует реагент, что облегчает протекание реакции. На границе раздела фаз реакции идут с б´ольшими скоростями при невысоких температурах.
Вгетерогенном катализе значительную роль играет адсорбция, так как каталитическая реакция протекает в поверхностном слое, поэтому обычно добиваются увеличения площади поверхности катализатора, например путем его дробления. Гетерогенные катализаторы используют в виде порошков, высокодисперсных тел, пористых зерен.
Установлено, что фактическое участие в каталитическом про-
цессе принимают только особые активные микроструктуры — активные центры, составляющие лишь небольшую часть общей по-
верхности катализатора. Ими могут быть ионы, атомы, расположенные на ребрах граней кристалла или в его вершинах, дефекты кристаллической структуры и т. д.
Так как в большинстве случаев адсорбция реагентов на поверхности катализаторов — процесс экзотермический, реакционная система в результате адсорбции переходит на более низкий энергетический уровень. Это является одной из причин уменьшения энергии активации процесса в случае гетерогенного катализа. Дело в том, что катализатор не просто уменьшает энергетический барьер реакции, а создает новые химические пути с иным энергетическим рельефом. На рис. 11 изображены энергетические
32
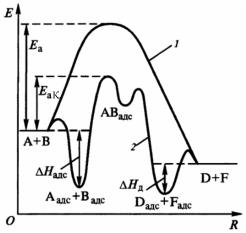
Рис. 11. Энергетические диаграммы реакции А + В = D + F, протекающей:
1 — без катализатора; 2 — с гетерогенным катализатором; Eа и EаК — энергия активации некаталитической и каталитической реакций; Hадс — энтальпия адсорбции; Hд — энтальпия десорбции
диаграммы для реакции А + В = D + F. От аналогичной энергетической диаграммы с участием гомогенного катализатора (см. рис. 10) диаграмма, представленная на рис. 11, отличается наличием энтальпий адсорбции и десорбции. Однако очень сильное адсорбционное взаимодействие молекул или слишком большое значение энтальпии десорбции может препятствовать протеканию процесса.
В настоящее время нет единой теории катализа. Для объяснения механизма гетерогенных каталитических реакций предложено несколько теоретических подходов: мультиплетная теория катализа
А.А.Баландина, теория активных ансамблей Н.И. Кобозева, электронная теория катализа Ф.Ф. Волькенштейна, теория цепных каталитических реакций, теория полупроводниковых катализаторов.
Так, согласно мультиплетной теории катализа, разработанной
А.А.Баландиным, между атомами в поверхностном слое катализатора и атомами реагирующей молекулы должно быть структурное и энергетическое соответствие. Отдельные участки поверхности катализатора, состоящие из нескольких атомов или ионов, расположенных закономерно в соответствии со строением кристал-
33
