
- •ВВЕДЕНИЕ
- •1. ХИМИЧЕСКАЯ КИНЕТИКА
- •1.1. Основные понятия и определения
- •1.2. Основной постулат химической кинетики
- •1.3. Формальная кинетика
- •1.4. Некоторые методы определения порядка реакции
- •1.5. Влияние температуры на скорость химической реакции
- •1.6. Методы расчета энергии активации
- •2. КАТАЛИЗ
- •2.1. Основные понятия и определения
- •2.2. Теория промежуточных соединений в катализе
- •2.3. Термодинамические и кинетические аспекты каталитических процессов
- •2.4. Гомогенный катализ. Простейшие механизмы гомогенных каталитических реакций
- •2.5. Гетерогенный катализ
- •3. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
- •5. ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
- •ЛИТЕРАТУРА
- •ОГЛАВЛЕНИЕ
изведению концентраций реагирующих веществ, возведенных в некоторые степени, определяемые экспериментально.
Размерность константы скорости k зависит от порядка реакции. Наряду с термином «порядок реакции» Я. Вант-Гофф ввел по-
нятие «молекулярность».
Молекулярность (м) определяется числом частиц, одновременно взаимодействующих в элементарном акте превращения. Молекулярность имеет ясный физический смысл, указывая на конкретное число частиц, участвующих в элементарной реакции. Она принимает целочисленные значения: м = 1, 2, 3, поскольку вероятность одновременного столкновения четырех и более молекул близка к нулю. Таким образом, существуют моно-, би- и тримолекулярные реакции. Понятие «молекулярность» применяется только к элементарным реакциям. Например, элементарная реакция 2NO + О2 → 2NO2 является тримолекулярной.
В отличие от молекулярности порядок реакции — математическое число, формальная величина, принимающая любые значения. В гомогенной среде порядок реакции обычно изменяется от 0,5 до 4,0. Этот термин используется для описания как простых, так и сложных реакций и, как правило, зависит от механизма сложной реакции.
Подавляющее большинство встречающихся на практике химических реакций являются сложными, многостадийными. Каждая стадия сложной реакции протекает с определенной скоростью.
Скорость любого многостадийного процесса определяется ско-
ростью самой медленной стадии. Самую медленную стадию сложной химической реакции называют лимитирующей стадией.
1.3. Формальная кинетика
Основной постулат химической кинетики и принцип независимости реакций лежат в основе теории формальной кинетики, зада-
чами которой являются установление количественной связи между скоростью реакции и концентрацией реагентов, а также выяснение механизма химической реакции.
Рассмотрим закономерности формальной кинетики для односторонних гомогенных реакций различных порядков.
9
Реакции нулевого порядка. Кинетическое уравнение для ре-
акции нулевого порядка имеет следующий вид: |
|
||
|
dC |
|
|
− |
|
= kC0. |
(11) |
dt |
|||
В результате интегрирования получаем уравнение |
|
||
C = C0 −kt, |
(12) |
||
где C0 — начальная концентрация вещества; С — концентрация вещества в данный момент времени t (текущая концентрация).
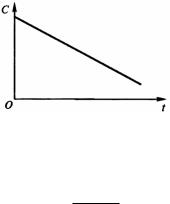
Из формулы (12) следует, что в реакциях нулевого порядка концентрация исходного вещества линейно уменьшается во времени (рис. 2).
Рис. 2. Зависимость концентрации C исходного вещества от времени t реакции для реакции нулевого порядка
Константу скорости рассчитывают по формуле |
|
k = C0 t−C. |
(13) |
Ее размерность такая же, как и размерность скорости реакции. Подставляя в уравнение (12) вместо концентрации C величину
C0/2, находим время полупревращения t1/2: |
|
|||
t1/2 |
= |
C0 |
. |
(14) |
|
||||
|
|
2k |
|
|
Таким образом, время полупревращения для реакции нулевого порядка пропорционально начальной концентрации исходного вещества.
Нулевой порядок реакции имеет место в тех случаях, когда убыль вещества в результате протекания химической реакции восполняется доставкой его из другой фазы. Примером реакции нулевого порядка может служить разложение малорастворимых в воде
10

сложных эфиров в присутствии эфирного слоя. Нулевой порядок реакции наблюдается также в случае, если скорость процесса лимитируется подачей энергии, необходимой для активации реагирующих молекул. Например, при фотохимических реакциях определяющим фактором может служить количество поглощенного света, а не концентрации веществ. В каталитических реакциях скорость часто определяется концентрацией катализатора и не зависит от концентраций реагирующих веществ.
Реакции первого порядка. Для реакции первого порядка A1 → А2 + А3 + ... кинетическое уравнение имеет следующий вид:
dC |
|
(15) |
− dt |
= k1C. |
Интегрирование выражения (15) приводит к уравнениям
ln |
C0 |
= k1t; |
(16) |
|
C |
||||
|
|
|
||
lnC = lnC0 −k1t; |
(17) |
|||
C = C0e−k1t, |
(18) |
|||
где С0, C — начальная и текущая концентрации вещества. Уравнение (18) показывает, что концентрация С реагента для
реакций первого порядка экспоненциально уменьшается со временем. Аналогично изменяется и скорость реакции. Уравнение (17) в координатах (lnC;t) является уравнением прямой линии. Это означает, что для различных начальных концентраций С0 мы получим параллельные прямые в полулогарифмических координатах
(рис. 3). Из формулы (17) следует: |
. |
|
||||
k1 = |
1t ln |
C0 |
(19) |
|||
|
|
|
|
C |
|
|
Согласно (19) размерность константы скорости реакции первого порядка [k1] = [t−1], поэтому ее численное значение зависит от того, в каких единицах выражается время. Подставив в уравнение
(17) С = С0/2, можно определить время полупревращения: |
|
|||
t |
= |
ln2 |
. |
(20) |
|
||||
1/2 |
|
k |
|
|
|
1 |
|
|
|
11

Рис. 3. Зависимость lnC(t) для реакции первого порядка при различных начальных концентрациях реагента
Таким образом, время полупревращения не зависит от начальной концентрации С0 реагирующего вещества.
Особенностью реакций первого порядка является инвариантность кинетической кривой при линейном преобразовании концентрации. Проведем операцию замещения концентрации С пропорциональной величиной nC в уравнении (15):
− |
d(nC) |
= k1nC. |
dt |
Поскольку величина n постоянна, ее можно вынести за знак дифференциала и затем сократить:
dC
−n dt = k1nC.
Это означает, что кинетическое уравнение остается неизменным при умножении величины С на какую-либо постоянную величину. Из этого свойства следует, что для оценки скорости реакции вместо концентрации можно использовать любую другую пропорциональную ей величину (например, оптическую плотность, электропроводность, объем раствора, пошедшего на титрование).
Получим еще одно важное соотношение. Так как скорость реакции в данный момент времени определяется тангенсом угла наклона касательной к кинетической кривой (см. рис. 1), начальная
12
скорость превращения исходного вещества равна С0/tx, где tx — время пересечения касательной к начальному участку кинетической кривой с осью времени. Подставив эту величину в кинетическое уравнение, получим
r0 = C0 = k1C0, tx
т. е.
1 tx = k1 .
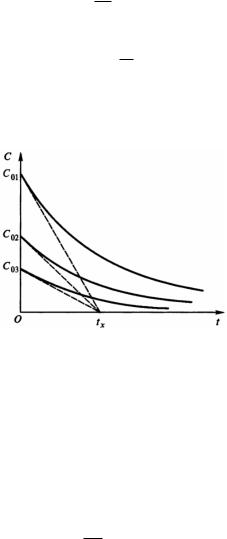
Таким образом, при любых начальных концентрациях С0 касательные к начальному участку кинетической кривой пересекут ось времени при одном и том же значении tx (рис. 4).
Рис. 4. Касательные к кинетическим кривым реакции первого порядка в точках, соответствующих начальным концентрациям
Реакции второго порядка. Рассмотрим некоторые случаи реакции второго порядка.
1. Реакция A + В → P, в которой начальные концентрации С0 реагентов равны и текущие концентрации одинаковы на протяжении всего хода реакции (CA = CB = C).
Дифференциальное уравнение для скорости реакции имеет следующий вид:
dC |
= k2C2. |
(21) |
− dt |
13
Разделение переменных и интегрирование в пределах от С0 до С приводит к такому результату:
1 |
1 |
|
(22) |
|
|
− |
|
= k2t. |
|
C |
C0 |
|||
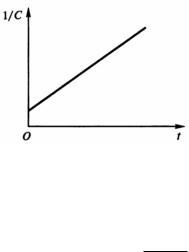
Из уравнения (22) следует, что для реакций второго порядка при равенстве начальных концентраций реагирующих веществ величина, обратная концентрации, линейно зависит от времени (рис. 5).
Рис. 5. Зависимость обратной концентрации вещества от времени для реакции второго порядка
Константу скорости реакции вычисляют по формуле
2 |
|
t |
C |
− C0 |
|
t CC0 |
|
|||
k |
= |
1 |
1 |
1 |
|
= |
1 |
C0 −C |
; |
(23) |
|
|
|
|
|
||||||
она имеет размерность [k2] = [t−1 ·C−1].
Для вычисления времени полупревращения для реакции вто-
рого порядка в уравнение (22) подставим С = С0/2: |
|
||||||||
1 |
|
1 |
|
|
|
|
|
||
|
|
− |
|
|
= k2t1/2. |
|
|||
|
C0/2 |
C0 |
|
||||||
Тогда |
|
|
|
|
|
|
|
||
|
t1/2 |
= |
|
1 |
|
. |
(24) |
||
|
k C |
0 |
|||||||
|
|
|
|
|
|
2 |
|
|
|
В отличие от времени полупревращения реакций первого порядка время полупревращения реакций второго порядка обратно пропорционально начальной концентрации.
14

2. Рассмотрим второй случай реакции второго |
порядка: |
||||||
A + В → P, когда начальные концентрации реагентов не равны. |
|||||||
Тогда кинетическое уравнение имеет вид |
|
||||||
|
− |
dCA |
= k2CACB, |
(25) |
|||
|
dt |
||||||
где CA, CB — текущие концентрации реагентов. |
|
||||||
Интегрирование приводит к следующему результату: |
|
||||||
|
1 |
|
|
ln |
C0ACB |
= k2t. |
(26) |
|
C0B −C0A |
|
|||||
|
|
C0BCA |
|
||||
Отметим, что на протяжении всей реакции будет соблюдаться уравнение материального баланса:
C0A −CA = C0B −CB.
С учетом этого соотношения из уравнения (26) получаем выражение для периода полупревращения вещества А (СА = С0А/2):
t1/2 |
= |
ln(2C0B −C0A)/C0B |
. |
(27) |
|
|
k2 (C0B −C0A) |
|
|
Реакции третьего порядка. Рассмотрим простейший слу- |
||||
чай реакции третьего |
порядка: A + B + D → P, |
когда началь- |
||
ные концентрации реагентов равны (C0A = C0B = C0D) и текущие концентрации одинаковы на протяжении всего хода реакции
(CA = CB = CD = C).
Дифференциальное уравнение для скорости имеет вид |
|
|
dC |
= k3C3. |
(28) |
− dt |
||
Разделение переменных и интегрирование в пределах от С0 до С приводит к следующему результату:
|
1 |
|
1 |
= 2k t; |
1 |
= |
1 |
+2k t; |
k |
= |
1 |
C02 −C2 |
. (29) |
|
C2 − C02 |
|
C02 |
|
|||||||||
|
3 |
C2 |
|
3 |
3 |
|
2t C02C2 |
|
|||||
Из |
уравнения (29) следует размерность константы скорости |
||||||||||||
реакции: [k3] = [t−1C−2].
Время полупревращения для реакции третьего порядка равно:
t1/2 = |
3 |
. |
(30) |
|
|||
2k3C2 |
|||
|
0 |
|
|
15
