
- •ВВЕДЕНИЕ
- •1. ХИМИЧЕСКАЯ КИНЕТИКА
- •1.1. Основные понятия и определения
- •1.2. Основной постулат химической кинетики
- •1.3. Формальная кинетика
- •1.4. Некоторые методы определения порядка реакции
- •1.5. Влияние температуры на скорость химической реакции
- •1.6. Методы расчета энергии активации
- •2. КАТАЛИЗ
- •2.1. Основные понятия и определения
- •2.2. Теория промежуточных соединений в катализе
- •2.3. Термодинамические и кинетические аспекты каталитических процессов
- •2.4. Гомогенный катализ. Простейшие механизмы гомогенных каталитических реакций
- •2.5. Гетерогенный катализ
- •3. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
- •5. ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
- •ЛИТЕРАТУРА
- •ОГЛАВЛЕНИЕ

1.ХИМИЧЕСКАЯ КИНЕТИКА
1.1.Основные понятия и определения
Скорость гомогенной химической реакции. Скорость — важнейшая количественная характеристика любой химической реакции. Наиболее общим является определение скорости реакции r
(от англ. rate — скорость) как скорости возрастания степени завершенности реакции ξ, которую называют химической переменной.
Пусть в закрытой системе протекает химическая реакция
νAA+ νBB → νDD+ νFF,
где A, B, D, F — вещества, участвующие в реакции; νA, νB, νD, νF — стехиометрические коэффициенты в уравнении реакции. Тогда химическая переменная ξ, характеризующая глубину протекания реакции по i-му компоненту, определяется соотношением
ξ = |
ni −n0i |
, |
(1) |
|
νi |
|
|
где ni — число молей i-го компонента в момент времени t; n0i — число молей i-го компонента в начальный момент времени (t = 0);
νi — стехиометрический коэффициент в уравнении реакции. Скорость гомогенной химической реакции r определяется как изме-
нение глубины протекания реакции в единицу времени в единице объема системы:
r = |
1 dξ |
, |
(2) |
|||
|
|
|
||||
V dt |
||||||
|
|
|
||||
где V — объем системы; t — время реакции. Определенная таким образом скорость реакции не зависит от выбора компонента
4

и практически одинакова для различных веществ, участвующих в реакции. Дифференциальная форма уравнения (1) выглядит так:
ξ dni d = νi .
С учетом этого из уравнения (2) можно получить следующее соотношение:
r = |
1 |
|
|
dni |
(3) |
|||
|
|
|
|
|
. |
|||
νiV |
|
dt |
||||||
Величина |
|
|
|
|
|
|
|
|
ri = ± |
1 dni |
(4) |
||||||
V |
|
|
dt |
|
||||
называется скоростью реакции по i-му компоненту. Она характеризует изменение количества i-го вещества ni (в молях) в единицу времени в единице объема системы. Таким образом, скорость реакции в целом и скорости реакции по отдельным компонентам связаны соотношением
r = |
1 |
(5) |
νi ri. |
Выражения (3) и (4) являются строгими определениями скорости реакции, справедливыми и для системы с переменным объемом. На практике часто пользуются более простым соотношением, пригодным для описания реакции в системе с постоянным объемом. Если в закрытой системе протекание гомогенной реакции не сопровождается изменением объема, то
|
dni |
= dCi; |
ri = ± |
dCi |
, |
(6) |
|||
|
V |
dt |
|||||||
скорость реакции |
|
|
|
|
|
|
|
|
|
|
|
r = |
1 dCi |
. |
|
|
(7) |
||
|
|
νi |
|
dt |
|
|
|||
Здесь Ci — концентрация i-го вещества.
Таким образом, скорость реакции (при постоянном объеме) представляет собой изменение концентрации данного компонента в единицу времени.
Скорость является положительной величиной, поскольку dCi > 0, поэтому в уравнении (6) используют знак плюс, если
5
скорость реакции определяют по изменению концентрации продукта реакции, и знак минус, если ее определяют по изменению концентрации одного из исходных веществ.
Изменения концентраций реагентов в процессе реакции пропорциональны друг другу, так как количества взаимодействующих исходных веществ и образующихся продуктов связаны уравнением химической реакции. Например, для реакции
νAA+ νBB → νDD+ νFF
справедливо соотношение
r = − |
1 |
|
dCA |
= − |
1 |
|
dCB |
= |
1 |
|
dCD |
= |
1 dCF |
(8) |
|||
|
|
|
|
|
|
|
|
|
|
|
|
. |
|||||
νA |
|
dt |
νB |
|
dt |
νD |
|
dt |
νF |
dt |
|||||||
Кинетическая кривая. Скорость гомогенной реакции, протекающей в закрытой системе, экспериментально определяют измерением концентрации i-го реагента (Ci) в различные моменты
времени. Полученные данные представляют в виде графической зависимости Ci = f(t), которую называют кинетической кривой.
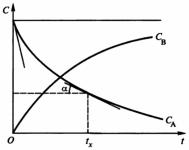
На рис. 1 приведены типичные кинетические кривые для элементарной химической реакции А → В. Скорость реакции по i-му компоненту ri в момент времени t соответствует тангенсу угла наклона касательной, проведенной к кинетической кривой, в точке, соответствующей моменту времени t.
Рис. 1. Кинетические кривые для исходного вещества (А) и продукта реакции (В) (r = tg α)
Еще одной важной кинетической характеристикой реакции является время (период) полупревращения (t1/2) — время, не-
6
обходимое для химического превращения половины начального
количества вещества.
Факторы, влияющие на скорость химических реакций.
На скорость гомогенной химической реакции оказывают влияние:
1)природа реагирующих веществ;
2)концентрации реагирующих веществ;
3)температура;
4)присутствие катализаторов;
5)физические воздействия (например, скорость некоторых реакций возрастает при воздействии светового или радиационного излучения, при пропускании электрического тока и т. д.).
Влияние природы и концентраций реагирующих веществ определяется основным постулатом химической кинетики.
1.2. Основной постулат химической кинетики
При постоянной температуре системы скорость реакции определяется концентрациями веществ, участвующих в реакции в данный момент времени.
Математическое соотношение, выражающее зависимость
скорости химической реакции от концентрации реагентов, называется кинетическим уравнением химической реакции:
r = f(C1,С2, ...,С).
Экспериментальным путем было показано, что для элементарных реакций скорость реакции в каждый момент времени пропорциональна произведению текущих концентраций взаимодействующих веществ, возведенных в степени, равные стехиометрическим
коэффициентам в уравнении реакции.
Элементарной называется реакция, которая осуществляется путем непосредственного превращения реагентов в продукты реакции (в одну стадию). Например, скорость элементарной реакции aA + bB → dD + f F равна:
r = kCaCb . |
(9) |
A B |
|
где а, b — стехиометрические коэффициенты в уравнении реакции
(целые положительные числа).
Кинетическое уравнение (9) называют законом действующих масс, а постоянную k в уравнении (9) — константой скорости
7
реакции. Численно она равна скорости реакции при концентрациях веществ, равных единице, поэтому ее часто называют удельной скоростью реакции. Согласно определению k не зависит от кон-
центрации реагентов и времени реакции.
Однако большинство химических процессов являются слож-
ными и включают несколько элементарных стадий. Для сложных реакций выполняется принцип независимости протекания реакций: если в системе одновременно протекает несколько реакций, то каждая из них протекает независимо от остальных. Таким образом, константа скорости каждой реакции не зависит от наличия в системе других реакций.
Это положение справедливо для реакций, протекающих как в закрытых, так и в открытых системах. В этих случаях соотношение (9) выполняется для каждой стадии процесса. При известном механизме сложной реакции это выражение преобразуется в систему дифференциальных уравнений, решение которой при дополнительных условиях позволяет найти уравнение зависимости скорости сложной реакции от концентрации реагентов. Однако в большинстве случаев экспериментально наблюдаемую зависимость скорости реакции от концентрации реагирующих веществ представляют в виде эмпирического уравнения.
Так, для сложной реакции νAA+ νBB → νDD+ νFF кинетическое уравнение записывают в виде
r = kCnCBm, |
(10) |
где коэффициенты n, m, стоящие в показателе степени при концентрациях веществ, называют порядком реакции по данному реагенту
или частным порядком реакции. Эти коэффициенты не равны стехиометрическим коэффициентам и могут быть как целыми, так и дробными числами, как положительными, так и отрицательными.
Алгебраическая сумма показателей степеней q = n + m при
концентрациях всех реагирующих веществ, входящих в кинетическое уравнение, называется порядком реакции q.
Порядок реакций определяют только опытным путем. Кинетическое уравнение (10) называют основным постулатом
(законом) химической кинетики: скорость реакции в каждый момент времени при постоянной температуре пропорциональна про-
8
