
- •Физическая и коллоидная химия
- •240134 Переработка нефти и газа
- •Содержание
- •2 Рабочая программа учебной дисциплины
- •2.1 Паспорт рабочЕй программы учебной дисциплины Физическая и коллоидная химия
- •2.1.1 Область применения рабочей программы
- •2.1.3 Цели и задачи учебной дисциплины – требования к результатам освоения учебной дисциплины:
- •2.1.4 Рекомендуемое количество часов на освоение рабочей программы учебной дисциплины: Физическая и коллоидная химия
- •2.2 Структура и содержание учебной дисциплины
- •2.2.1 Объем учебной дисциплины и виды учебной работы
- •2.2.2 Тематический план и содержание учебной дисциплины _____Физическая и коллоидная химия_______
- •2.3 Условия реализации учебной дисциплины
- •2.3.1 Требования к минимальному материально-техническому обеспечению
- •2.3.2 Информационное обеспечение обучения
- •Еремин в.В., Каргов с.И. И др. Основы физической химии. Теория и задачи. - м.: Экзамен, 2005. - 480 с.
- •3 Методические указания по изучению учебного материала по теме Введение
- •Вопросы для самоконтроля
- •Методические указания по теме 1.1 Молекулярно-кинетическая теория агрегатных состояний вещества
- •Вопросы для самоконтроля
- •Методические указания по теме 1.2 Основы химической термодинамики
- •Вопросы для самоконтроля
- •Методические указания по теме 1.3 Химическая кинетика
- •Вопросы для самоконтроля
- •Методические указания по теме 1.4 Катализ
- •Вопросы для самоконтроля
- •Методические указания по теме 1.5 Химическое равновесие
- •Решение. Используем формулу
- •Вопросы для самоконтроля
- •Методические указания по теме 1.6 Фазовое равновесие
- •Вопросы для самоконтроля
- •Методические указания по теме 1.7 Растворы
- •Вопросы для самоконтроля
- •Методические указания по теме 1.8 Электрохимия
- •Вопросы для самоконтроля
- •Методические указания по теме 2. 1 Дисперсные системы
- •Вопросы для самоконтроля
- •Литература: [1], с.214-216, с.230-259, с. 263-271; [2], с.329-373; [3], с.209-214; [4], с.165-170
- •Вопросы для контрольной работы №1
- •5 Список вопросов к экзамену
Решение. Используем формулу
![]() .
.
Определим n = 2 – 1 = – 2.
Следовательно,
![]()
Т = 350 + 273 = 623 К;
КС = 2,3210-13(8,314103623)2 = 6,224.
Пример 4 В какую сторону сместятся равновесия реакций:
2СО + О2 2СО2 + 566,9 кДж;
2Н2S 2H2 + S2 – 41,9 кДж,
а) при повышении температуры;
б) при повышении давления?
Каким изменением концентраций можно добиться смещения равновесий приведенных реакций вправо?
Решение. Исходя из принципа Ле Шателье, можно сказать, что
а) при повышении температуры равновесие первой реакции сдвинется влево, т.к. реакция экзотермическая, а равновесие второй реакции сдвинется вправо, т.к. реакция эндотермическая.
б) при повышении давления равновесие первой реакции сдвинется в сторону прямой реакции, а равновесие второй реакции сдвинется в сторону обратной реакции, т.е. всегда в сторону меньшего объема.
Чтобы сдвинуть равновесие этих реакций вправо путем изменения концентраций, надо увеличить концентрации исходных веществ или уменьшить концентрации конечных веществ.
Пример 5 Константа равновесия КР реакции
I2 2I
при t1 = 6770C равна 1,149102, а при t2 = 7770C – 7,413102. Вычислить константу равновесия данной реакции при 7270С.
Решение. Используя уравнение
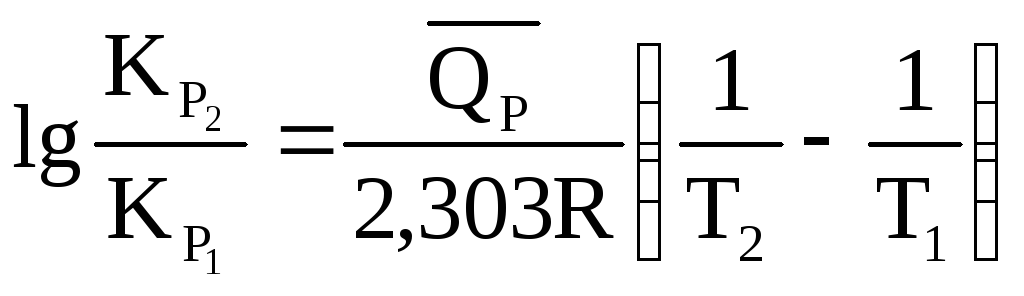 ,
,
по двум приведенным величинам КР вычисляем среднее значение теплового эффекта реакции термического разложения йода в интервале 677 – 777 0С:
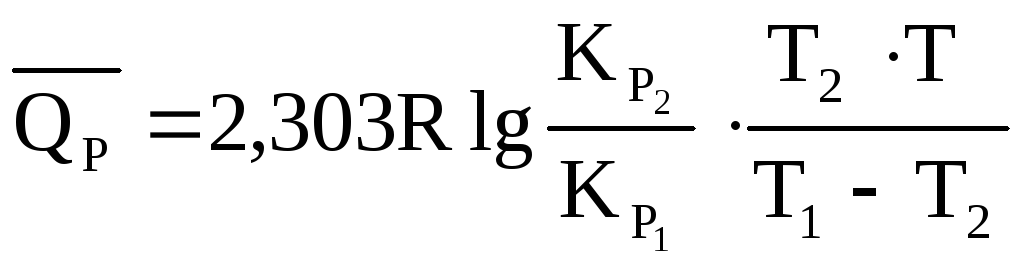 ;
;
Т1 = 950 К, Т2 = 1050 К.
![]() Дж/моль
Дж/моль
Т3 = 1000 К;
Определим КР3:
![]() ;
;
![]() ;
;
![]() ;
;
КР3 = 3,057102.
Вопросы для самоконтроля
Что такое истинное равновесие?
Каковы признаки истинного равновесия?
Вывести константы равновесия Кс и Кр и их взаимосвязь. От чего зависят и от чего не зависят эти константы равновесия?
Сформулировать принцип Ле Шателье.
Как влияют температура, давление, концентрация на смещение равновесия?
Для чего и как применяются уравнения изохоры и изобары?
Литература: [1], с.71-82; [2], с.152-172
Методические указания по теме 1.6 Фазовое равновесие
Прежде всего, при изучении этой темы нужно четко уяснить: что такое фаза и компонент и не путать эти понятия друг с другом. Особое внимание обратите на понятие «число степеней свободы».
Обратите внимание на то, как строится диаграмма плавкости, почему правило фаз для однокомпонентных систем пишем в виде С = К – Ф + 2, а для двухкомпонентных конденсированных систем в виде С = К – Ф + 1
Вопросы для самоконтроля
Что такое фаза, компонент и число степеней свободы?
Записать правило фаз Гиббса в общем виде и прочитать его.
Написать правило фаз Гиббса для однокомпонентных систем. Что означает «2» в этом уравнении?
Написать правило фаз Гиббса для двухкомпонентных конденсированных систем. Что означает «I» в этом уравнении? Почему надо писать «I», a не «2» ?
Начертить диаграмму состояния воды и разобрать ее по правилу фаз. Что такое тройная точка?
Начертить диаграмму состояния серы и разобрать ее по правилу фаз. Сколько здесь тройных точек?
Как строится кривая плавкости (показать на примере системы Cd - Bi)?
Литература: [1], с.85-96; [2], с.176-196; [3], с.139-144; [4], с.65-74
