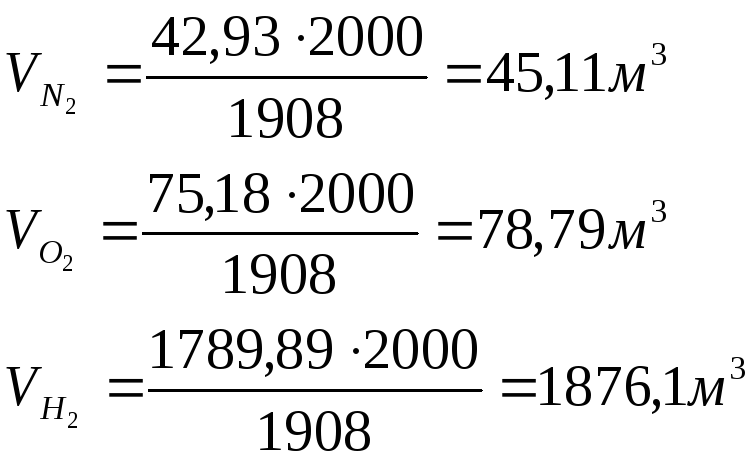- •Физическая и коллоидная химия
- •240134 Переработка нефти и газа
- •Содержание
- •2 Рабочая программа учебной дисциплины
- •2.1 Паспорт рабочЕй программы учебной дисциплины Физическая и коллоидная химия
- •2.1.1 Область применения рабочей программы
- •2.1.3 Цели и задачи учебной дисциплины – требования к результатам освоения учебной дисциплины:
- •2.1.4 Рекомендуемое количество часов на освоение рабочей программы учебной дисциплины: Физическая и коллоидная химия
- •2.2 Структура и содержание учебной дисциплины
- •2.2.1 Объем учебной дисциплины и виды учебной работы
- •2.2.2 Тематический план и содержание учебной дисциплины _____Физическая и коллоидная химия_______
- •2.3 Условия реализации учебной дисциплины
- •2.3.1 Требования к минимальному материально-техническому обеспечению
- •2.3.2 Информационное обеспечение обучения
- •Еремин в.В., Каргов с.И. И др. Основы физической химии. Теория и задачи. - м.: Экзамен, 2005. - 480 с.
- •3 Методические указания по изучению учебного материала по теме Введение
- •Вопросы для самоконтроля
- •Методические указания по теме 1.1 Молекулярно-кинетическая теория агрегатных состояний вещества
- •Вопросы для самоконтроля
- •Методические указания по теме 1.2 Основы химической термодинамики
- •Вопросы для самоконтроля
- •Методические указания по теме 1.3 Химическая кинетика
- •Вопросы для самоконтроля
- •Методические указания по теме 1.4 Катализ
- •Вопросы для самоконтроля
- •Методические указания по теме 1.5 Химическое равновесие
- •Решение. Используем формулу
- •Вопросы для самоконтроля
- •Методические указания по теме 1.6 Фазовое равновесие
- •Вопросы для самоконтроля
- •Методические указания по теме 1.7 Растворы
- •Вопросы для самоконтроля
- •Методические указания по теме 1.8 Электрохимия
- •Вопросы для самоконтроля
- •Методические указания по теме 2. 1 Дисперсные системы
- •Вопросы для самоконтроля
- •Литература: [1], с.214-216, с.230-259, с. 263-271; [2], с.329-373; [3], с.209-214; [4], с.165-170
- •Вопросы для контрольной работы №1
- •5 Список вопросов к экзамену
3 Методические указания по изучению учебного материала по теме Введение
При изучении данной темы необходимо сформировать представления о содержании, значимости и роли данной дисциплины в развитии важнейших отраслей промышленности, обратить внимание на экологические проблемы химических и нефтехимических производств.
Вопросы для самоконтроля
Что является предметом изучения физической химии?
Какие разделы включает физическая химия?
Что является предметом изучения коллоидной химии?
Кто является основоположником физической химии?
Назовите области применения физико-химических методов исследования.
Литература: [1], с.6-8
Методические указания по теме 1.1 Молекулярно-кинетическая теория агрегатных состояний вещества
При изучении этой темы следует обратить внимание на отличие реального газа от идеального и на то, как они связываются в написании уравнения состояния. Какие поправки введены в уравнение состояния реального газа и что они учитывают, когда можно при расчетах пользоваться уравнением идеального газа, а когда надо использовать уравнение состояния реального газа.
При изучении жидкого состояния вещества надо обратить внимание на особенности жидкостей, физический смысл поверхностного натяжения, вязкости, а также на методы их определения.
При изучении твердого состояния вещества надо уяснить отличие кристаллических веществ от аморфных и как это отражается на графике tохл. – время.
Пример 1. Газ под давлением 1,2 . 105 Па занимает объём 4,5л. Каково будет давление, если не изменяя температуры, увеличить объём до 0,0055м3?
Решение: При решении задач условие следует записывать в сокращённом виде, как показано в примере 1. В дальнейшем сокращённая запись условия не приводится.
Используем формулу
закона Бойля – Мариотта.
Д ано:
ано:
Р 1
= 1,2 .
105 Па
1
= 1,2 .
105 Па
V1
= 4,5 л. = 4,5 .
10-3
м3![]()
![]() V2
= 0,0055 м3
V2
= 0,0055 м3

Р2 - ?
Пример 2 При 37С объём газа равен 0,5 м3. Какой объём займет газ при 100С, если давление останется постоянным?
Решение. Определяем объём газа, применяя закон Гей – Люссака:
![]() .
.
В градусах термодинамической шкалы температура равна:
Т1 = 37 + 273 = 310 К
Т2 = 100 + 273 = 373 К
![]()
Пример 3 При 22С и 95940 Па объём кислорода равен 20 л. Рассчитать объём газа при н.у. Какова плотность кислорода при заданных условиях?
Решение.
Из уравнения
![]() определяем объём кислорода при н.у.
определяем объём кислорода при н.у.
![]()
Плотность кислорода
при н.у. согласно уравнения
![]()
![]()
![]() Используя
Используя![]() для н.у. и заданных условий:
для н.у. и заданных условий:![]()
Пример 4 При 27С и 106600 Па масса 380 см3 газа равна 0,4550 г. Определить молекулярную массу (кг) газа и его плотность при 50С и том же давлении.
Решение. Выразим все величины в системе СИ:
m = 0,4550 г = 0,455.10-3 кг;
V = 380 см3 = 380.10-6 м3;
Т1 = 273 + 27 = 300 К
Т2 = 273 + 50 = 323 К
Из уравнения
![]() определяем
определяем![]()
Плотность
газа при н.у. согласно ![]() ;
;![]()
Плотность газа
при 50С
рассчитываем по формуле![]() ;
;![]()
![]()
Пример 5 Колошниковый газ имеет примерный состав (об. доли):СО – 0,28; Н2 - 0,03; СО2 – 0,1; N2 - 0,59. Вычислить парциальные давления составляющих смесь газов, если общее давление газовой смеси 106400 Па.
Решение. Парциальные давления отдельных газов в смеси можно вычислить, используя соотношения.
![]() и
и
![]()
![]()
![]() и
и
![]()
Тогда PCO = Pобщ. общ.
PCO = 106400 . 0,28 = 29792 Па
PH2 = 106400 . 0,03 = 3192 Па
PCO2 = 106400 . 0,1 = 10640 Па
PN2 = 106400 . 0,59 = 62776 Па
Пример 6 В сосуде объёмом 2000 м3 смешиваются 1 кг азота и 2 кг кислорода, и 3 кг водорода. Вычислить парциальные объёмы и давления соответствующих газов, составляющих смесь, а также общее давление газовой смеси при17С.
Решение.
Вычисляем числа киломолей газов по
уравнению
![]()
![]()
![]()
Т = 273 + 17 = 290 К
Из уравнения
![]() определяем
общее давление смеси газов Робщ.:
определяем
общее давление смеси газов Робщ.:
![]()
По уравнению
![]() рассчитываем
парциальные давления газов в смеси:
рассчитываем
парциальные давления газов в смеси:![]()
![]()
![]()
По уравнению
![]() определяем парциальные объёмы газов:
определяем парциальные объёмы газов: