
- •Физическая и коллоидная химия
- •240134 Переработка нефти и газа
- •Содержание
- •2 Рабочая программа учебной дисциплины
- •2.1 Паспорт рабочЕй программы учебной дисциплины Физическая и коллоидная химия
- •2.1.1 Область применения рабочей программы
- •2.1.3 Цели и задачи учебной дисциплины – требования к результатам освоения учебной дисциплины:
- •2.1.4 Рекомендуемое количество часов на освоение рабочей программы учебной дисциплины: Физическая и коллоидная химия
- •2.2 Структура и содержание учебной дисциплины
- •2.2.1 Объем учебной дисциплины и виды учебной работы
- •2.2.2 Тематический план и содержание учебной дисциплины _____Физическая и коллоидная химия_______
- •2.3 Условия реализации учебной дисциплины
- •2.3.1 Требования к минимальному материально-техническому обеспечению
- •2.3.2 Информационное обеспечение обучения
- •Еремин в.В., Каргов с.И. И др. Основы физической химии. Теория и задачи. - м.: Экзамен, 2005. - 480 с.
- •3 Методические указания по изучению учебного материала по теме Введение
- •Вопросы для самоконтроля
- •Методические указания по теме 1.1 Молекулярно-кинетическая теория агрегатных состояний вещества
- •Вопросы для самоконтроля
- •Методические указания по теме 1.2 Основы химической термодинамики
- •Вопросы для самоконтроля
- •Методические указания по теме 1.3 Химическая кинетика
- •Вопросы для самоконтроля
- •Методические указания по теме 1.4 Катализ
- •Вопросы для самоконтроля
- •Методические указания по теме 1.5 Химическое равновесие
- •Решение. Используем формулу
- •Вопросы для самоконтроля
- •Методические указания по теме 1.6 Фазовое равновесие
- •Вопросы для самоконтроля
- •Методические указания по теме 1.7 Растворы
- •Вопросы для самоконтроля
- •Методические указания по теме 1.8 Электрохимия
- •Вопросы для самоконтроля
- •Методические указания по теме 2. 1 Дисперсные системы
- •Вопросы для самоконтроля
- •Литература: [1], с.214-216, с.230-259, с. 263-271; [2], с.329-373; [3], с.209-214; [4], с.165-170
- •Вопросы для контрольной работы №1
- •5 Список вопросов к экзамену
Методические указания по теме 1.7 Растворы
При изучении этой темы необходимо уделить особое внимание выражению и перерасчету концентраций растворов. Уделить внимание изучению условий кипения и замерзания растворов.
Обратить внимание на процессы перегонки растворов, а так же на закономерности этих процессов их практическое применение. Особое внимание уделить процессу ректификации: физической сущности и теоретическим основам процесса, условиям работы и принципиальному устройству ректификационной колонны, а также методам разделения азеотропных смесей.
Изучая законы Рауля, запомнить, что он применим только для идеальных растворов. При изучении криоскопии и эбулиоскопии усвоить методику определения молекулярной массы вещества с помощью криоскопии (или эбулиоскопии). Законы Коновалова и перегонку жидких смесей надо разбирать с помощью диаграмм: t0кип. – состав. При рассмотрении второго закона Коновалова особое внимание обратить на то, что такое азеотроп и как его разделить.
Изучая растворы газов в жидкостях обратить внимание на абсорбцию газов жидкостями и на практическое применение этого процесса.
Пример 1 Осмотическое давление раствора не электролита при 170С равно ,82105 Па. Определить осмотическое давление этого раствора при 570С.
Решение. Используем закон Вант - Гоффа для не электролитов П = СRT
Сначала найдем концентрацию раствора
![]() ;
Т1
= 290 К
;
Т1
= 290 К
![]() кмоль/м3
кмоль/м3
Находим осмотическое давление раствора при 570С
Т2 = 330 К
П2 = 0,28,314103330 = 5,487105 Па.
Пример 2 Определить осмотическое давление 0,01н. раствора К2SO4 при 180С, если степень диссоциации соли в растворе равна 87%.
Решение. Находим величину изотонического коэффициента
i = 1 + (K – 1);
К2SO4 2K+ + SO4-2
K = 3;I = 1 + 0,87(3 – 1) = 2,74.
По закону Вант – Гоффа для электролитов находим величину осмотического давления данного раствора при данной температуре П = iCRT, где Т = 290 К, С – концентрация, которая дана в г-экв/л, а ее надо выразить в кмоль/м3.
М(К2SO4) = 174,2 Э(К2SO4) = 174,2/2 = 87,1
Найдем число молей К2SO4
n= m/M
0,01н. = 0,01 г-экв/л, т.к. 1 г-экв равен 87,1 г, то 0,01 г-экв К2SO4 будет равен 0,871 г
n = 0,871/174,2 = 0,005 моль К2SO4
Следовательно, С = 0,005 моль/л = 0,005 кмоль/м3
П = 2,74·0,005·8,314·103·291 = 9,3·104 Па.
Пример 3 Определить давление пара раствора 6,4 г нафталина в 90 г бензола при 200С, если давление пара бензола при данной температуре равно 9953,82 Па.
Решение. Давление пара раствора можно определить из закона Рауля
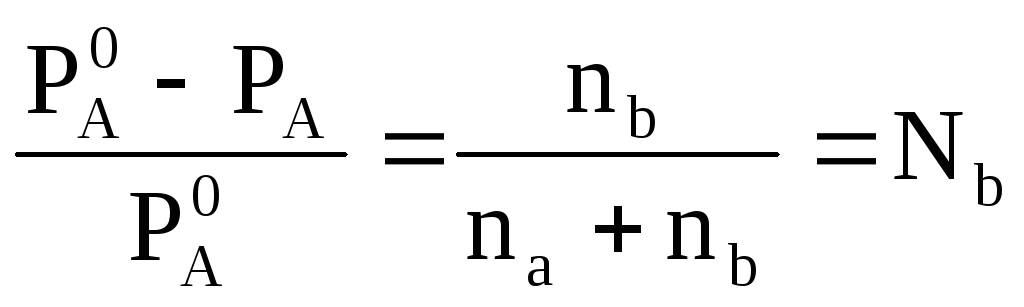
![]() ;
;
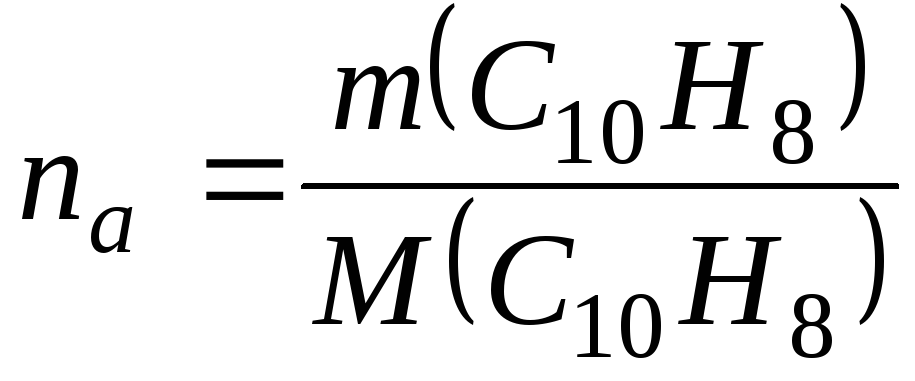
n(C6H6) = 0,09/78 = 1,15*10-3 кмоль
n(C10H8) = 0,0064/128 = 5*10-5 кмоль
![]()
Рассчитываем давление паров бензола над раствором
![]()
![]() Па
Па
Пример 4 Давление пара чистого ацетона при 200С 23940 Па. Давление пара раствора камфоры в ацетоне, содержащего 5 г камфоры на 200 г ацетона при той же температуре, равно 23710 Па. Определить молекулярную массу камфоры, растворенной в ацетоне.
Решение. Раствор разбавленный, поэтому можно воспользоваться упрощенной формулой

Из этой формулы рассчитываем число молей комфоры:
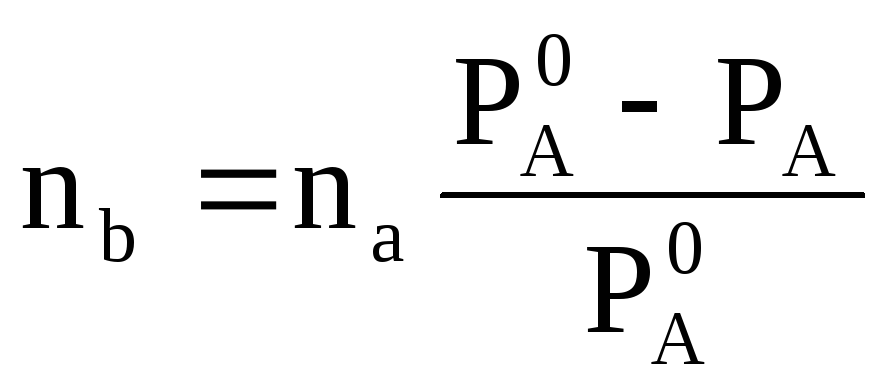 ,
,
М( СО(СН3)2 ) = 58; na = 200/58 = 3,45
![]() .
.
Но
![]() .
.
Откуда
![]() .
.
Пример 5 При какой примерно температуре будет замерзать водный раствор этилового спирта концентрации 0,4 (40%) масс. доли С2Н5ОН.
Решение. Используем формулу
![]()
![]()
![]()
![]()
![]() .
.
Раствор замерзает примерно при – 270С.
Пример 6. Раствор, содержащий 1,70 г хлорида цинка в 250 г воды, замерзает при – 0,230С. Определить кажущуюся степень диссоциации ZnCl2 в растворе.
Решение. Вычисляем ТЗ данного раствора:
![]()
М(ZnCl2) = 136.
Из формулы
![]() ,
,
находим изотонический коэффициент:
![]()
![]()
Используя формулу i = 1 + (K – 1) , вычисляем соли в растворе (К = 3):
![]() ;
;
![]() .
.
Пример 7 В 1 л водного раствора содержится 0,15 г йода. Какова будет степень извлечения йода из данного раствора 40 см3 ССl4:
а) при однократном извлечении всем количеством растворителя;
б) при четырехкратном извлечении порциями по 10 см3? Коэффициент распределения йода между Н2О и ССl4 0,0117.
Решение. Используем формулу
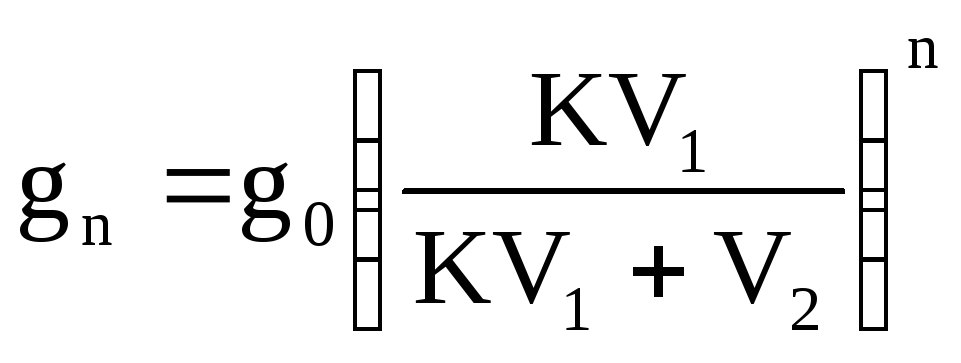
а) количество йода, оставшееся после однократного извлечения
n = 1
![]() г.
г.
Это составляет
![]() .
.
Следовательно, в слой ССl4 перейдет
100 – 22,6 = 77,4 % йода;
б) количество йода, оставшееся после четырехкратного извлечения (n = 4)
![]() г,
г,
или
![]() .
.
В слой ССl4 перейдет 100 – 8,45 = 91,55%.
