
- •Физическая и коллоидная химия
- •240134 Переработка нефти и газа
- •Содержание
- •2 Рабочая программа учебной дисциплины
- •2.1 Паспорт рабочЕй программы учебной дисциплины Физическая и коллоидная химия
- •2.1.1 Область применения рабочей программы
- •2.1.3 Цели и задачи учебной дисциплины – требования к результатам освоения учебной дисциплины:
- •2.1.4 Рекомендуемое количество часов на освоение рабочей программы учебной дисциплины: Физическая и коллоидная химия
- •2.2 Структура и содержание учебной дисциплины
- •2.2.1 Объем учебной дисциплины и виды учебной работы
- •2.2.2 Тематический план и содержание учебной дисциплины _____Физическая и коллоидная химия_______
- •2.3 Условия реализации учебной дисциплины
- •2.3.1 Требования к минимальному материально-техническому обеспечению
- •2.3.2 Информационное обеспечение обучения
- •Еремин в.В., Каргов с.И. И др. Основы физической химии. Теория и задачи. - м.: Экзамен, 2005. - 480 с.
- •3 Методические указания по изучению учебного материала по теме Введение
- •Вопросы для самоконтроля
- •Методические указания по теме 1.1 Молекулярно-кинетическая теория агрегатных состояний вещества
- •Вопросы для самоконтроля
- •Методические указания по теме 1.2 Основы химической термодинамики
- •Вопросы для самоконтроля
- •Методические указания по теме 1.3 Химическая кинетика
- •Вопросы для самоконтроля
- •Методические указания по теме 1.4 Катализ
- •Вопросы для самоконтроля
- •Методические указания по теме 1.5 Химическое равновесие
- •Решение. Используем формулу
- •Вопросы для самоконтроля
- •Методические указания по теме 1.6 Фазовое равновесие
- •Вопросы для самоконтроля
- •Методические указания по теме 1.7 Растворы
- •Вопросы для самоконтроля
- •Методические указания по теме 1.8 Электрохимия
- •Вопросы для самоконтроля
- •Методические указания по теме 2. 1 Дисперсные системы
- •Вопросы для самоконтроля
- •Литература: [1], с.214-216, с.230-259, с. 263-271; [2], с.329-373; [3], с.209-214; [4], с.165-170
- •Вопросы для контрольной работы №1
- •5 Список вопросов к экзамену
Вопросы для самоконтроля
Вывести основное уравнение молекулярно- кинетической теории газов.
Вывести уравнение идеального газа.
Физический смысл универсальной газовой постоянной, ее численные значения и размерность.
Закон Дальтона.
Написать уравнение Ван-дер-Ваальса.
Отличия реальных газов от идеальных.
Особенности жидкого состояния вещества.
Что называется поверхностным натяжением? Методы его определения.
Вязкость, ее определение с помощью вискозиметра Оствальда.
Что такое кристаллическая решетка?
Что такое полиморфизм, аллотропия, изоморфизм, анизотропия?
Какие вещества называются аморфными?
Литература: [1], с.9-26; [2], с.13-67; [3], с.14-38; [4], с.4-23
Методические указания по теме 1.2 Основы химической термодинамики
При изучении данной темы необходимо уяснить понятие теплоемкости и взаимосвязь между изобарной и изохорной теплоемкостью газов. Обратить внимание на закон Гесса и применение его для расчета тепловых эффектов различных реакций. Рассмотреть приложение первого закона термодинамики к химическим процессам.
Уяснить уравнение, связывающее Qp и Qv, вычислять теплоты образования неорганических веществ и теплоты сгорания органических веществ по формуле Д.П. Коновалова и с использованием справочной литературы.
При изучении второго закона термодинамики необходимо обратить внимание, что закон устанавливает: возможен или невозможен при данных условиях тот или иной процесс; до какого предела он может протекать и какая наибольшая полезная работа совершается при этом. Обратите внимание, что на основании второго закона термодинамики
U = F + TS ,
где F – свободная энергия системы, т.е. часть внутренней энергии, которая способна преобразовываться в полезную работу при постоянной температуре; TS – связанная энергия, часть внутренней энергии не способной превращаться в работу.
Обратите внимание, что применительно к химическим процессам второй закон термодинамики можно сформулировать: всякое химическое взаимодействие, при неизменных давлении или объеме и постоянстве температуры, протекает в направлении уменьшения свободной энергии системы.
Необходимо уяснить, что пределом протекания химических реакций (т.е. условием равновесия) является достижение некоторого минимального для данных условий значения свободной энергии системы G или F.
Значения термодинамических функций при стандартных условиях t=250C и Р = =101325 Па приводятся в справочных таблицах .
Пример 1 Определить теплоту сгорания этилена
С2Н4 + 3О2 2СО2 + 2Н2О + Q
Исходя из следующих данных:
2Cгр + 2Н2 = С2Н4 – 62,01 кДж/моль (а)
Cгр + 2О2 = СО2 + 393,9 кДж/моль (б)
Н2 + ½О2 = Н2О + 284,9 кДж/моль (в)
Решение. В данном случае можно воспользоваться двумя методами.
1-й метод. Комбинируя заданные термохимические уравнения, исключим водород и углерод, которые не участвуют в реакции горения. Для этого уравнение (б) умножаем на 2 и вычитаем из него уравнение (а):
2Сгр + 2О2 = 2СО2 + 787,8
2
 Сгр
+ 2О2 =
С2Н4
– 62,01
Сгр
+ 2О2 =
С2Н4
– 62,01
2О2 – 2Н2 = 2СО2 - С2Н4 +849,81
Полученный результат складываем по численно с уравнением (в), предварительно умножив его на 2:
2О2 + 2Н2 = 2СО2 – С2Н4 + 849,8
2
 Н2
+ 2О2 =
2Н2О(ж)
+ 569,80
Н2
+ 2О2 =
2Н2О(ж)
+ 569,80
3О2 = 2СО2 – 2Н2О(ж) + С2Н4 + 1419,61
или С2Н4 + 3О2 = 2СО2 + 2Н2О(ж) + 1419,61 кДж/моль
Qc2н4 = 1419,61 кДж/моль
2-й метод. Применяем 1-е следствие закона Гесса, поскольку все приведённые в условии задачи тепловые эффекты являются теплотами образования соответственно этилена, диоксида углерода и жидкой воды из простых веществ (теплоты образования простых веществ применяются равными нулю):
![]()
![]()
Пример 2
Определить разность между
![]() и
и![]() при 25С
для следующих реакций.
при 25С
для следующих реакций.
1. N2 + 3H2 = 2NH3
2. 2Cгр. + О2 = 2СО
3. 3С2Н2 С6Н6.
Решение: Применяем формулу взаимосвязи изобарного и изохорного теплового эффекта.
![]()
![]()
1. Находим
![]() ,
где
,
где
n1- число молей газообразных исходных вещевств;
n2-число молей газообразных конечных веществ.
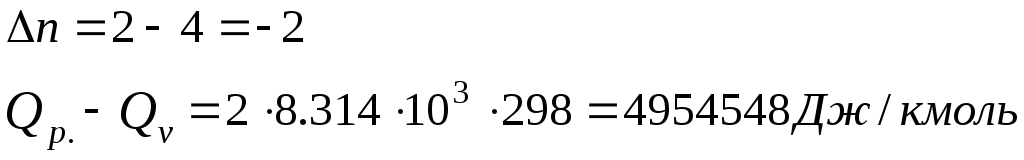
2.
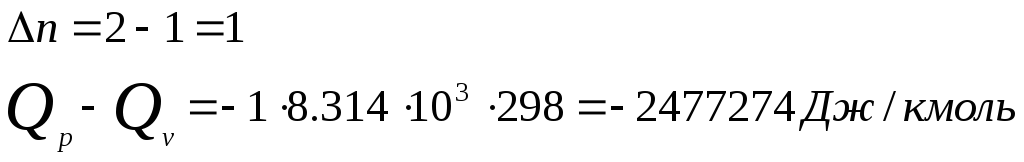
Пример 3 Теплота образования Qр. Аммиака равна 46,26кДж/кмоль при 25С. Определить теплоту образования Qv. Аммиака при этой же температуре.
Решение. Согласно условию можно записать:
1/2N2 + 3/2H2 = NH3 + 46,26 кДж/моль (или 46260 кДж/кмоль)
Находим изменение числа молей газа
![]()
Из соотношения
![]() находим
Qv.
находим
Qv.
![]()
