
- •Физическая и коллоидная химия
- •240134 Переработка нефти и газа
- •Содержание
- •2 Рабочая программа учебной дисциплины
- •2.1 Паспорт рабочЕй программы учебной дисциплины Физическая и коллоидная химия
- •2.1.1 Область применения рабочей программы
- •2.1.3 Цели и задачи учебной дисциплины – требования к результатам освоения учебной дисциплины:
- •2.1.4 Рекомендуемое количество часов на освоение рабочей программы учебной дисциплины: Физическая и коллоидная химия
- •2.2 Структура и содержание учебной дисциплины
- •2.2.1 Объем учебной дисциплины и виды учебной работы
- •2.2.2 Тематический план и содержание учебной дисциплины _____Физическая и коллоидная химия_______
- •2.3 Условия реализации учебной дисциплины
- •2.3.1 Требования к минимальному материально-техническому обеспечению
- •2.3.2 Информационное обеспечение обучения
- •Еремин в.В., Каргов с.И. И др. Основы физической химии. Теория и задачи. - м.: Экзамен, 2005. - 480 с.
- •3 Методические указания по изучению учебного материала по теме Введение
- •Вопросы для самоконтроля
- •Методические указания по теме 1.1 Молекулярно-кинетическая теория агрегатных состояний вещества
- •Вопросы для самоконтроля
- •Методические указания по теме 1.2 Основы химической термодинамики
- •Вопросы для самоконтроля
- •Методические указания по теме 1.3 Химическая кинетика
- •Вопросы для самоконтроля
- •Методические указания по теме 1.4 Катализ
- •Вопросы для самоконтроля
- •Методические указания по теме 1.5 Химическое равновесие
- •Решение. Используем формулу
- •Вопросы для самоконтроля
- •Методические указания по теме 1.6 Фазовое равновесие
- •Вопросы для самоконтроля
- •Методические указания по теме 1.7 Растворы
- •Вопросы для самоконтроля
- •Методические указания по теме 1.8 Электрохимия
- •Вопросы для самоконтроля
- •Методические указания по теме 2. 1 Дисперсные системы
- •Вопросы для самоконтроля
- •Литература: [1], с.214-216, с.230-259, с. 263-271; [2], с.329-373; [3], с.209-214; [4], с.165-170
- •Вопросы для контрольной работы №1
- •5 Список вопросов к экзамену
Вопросы для самоконтроля
Что называется теплоемкостью вещества?
Теплоемкость газов. Взаимосвязь между Сv и С р.
Что называется внутренней энергией? От чего она зависит?
Что называется тепловым эффектом реакции?
Вывести взаимосвязь между изобарным и изохорным тепловым эффектом.
Закон Гесса. Следствия из закона Гесса.
Что называется теплотой образования?
Как рассчитывается тепловой эффект неорганических реакций?
Что называется теплотой сгорания?
Как рассчитывается тепловой эффект органических реакций?
Как рассчитывается теплота образования органических веществ?
Что называется внутренней энергией? От чего она зависит?
Что называется тепловым эффектом реакции?
Что такое необратимые и обратимые процессы?
Что такое «связанная» и «свободная» энергия?
Закон Кирхгофа.
Каким способом можно получить перегретый пар?
Какой пар называют влажным, сухим насыщенным и перегретым?
Как можно определить параметры паров?
Что является основными параметрами водяного пара?
Литература: [1], с.27-54, с.57-70; [2], с.71-107; [3], с.43-61, с.68-85; [4], с.27-54, с.77-85
Методические указания по теме 1.3 Химическая кинетика
При изучении данной темы необходимо уяснить, что основной закон химической кинетики – закон действия масс. Четко знать и определять зависимость факторов, влияющих на скорость химической реакции. Уметь определять константы скоростей реакций первого, второго и третьего порядков, а также знать зависимость константы скорости реакции от периода полураспада.
Особое внимание уделите теории активации Аррениуса и ее практическому применению.
При изучении данной темы обратить внимание на цепные реакции, их особенности, характеристику и механизм этих реакций, а также применение радиационно-химических процессов в химической промышленности.
Пример 1 Как изменятся скорости прямой и обратной реакций N2 + O2 ↔ 2NO;
протекающих в закрытом сосуде при высокой температуре, если увеличить давление в 3 раза?
Решение. При увеличении давления в 3 раза объём газовой смеси уменьшится в 3 раза, а мольные концентрации веществ во столько же раз увеличатся.
Согласно закону действия масс можно написать:

При увеличении давления в 3 раза концентрации станут равными
![]()
Поэтому

Находим отклонения:
![]() т.е.
скорость прямой реакции увечиться в 9
раз.
т.е.
скорость прямой реакции увечиться в 9
раз.
![]() т.е.
скорость обратной реакции увеличится
в 9 раз.
т.е.
скорость обратной реакции увеличится
в 9 раз.
Пример 2 Реакция разложения перекиси водорода в водном растворе протекает как реакция первого рода. Период половины превращения Н2О2 при заданных условиях равен 15,86 мин. Определить, какое время потребуется для разложения (при тех же условиях) 99% Н2О2.
Решение.
По периоду половины превращения,
используя
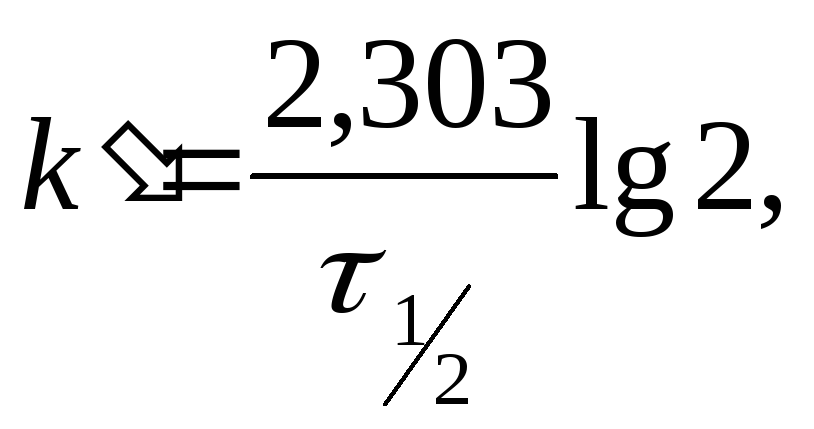 вычисляем константу скорости разложения
водорода:
вычисляем константу скорости разложения
водорода:![]()
из формулы
![]() определяем
время, за которое разложится 99% перекиси
водорода: а = 100% а – х = 100 – 99 = 1%
определяем
время, за которое разложится 99% перекиси
водорода: а = 100% а – х = 100 – 99 = 1%
![]()
Пример 3 Тростниковый сахар в присутствии ионов водорода подвергается гидролизу с образованием глюкозы и фруктозы (реакция тростникового сахара):
![]()
Определить
количество сахара (масс. доли, %),
вступающего в реакцию через 5ч от начала
опыта:
![]() ;
;![]() ;
;![]() ;
а = 4,544а – 4,544х; 4,544х = 3,544а
;
а = 4,544а – 4,544х; 4,544х = 3,544а![]()
Следовательно, за 300 мин прореагирует 77,96% первоначально взятого количества сахара.
Пример 4 Используя приближенное правило Вант – Гоффа, вычислить, на сколько нужно повысить температуру, чтобы скорость реакции возросла в 80 раз? Температурный коэффициент скорости принять равным 3.
Решение. Используя
уравнение
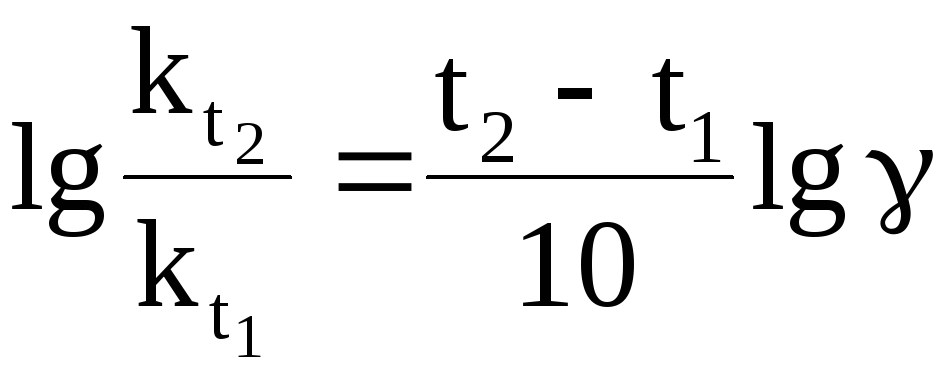 ;
;
![]() ;
;
![]() º
º
Таким образом, чтобы скорость реакции возросла в 80 раз, необходимо повысить температуру примерно на 40ºС.
Пример 5 Для одной из реакций были определены две константы скорости при 443ºС 0,0067 и при 497ºС 0,06857. Определить константу скорости этой же реакции при 508ºС.
Решение. По двум значениям констант скорости реакции, используя
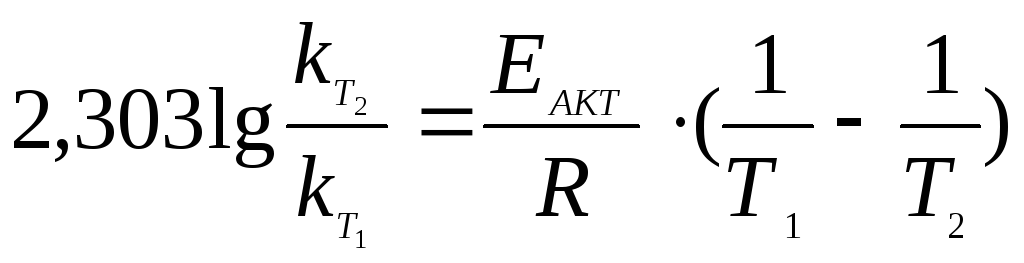 определить величину
энергии активации реакции
определить величину
энергии активации реакции
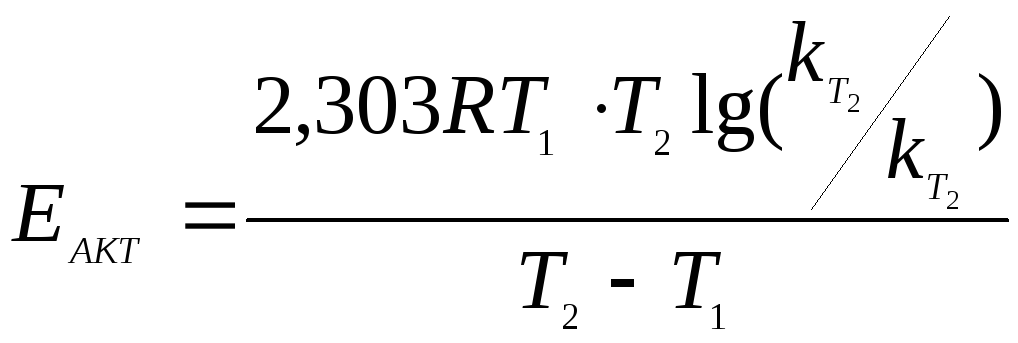 ;Т1
=716 К; Т2
= 770 К.
;Т1
=716 К; Т2
= 770 К.
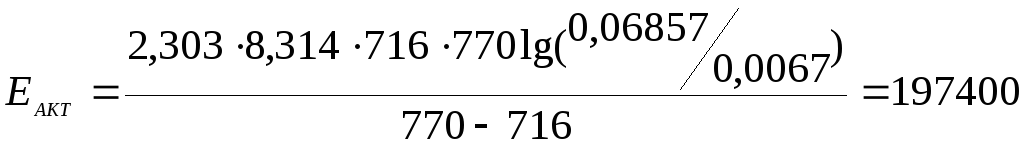 Дж/моль
Дж/моль
Рассчитывается
константа скорости реакции при t = 508ºС.
Используется в расчетах константа
скорости при 497ºС и уравнение
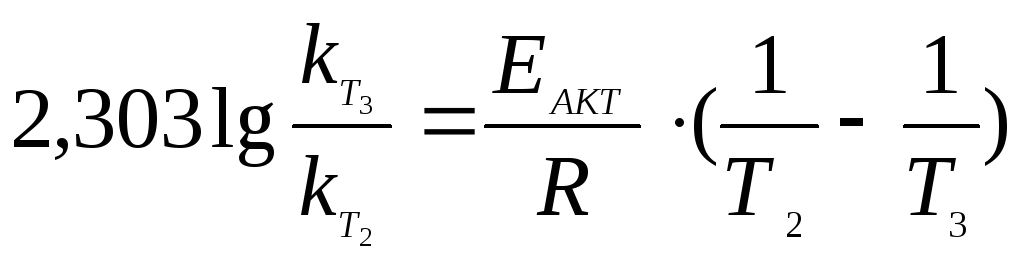 ;
;
Т3
= 781 К; Т2
= 770 К.
![]()
![]()
