
- •Физическая и коллоидная химия
- •240134 Переработка нефти и газа
- •Содержание
- •2 Рабочая программа учебной дисциплины
- •2.1 Паспорт рабочЕй программы учебной дисциплины Физическая и коллоидная химия
- •2.1.1 Область применения рабочей программы
- •2.1.3 Цели и задачи учебной дисциплины – требования к результатам освоения учебной дисциплины:
- •2.1.4 Рекомендуемое количество часов на освоение рабочей программы учебной дисциплины: Физическая и коллоидная химия
- •2.2 Структура и содержание учебной дисциплины
- •2.2.1 Объем учебной дисциплины и виды учебной работы
- •2.2.2 Тематический план и содержание учебной дисциплины _____Физическая и коллоидная химия_______
- •2.3 Условия реализации учебной дисциплины
- •2.3.1 Требования к минимальному материально-техническому обеспечению
- •2.3.2 Информационное обеспечение обучения
- •Еремин в.В., Каргов с.И. И др. Основы физической химии. Теория и задачи. - м.: Экзамен, 2005. - 480 с.
- •3 Методические указания по изучению учебного материала по теме Введение
- •Вопросы для самоконтроля
- •Методические указания по теме 1.1 Молекулярно-кинетическая теория агрегатных состояний вещества
- •Вопросы для самоконтроля
- •Методические указания по теме 1.2 Основы химической термодинамики
- •Вопросы для самоконтроля
- •Методические указания по теме 1.3 Химическая кинетика
- •Вопросы для самоконтроля
- •Методические указания по теме 1.4 Катализ
- •Вопросы для самоконтроля
- •Методические указания по теме 1.5 Химическое равновесие
- •Решение. Используем формулу
- •Вопросы для самоконтроля
- •Методические указания по теме 1.6 Фазовое равновесие
- •Вопросы для самоконтроля
- •Методические указания по теме 1.7 Растворы
- •Вопросы для самоконтроля
- •Методические указания по теме 1.8 Электрохимия
- •Вопросы для самоконтроля
- •Методические указания по теме 2. 1 Дисперсные системы
- •Вопросы для самоконтроля
- •Литература: [1], с.214-216, с.230-259, с. 263-271; [2], с.329-373; [3], с.209-214; [4], с.165-170
- •Вопросы для контрольной работы №1
- •5 Список вопросов к экзамену
Вопросы для самоконтроля
Что такое скорость реакции?
Сформулировать закон действия масс.
Что такое молекулярность реакций и как классифицируются реакции по этому признаку?
Вывести кинетическое уравнение реакции 1- го порядка.
Написать кинетическое уравнение реакции 2-го порядка.
Уравнение Аррениуса и его значение.
Что называется энергией активации? Сделать рисунок для экзотермической и эндотермической реакций и пояснить. Формула для расчета энергии активации.
Методы активации.
Что такое цепная реакция? Каковы стадии цепной реакции? Написать механизм какой-либо цепной реакции по стадиям.
Что называется цепной разветвленной реакцией?
Что называется цепной неразветвленной реакцией? Написать ее механизм на каком-нибудь примере.
Литература: [1], с.173-180, 184-198; [2], с.101-124,135-143; [3], с.112-120, 131-135; [4], с.105-112
Методические указания по теме 1.4 Катализ
В этой теме надо усвоить такие вопросы, как: закон действия масс, молекулярность и порядок реакций, зависимость скорости реакции от температуры. Особое внимание надо обратить на энергию активации, и её физический смысл. Четко знать определения гомогенного и гетерогенного катализа, современные представления о механизме и теориях гетерогенного катализа. Знать принцип минимума свободной энергии в применении к каталитическим процессам. При изучении процесса катализа обратите внимание на механизм этого процесса и значение катализа для промышленности и в решении ряда экологических вопросов.
Вопросы для самоконтроля
Что такое катализ и автокатализ?
Механизм гомогенного катализа (дать в общем виде и на конкретном примере).
Теории гетерогенного катализа.
Литература: [1], с.204-213; [2], с.129-132, 143-150; [3], с.124-127
Методические указания по теме 1.5 Химическое равновесие
Изучая данную тему, обратите внимание на то, что при расчете константы равновесия в числителе пишут концентрации или парциальные давления конечных веществ, а в знаменателе – исходных (с учетом стехиометрических коэффициентов). Если же реакция гетерогенная, то при расчете константы равновесия Кр учитываются только газообразные вещества. Уделите больше внимания принципу Ле Шателье, который говорит о направлении смещения химического равновесия при изменении внешних условий.
Самое главное при изучении уравнений изотермы, изохоры и изобары – это их применение.
Особое внимание заслуживает вопрос об истинном химическом равновесии, так как истинным (или устойчивым) равновесием называется такое состояние системы, которое не изменяется с течением времени при неизменных внешних условиях, причем эта неизменяемость не обусловлена протеканием какого-либо внешнего процесса. Если внешние условия изменяются, то состояние равновесия нарушается, но через некоторое время наступает новое состояние равновесия.
Пример 1
При нагревании водорода и йода в закрытом
сосуде до 444ºС обратимо протекает реакция
по уравнению
![]() Н2
+ I2
Н2
+ I2
![]() 2НI.
Равновесная смесь при этой температуре
содержит 5,64 моль НI;
0,12 моль I2
и 5,28 моль Н2.
Вычислить константу равновесия указанной
реакции и исходные концентрации водорода
и йода.
2НI.
Равновесная смесь при этой температуре
содержит 5,64 моль НI;
0,12 моль I2
и 5,28 моль Н2.
Вычислить константу равновесия указанной
реакции и исходные концентрации водорода
и йода.
Решение.
Согласно
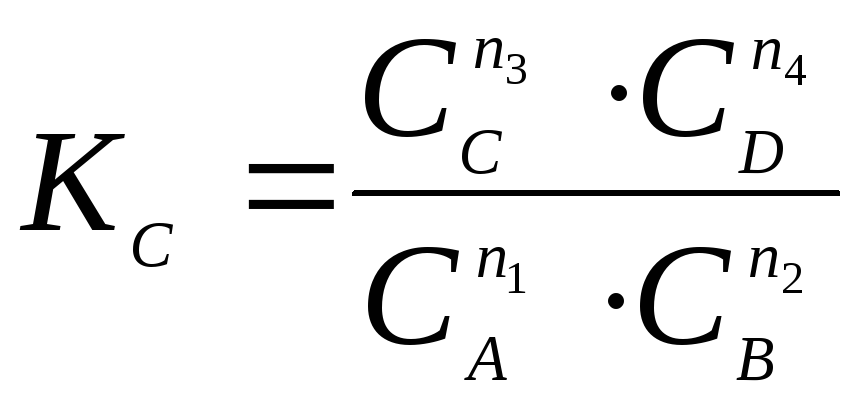 для данной реакции
для данной реакции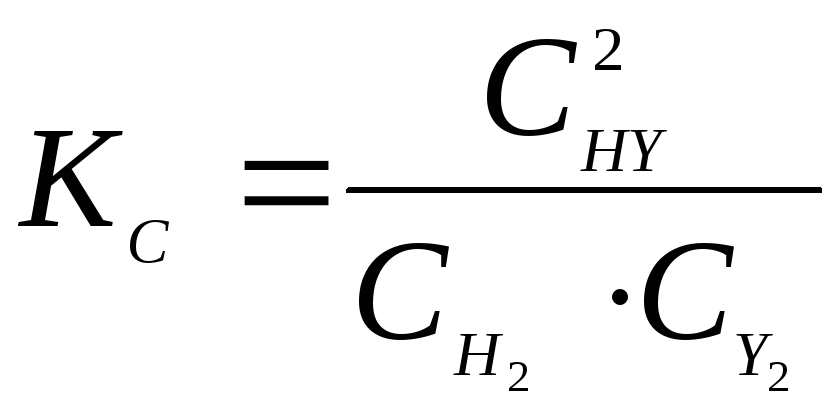
![]()
Так как данная реакция протекает без изменения объёма, то значение константы будет одинаково при всех способах выражения равновесных концентраций веществ. Вместо концентраций СНI ; СН2; СI2можно подставить числа молей этих веществ:
![]()
Определяем исходные
концентрации йода и водорода. Согласно
уравнению реакции для образования 2
моль НI
расходуется по 1 моль Н2
и I2.
К моменту достижения равновесия в смеси
образовалось 5,64/2 моль Н2
и I2.
Учитывая равновесные концентрации Н2
и I2,
рассчитываем исходные концентрации
этих веществ суммированием:![]() моль
моль![]() моль
моль
Пример 2 Константа равновесия реакции
СН3СООН + С2Н5СОН СН3СООС2Н5 + Н2О
при некоторой температуре равна 4. Определить состав реакционной смеси при равновесии, если в реакцию введены 1 моль кислоты и 2 моль спирта.
Решение.
Используем формулу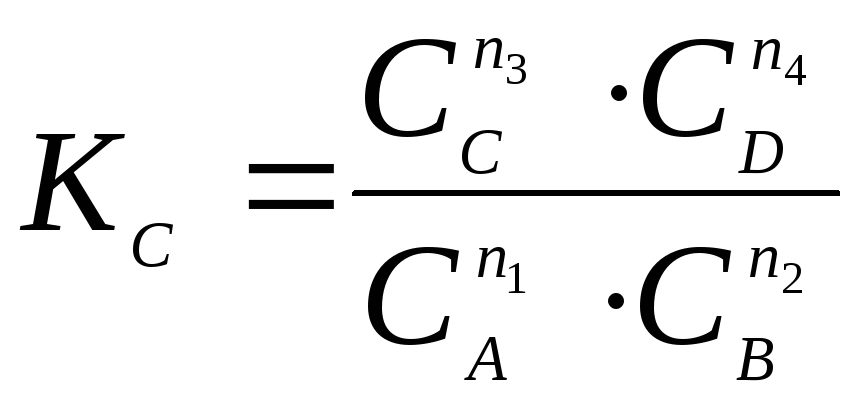 . Обозначим число молей эфира, образующего
в равновесной смеси, через х. Такое же
количество (х молей) выделится и воды.
Количество кислоты к моменту равновесия
останется (1 - х) моль, а спирта (2-х) моль.
Тогда
. Обозначим число молей эфира, образующего
в равновесной смеси, через х. Такое же
количество (х молей) выделится и воды.
Количество кислоты к моменту равновесия
останется (1 - х) моль, а спирта (2-х) моль.
Тогда![]() откуда
х2
= 4(1- х)( 2 - х)
откуда
х2
= 4(1- х)( 2 - х)
3х2 - 12х + 8 = 0.
Решая это квадратное уравнение, получим х1 = 3,154 и х2 = 0,845. Первый корень отбрасывается как не удовлетворяющий условию задачи. Таким образом, в момент установившегося равновесия состав реакционной смеси (моль): эфир 0,845; вода 0,845; уксусная кислота 0,155; спирт 1,155.
Пример 3 Константа равновесия КР реакции синтеза аммиака
N2 + 3H2 2NH4
при 3500С равна 2,3210-13. Вычислить КС для этого процесса при этой же температуре.
