
Концепции современного естествознания
.pdfТаким образом, атом-динамическая система, включающая в себя физические точки кварки, электроны и виртуальные фотоны. Например, атом водорода на самом деле представляет систему, состоящую их трех физических точек-кварков, точки-электрона и великого множества виртуальных фотонов.
В ходе химических превращений происходит перестройка электронных оболочек взаимодействующих атомов, молекул и ионов, и перераспределение сил химической связи, что приводит либо к выделению энергии (если итогом взаимодействия является упрочнение связей между атомами, ионами и молекулами), либо к поглощению (если эти связи становятся более слабыми, рыхлыми). Поэтому для всех химических реакций характерны не только глубокие качественные изменения и строго определенные стехиометрические соотношения между количествами исходных и образующихся в результате реакции веществ, но и вполне определенные энергетическиеэффекты.
Тесная взаимосвязь между превращениями одних видов материи в другие (или между переходами их из одного состояния в другое) и энергетическими эффектами, сопровождающими эти превращения, характерна практически для всех процессов, происходящих в природе. В связи с этим нельзя не преклоняться перед гением великого ученого земли русской – М.В. Ломоносовым, который за несколько десятилетий до А. Лавуазье и за столетие до Д. Джоуля, Р. Майера и Г.Л. Гельмгольца сформулировал законы сохранения и превращения материи и энергии как единый, всеобщий закон сохранения материи и движения.
Химические реакции широко используются во многих производственных процессах. Они (например, процессы окисления, коррозии и др.) протекают при работе установок, машин и приборов. Получение электроэнергии, топлива, металлов, различных материалов, продуктов питания и т. п. непосредственно связано с химическими реакциями. Например, в настоящее время электрическую и механическую энергии получают в основном преобразованием химической энергии природного топлива. В процессе этого преобразования происходят сложные химические реакции: горения, взаимодействия воды и ее примесей с металлами ит.п.
Без понимания этих процессов невозможно обеспечить эффективную работу электростанций и двигателей внутреннего сгорания. Велика роль химических процессов и в атомной энергетике, значение которой непрерывновозрастает.
Использование химических реакций в ряде производственных процессов позволяет резко повышать производительность труда и качество продукции, получать новые материалы.
Понимание законов химии и их использование исключительно важно при
211
решении проблемы повышения эффективности производства и качества продукции, так как ухудшение качества и надежности продукции во многих случаях вызывается нежелательными химическими процессами, например коррозией металлов, старением полимеров и т.п. Изучение механизмов химических реакций позволяет выбрать рациональные методы охраны окружающей среды, создавать новые экологически чистые процессы. Химизация любой отрасли хозяйства приносит большой экономический эффект.
5.1. Электронные конфигурации атомов химических элементов
Представьте себе двести замечательных скрипачей, играющих одну и ту же пьесу на прекрасно настроенных инструментах, но не в унисон. Результат будет не из приятных, и даже человек с хорошим слухом не поймет, что они играют. Аналогичную музыку издают молекулы газов, жидкостей и обычных твердых тел…
В. Фогт
Основной характеристикой, определяющей состояние электрона в поле ядра атома, в современной квантовой механике является энергия. Энергия электрона, как и энергия фотона, принимает не любые, а лишь определенные дискретные (квантующиеся) значения.
Квантовые числа, как и энергия электрона, могут принимать только вполне определенные значения, причем такие, чтобы соседние отличались друг от друга на единицу.
Главное квантовое число n с точки зрения волновых представлений об электроне определяет, насколько удалено данное электронное облако от ядра. Чем больше значение n, тем слабее связан электрон с ядром, тем на более высоком энергетическом уровне находится и тем большей энергией он обладает. Главное квантовое число может принимать значения целых чисел от 1 до ∞, но для электронов в невозбужденных атомах открытых до сих пор элементов оно изменяется реально от 1 до 7. (Если будет искусственно синтезирован элемент порядкового номера 126, то его атомы будут включать энергетический уровень, отвечающий n = 8). Энергетические уровни, для которых n = 1,2,3,4,5,6,7 называются, соответственно, K-, L-, M-, N-, O-, P-, Q- уровнями. Если, например, n = 3, то говорят, что электрон находится на третьем (считая от ядра) уровне или на М- уровне.
Орбитальное, или побочное, квантовое число l характеризует различное энергетическое состояние электронов в пределах данного уровня, его значения определяют распределение электронов по подуровням данного уровня.
212
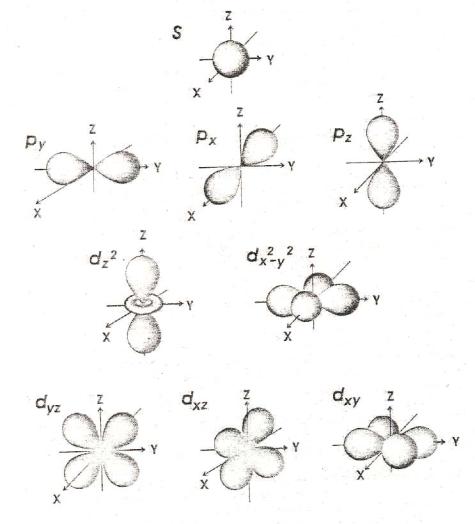
С точки зрения волновых представлений орбитальное квантовое число l характеризует форму электронного облака, пространственную область его наиболее вероятного нахождения. Для s-электронов (l = 0) характерна форма шара, для p-электронов – гантели, для d-электронов – форма четырёхлопастного винта (или гантели, окруженной кольцевым облаком), для f-электронов эта форма ещё сложнее.
Рис. 22. Форма и ориентация s-, p-, d-атомных орбиталей
Для электронов, находящихся на энергетическом уровне с главным квантовым числом n, орбитальные квантовые числа l могут принимать значения 0,1,2,3,… до (n – 1), т.е. возможное число подуровней в каждом энергетическом уровне связано с главным квантовым числом. Так, на четвёртом энергетическом уровне (n = 4) возможно заполнение четырёх подуровней, для которых l могут принимать значения 0,1,2 и 3.
Электроны, которым отвечают значения побочного квантового числа l = 0,1,2 и 3, называются, соответственно, s-, p-, d- и f- электронами.
В состав уровней входят следующие подуровни: |
(l = 0) |
||
1-й уровень (К) |
n=1 |
s-подуровень |
|
213
2-й уровень (L) |
n=2 |
s-подуровень |
(l = 0) |
|
|
p-подуровень |
(l = 1) |
3-й уровень (M) |
n=3 |
s-подуровень |
(l = 0) |
|
|
p-подуровень |
(l = 1) |
|
|
d-подуровень |
(l = 2) |
4-й уровень (N) |
n=4 |
s-подуровень |
(l = 0) |
|
|
p-подуровень |
(l = 1) |
|
|
d-подуровень |
(l = 2) |
|
|
f-подуровень |
(l = 3) |
Атомы, у которых заполнялось более четырёх подуровней, пока неизвестны, но если будет открыт элемент порядкового номера 126, вероятно, будут основания говорить и об атомах с застройкой подуровня 5g (n = 5, l
= 4).
Электронное облако, форма которого определяется значением побочного квантового числа l , а общий запас энергии – значением главного квантового числа n, называется атомной орбиталью (АО).
Магнитное квантовое число ml характеризует магнитный момент электрона, обусловленный его движением в поле ядра. Оно определяет ориентацию электронного облака относительно произвольно выбранных направлений (взаимно перпендикулярных осей x,y, и z) или относительно внешнего магнитного поля.
Магнитное квантовое число принимает целочисленные значения от –l до +l, включая и нуль, т.е. всего (2l + 1) значений, которым отвечают (2l + 1) энергетических состояний, возможных для электронов данного подуровня. Например, для f-электрона, для которого l = 3, магнитное квантовое число может иметь (2 · 3+1) значений, а именно ml = –3, –2, –1, 0, +1, +2, +3. Для s-электронов при l = 0 и ml = 0 это соответствует тому, что для электронного облака шаровидной формы не существует различных вариантов его ориентации в пространстве. Все направления равнозначны. Для p-электронов, имеющих форму гантели, l = 1 и ml может принимать 3 значения, чему отвечают 3 варианта взаимной ориентации этих орбиталей: вдоль осей x,y и z. У более сложных по своей конфигурации d- и f-электронов существует 5 и 7 вариантов соответственно их взаимного расположения в пространстве. Знание такой взаимной ориентации в пространстве атомных орбиталей p-, d- и f- электронов позволяет объяснить направленный характер химической связи, расположение химических связей в пространстве под вполне определенными углами.
Спиновое квантовое число ms характеризует внутреннее движение электрона, приводящее к возникновению у последнего собственного магнитного поля. Спиновое квантовое число может принимать только два значения: ± ½ ђ или сокращенного ms = ±½ в зависимости от того, парал-
214
лельно или антипараллельно ориентируется собственное магнитное поле электрона относительно магнитного поля, обусловленного движением электрона вокруг ядра. Числовые значения для двух возможных вариантов спинового квантового числа выбраны с таким расчетом, чтобы было соблюдено ранее указанное условие: соседние значения квантовых чисел должны отличаться на единицу.
Два электрона с одинаковыми значениями главного, побочного и магнитного квантовых чисел, но с различными значениями спинового квантового числа (электроны имеют антипараллельные, т.е. противоположно направленные спины) называют спаренными или неподеленной парой электронов. Их обычно обозначают в виде двух стрелок, имеющих противоположное направление (↑↓). Электроны с параллельными (некомпенсированными) спинами называют неспаренными и обозначают (↑↑).
Распределение электронов в атомах элементов определяется тремя основными положениями: принципом запрета Паули, принципом наименьшей энергии, а также правилом Гунда.
Согласно принципу запрета, установленному швейцарским физиком В. Паули (1925): в атоме не может быть двух электронов с одинаковыми значениями всех четырёх квантовых чисел.
Паули установил, что максимальное количество электронов, которое может находиться на n-ом уровне, так, чтобы не нарушалось это условие, определяется по формуле x = 2n2. Так, на первом уровне может находится не более двух электронов, на втором – 8, на третьем – 18, на четвертом –
32, на пятом – 50.
Согласно принципу наименьшей энергии размещение электронов должно отвечать наибольшей связи их с ядром, т.е. электрон прежде всего занимает такие положения (из числа не запрещенных принципом Паули), при которых он будет обладать наименьшим запасом энергии.
Так как энергия электрона в основном определяется значением главного квантового числа n и, в меньшей степени, значением побочного числа l, то согласно правилу В.М. Клечковского:
По мере увеличения заряда ядра атома заполнение подуровней осуществляется в таком порядке, при котором электрон в первую очередь поступает на подуровень, для которого значение суммы главного и орбитального квантовых чисел (n + l) оказывается меньшим. Если сумма (n +l) оказывается одинаковой для двух или трёх подуровней, то электрон в первую очередь поступает на подуровень с большим значением главного квантового числа. Правило имеет 18 исключений.
Наибольшее количество электронов, которое может разместиться на s- подуровне любого уровня равно 2, на p-подуровне их может разместиться не более 6, на d-подуровне – 10 и на f-подуровне – 14.
215
При описании электронных структур отдельных атомов для условной записи принята следующая символика. Вначале арабскими цифрами указывают номер уровня, а далее буквенным символом s-, p-, d-, f- или g- подуровень, к которому относятся электроны, и, наконец, верхним цифровым индексом справа от этого символа – количество электронов на рассматриваемом подуровне. Так, например, запись 3p6 означает, что на p- подуровне (l = 1) третьего уровня (n = 3) располагается 6 электронов; а запись 5f 3 – что на f-подуровне (l = 3) пятого уровня (n = 5) находится 3 электрона.
Так как минимальное значение суммы n + 1 равно единице, то у атома водорода (Z = 1) единственный электрон находится в состоянии с n = 1, l = 0. Стабильное состояние атома водорода обозначают символом 1s1. Иногда для обозначения состояния электронов используют следующий метод. Клеткой (квантовая ячейка) обозначают орбиталь, стрелкой – электрон (направление стрелки указывает ориентацию спина электрона), пустая клетка соответствует свободной орбитали. В этом случае состояние электрона в атоме водорода будет изображаться следующим спосо-
бом: 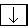 . 1 s
. 1 s
Так как минимальное значение суммы n + l = 1 могут иметь два электрона (x = 2n2 = 2), то оба электрона следующего элемента – гелия – характеризуется одинаковыми значениями n, l и ml и отличаются лишь направлениями спина ms.
Такое состояние выражается квантовой ячейкой 1s 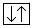 или электронной формулой 1s2. Из-за отсутствия в атоме гелия неспаренных электронов его валентность равна 0. Полная химическая инертность гелия обусловлена необычайно высокой стабильностью состояния 1s2 в сравнении с другими энергетическими состояниями. Гелием завершается первый период периодической системы и этому соответствует завершение застройки электронных состояний с n = 1.
или электронной формулой 1s2. Из-за отсутствия в атоме гелия неспаренных электронов его валентность равна 0. Полная химическая инертность гелия обусловлена необычайно высокой стабильностью состояния 1s2 в сравнении с другими энергетическими состояниями. Гелием завершается первый период периодической системы и этому соответствует завершение застройки электронных состояний с n = 1.
У следующего элемента – лития (Z = 3), которым открывается II период, начинается заполнение электронных орбиталей с n = 2. Из двух возможных значений орбитального квантового числа (l = 1 и l = 0) сначала реализуется l = 0, так как оно соответствует минимуму суммы n + l. Стабильное состояние атома лития выражается формулой 1s2 2s1 или
квантовыми ячейками 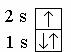 . У лития один неспаренный электрон, поэтому он может образовывать одну ковалентную связь.
. У лития один неспаренный электрон, поэтому он может образовывать одну ковалентную связь.
У бериллия (Z = 4) завершается заполнение 2s – орбиталей. Атом бе-
216

риллия не имеет неспаренных электронов и поэтому в стабильном состоянии имеет нулевую валентность. Однако при поглощении энергии он сравнительно легко переходит в возбужденное состояние, что сопровождается переходом электрона на орбиталь с большей энергией:
В возбужденном состоянии атом бериллия имеет два неспаренных электрона и образует две ковалентные связи (BeF2, BeH2).
У бора (Z = 5) начинается заполнение состояний n + l = 3 (n = 2; l = 1). Поэтому электронная конфигурация бора следующая:
5B 1s22s22p1 или
В стабильном состоянии атом бора имеет один неспаренный электрон, следовательно, он должен образовывать одну ковалентную связь. Между тем хорошо известно, что в большинстве соединений бор трехвалентен. Последнее объясняется близостью энергии 2s- и 2pсостояний. У бора легко происходит переход электронов:
Возникают три неспаренных электрона. Примечательно, что образуемые ими связи энергетически равноценны.
Для определения состояния электронов в атомах углерода и последующих за ним элементов следует учитывать закономерность, получившую название правила Хунда: электроны располагаются на одинаковых орбиталях таким образом, чтобы суммарный спин был максимален.
Это объясняется тем, что электроны, имеющие отрицательный заряд, вследствие отталкивания друг от друга стремятся занять, если имеется возможность, разные квантовые ячейки.
С учетом правила Хунда электронные конфигурации атомов углерода, азота, кислорода, фтора, неона будут следующие:
6C 1s2 2s2 2px1 2py1 |
или |
7N 1s2 2s2 2px1 2py1 2pz1 |
или |
217
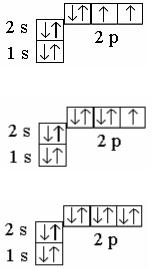
8O 1s2 2s2 2px2 2py1 2pz1 |
или |
9F 1s2 2s2 2px2 2py2 2pz1 |
или |
10Ne 1s2 2s2 2px2 2py2 2pz2 |
или |
Символы 2px, 2py и |
2pz обозначают ориентацию 2p-орбиталей в про- |
странстве вдоль осей x, y и z.
Унеона (Z = 10) завершается заполнение энергетических состояний, отвечающих n = 2 (x = 2n2 = 8). Эта особенность находит отражение в периодической таблице, в которой неоном завершается II период. Отсутствие неспаренных электронов и очень высокая стабильность основной электронной конфигурации объясняют высокую инертность неона.
Уэлементов III периода порядок заполнения энергетических состоя-
ний электронами аналогичен элементам II периода:
11Na 1s22s22p63s1 12Mg 1s22s22p63s2
13Al |
1s22s22p63s23px1 |
iS14Si 1s22s22p63s23px13py1 |
|
15P |
1s22s22p63s23p1x 3p1y 3p1z |
16S |
1s22s22p63s23px2 3py1 3pz1 |
17Cl |
1s22s22p63s23px2 3py2 3pz1 |
18Ar 1s22s22p63s23p2x 3p2y 3p2z
У аргона (Z = 18), являющегося последним элементом III периода, завершается застройка состояний n + l = 4 при n = 3 и l = 1. Вместе с тем остаются вакантные уровни с n + l = 4 при n = 4 (l = 0). Таких состояний всего два, и именно они должны застраиваться у последующих элементов. Поэтому калий (Z = 19) и кальций (Z = 20) имеют такие электронные кон-
фигурации:
19K 1s22s22p63s23p64s1 20Ca 1s22s22p63s23p64s2
Со следующего элемента – скандий (Z = 21) – начинается застройка энергетических состояний, отвечающих n + l = 5. Так как в пределах этой суммы энергетически более выгодны состояния с минимальными значениями n, а им может быть только n = 3 (l = 2), то у скандия начинается за-
218
полнение 3d-орбиталей:
21Sc 1s22s22p63s23p63d14s2
У следующих в порядке возрастания атомного номера элементов продолжается застройка 3d – орбиталей. Так как общее число таких орбиталей равно пяти, а их заполнение начинается у скандия (Z = 21), то следует ожидать, что оно закончится у цинка (Z = 30). Элементы от скандия до цинка, у которых происходит заполнение электронами 3d-орбиталей, называются 3d-элементами. В периодической таблице эти элементы входят в состав побочных подгрупп. Итак, у цинка завершается застройка 3d-
орбиталей (n = 3; l = 2):
30Zn 1s22s22p63s23p63d104s2
Но в пределах суммы n + l = 5 остаются вакантные состояния n = 4 (l = 1) и n = 5 (l = 0). Поскольку из этих двух наборов состояний энергетически более выгоден первый, то у последующих за цинком элементов IV периода происходит заполнение 4p-орбиталей. Так как общее число таких состояний равно шести, то они полностью заполняются у криптона, кото-
рым заканчивается IV период:
36Kr 1s22s22p63s23p63d104s24p6
Возможные энергетические состояния и порядок их заполнения у более тяжелых элементов определяются теми же принципами, что и у ранее рассмотренных элементов (принцип Паули, правила Хунда и Клечковского). Важнейшим следствием применения этих принципов является периодичность изменения электронной структуры атомов при переходе от одного элемента к другому в порядке возрастания порядкового номера (заряда ядра).
5.2. Периодический закон Д.И.Менделеева
«Иногда меня спрашивают, как можно быть уверенным, что где-то во Вселенной не существует большого числа элементов, чем в периодической системе. Пытаясь ответить на этот вопрос, я говорю, что он подобен вопросу – откуда известно, что где-нибудь во Вселенной не существует еще одного целого числа между 4 и 5? К сожалению, кому-то кажется, что это тоже разумный вопрос»
Джордж Уальд
Русский учёный Д.И.Менделеев открыл в 1869 году периодический закон химических элементов, согласно которому свойства элементов, а также свойства образуемых ими веществ находятся в периодической зависимости от их атомной массы. Этот закон составляет основу периодической системы, элементы которой располагаются в ней горизонтальными рядами в порядке увеличения атомной массы.
219
В 1961 г. в качестве единой была установлена углеродная шкала атомной массы, в которой за единицу принята 1/12 массы легкого изотопа углерода 12C, называемая атомной единицей массы (а.е.м.). Поскольку последняя очень мала (1,993 · 10–26 кг), то для удобства используют относительные атомные массы, вычисляемые как отношение массы данного атома к а.е.м.
Понятие «элемент» абстрактное, в то время как понятие «металл» и «неметалл» – конкретные. Таким образом нельзя называть химические элементы металлами или неметаллами, т.к. эти названия относятся к веществам.
Химические элементы образуют простые и сложные вещества, которые в зависимости от условий обладают или не обладают металлическими свойствами или неметаллическими.
Периодический закон химических элементов, обусловил рационализацию значительного эмпирического материала, накопленного химией. Это позволило укрепить теоретический фундамент химии и повысить её уровень до уровня науки современного типа. Более того, действие периодического закона выходит за пределы непосредственного химического знания – он стал одним из основных в системе естествознания. Именно в рамках этого закона раскрывается взаимосвязь различных уровней материи: электронов, атомов, молекул, кристаллов. Позднее, в связи с успехами квантовой теории, физика помогла составить представление об атоме элемента как о сложной квантово-механической системе. Место элемента получило новый смысл, оказавшись обусловленным зарядом ядра атома
(Z). На этой основе были выяснены особенности строения электронных орбит всех элементов и раскрыт физический смысл периодического закона.
Химический элемент – это совокупность нуклидо-электронных систем с одинаковым порядковым номером (зарядом ядра атомов).
Введение порядкового или атомного номера в качестве фундаментальной характеристики элемента позволило уточнить многие другие свойства химических элементов, например, установить взаимосвязь между физическими и химическими свойствами и, более того, оценить их изменение в зависимости от атомного номера.
Если периодический закон предложил исходные теоретические принципы для обобщения экспериментальных данных в физике микромира, то развитие физических наук, в свою очередь, способствовало углублению содержания периодического закона. Именно физические исследования показали, что по мере возрастания зарядов ядер в атомах элементов последовательно увеличивается количество электронов в виде периодического повторения исходных группировок во внешних слоях электронных
220
