
Концепции современного естествознания
.pdf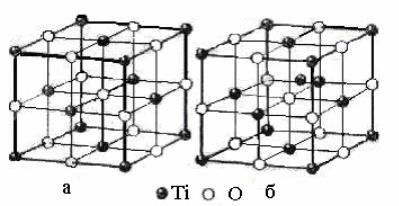
молекулярной структурой. Для них твердое состояние наиболее устойчиво и энергетически выгодно. Поэтому для превращения их в жидкость или пар необходимо затратить энергию (теплоты плавления и испарения). У таких веществ молекулы (например, молекулы NaCl в парах), по существу, представляют собой возбужденное состояние вещества с большим запасом внутренней энергии, а не нормальное.
В то же время в твердых неорганических веществах, как правило, отсутствуют молекулы. Поэтому на первый взгляд может показаться, что теория химического строения Бутлерова не применима для типичных неорганических соединений. На самом же деле такой вывод является преждевременным. Дело в том, что основная идея Бутлерова о взаимозависимости между химическим строением и свойствами остается в силе и для веществ, не имеющих молекулярной структуры. Только для последних вместо химического строения вводится понятие кристаллохимического строения.
Рис. 24. Кристаллическая решетка стехиометрического оксида титана ТiO: а) – идеальная структура; б) – атом титана в междоузлии
Кристаллохимическое строение – порядок расположения и природа связи атомов или ионов в пределах элементарной ячейки, их взаимное влияние друг на друга, а также распределение электронной плотности, величины эффективных зарядов. Как видно из этого определения, понятие кристаллохимического строения представляет собой превращенную форму химического строения молекул применительно к координационным решеткам. Вот почему теория химического строения Бутлерова является общехимической теорией, в одинаковой степени приложимой как к органическим, так и неорганическим объектам [29].
EN PASSANT (фр.) – между прочим
Химик Кекуле работал над формулами органических соединений. Лето было жарким, работа не шла. Однажды вечером он решил прогуляться по городу, зайдя в зоосад, остановился у клетки с обезьянами, которые
231
руками сцепились в кольцо. Вернувшись домой, он записал «круглую» структурную формулу бензола.
На рис.24а приведена кристаллическая структура высокотемпературной модификации стехиометрического оксида титана ТiO. Она показывает только порядок размещения атомов в элементарной ячейке и не отображает природу межатомных связей, а также их взаимное влияние. Вообще кристаллическая структура в той мере отражает кристаллохимическое строение вещества, в какой структурная формула химическое строение молекулы. В действительности химическое и кристаллохимическое строение – понятия динамические, а не статические.
Для веществ немолекулярной структуры не следует писать структурные формулы, так как последние искажают кристаллохимическое строение. Например, в кристаллических структурах карбонатов и сульфатов металлов все кислородные атомы совершенно равноценны, хотя этого нельзя сказать исходя из их структурных формул. Так, хорошо известная
структурная формула  ошибочна:
ошибочна:
1)создает ложное впечатление о существовании в твердом карбонате кальция отдельных молекул СаСО3;
2)из трех атомов кислорода один занимает особое положение. В дей-
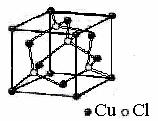
ствительности, в кристаллах СаСО3, все атомы кислорода структурно эквивалентны, и все они связаны как с углеродом, так и с кальцием. Так, формула хлорида меди (1+) Сu–С1 справедлива только для парообразного состояния, в котором и существуют молекулы СuСl (рис. 25).
Рис. 25. Структура хлорида меди (1+)
Таким образом, молекулы СuСl и твердый хлорид меди – это вещества, разные по структуре, следовательно, и по свойствам. Количественный состав твердого хлорида меди такой же, как и молекул: на атом меди приходится атом хлора. Для хлорида меди в парах формула СuCl является истинной, а для твердого состояния – только простейшей. Истинная формула кристаллического хлорида меди может быть написана как для полимерного вещества (СuСl)n.
На рис. 24б представлена идеальная структура стехиометрического оксида титана, когда все атомы размещены по узлам решетки. На
232
рис. 24б один атом титана находится в междоузлии, а узел (откуда ушел атом титана) остается незанятым. Рис. 24б отражает различное кристалллохимическое строение оксида титана одного и того же состава. Как показывают опыт и теория, реальные кристаллы предпочтительнее образуют дефектную структуру (рис. 24б). Концентрация же дефектов (в данном примере атом в междоузлии) находится в зависимости от способа получения и предыдущей обработки вещества.
Итак, кристаллы одного и того же соединения, полученные различными методами, отличаются своей реальной структурой и свойствами. Поэтому при одинаковом качественном и количественном составе веществ с координационной решеткой их свойства зависят от условий получения и предыдущей обработки (например, термической). Здесь в первую очередь речь идет об электрических и оптических свойствах, которые несравненно более чувствительны к нарушениям регулярности решетки и примесям, чем свойства химические. Химические свойства (они основаны на химических реакциях) более чувствительны к тонкостям химического строения молекул. Что касается химических свойств твердых фаз, то современная неорганическая химия ими только начала заниматься.
В химии главными объектами изучения являются химические индивиды. Последние противопоставляются механическим смесям и отличаются от растворов, состоящих из различных химических индивидов. Химический индивид представляет собой фазу, состоящую из одного вида вещества – простого или сложного. Все простые вещества и химические соединения в чистом виде являются химическими индивидами. Кусок металлического алюминия, взятые объемы аммиака, воды и кристаллы поваренной соли – это примеры химических индивидов. Все они представляют собой тела, состоящие из одного вида вещества (атомов алюминия, молекул аммиака и т. п.).
Химическое соединение – однородное вещество постоянного или переменного состава с качественно отличным химическим или кристаллохимическим строением, образованное из атомов одного или нескольких химических элементов. Характерной особенностью химического соединения является его однородность. В «Основах химии» Менделеев пишет: «Ближайший предмет химии составляет изучение однородных веществ...
Химия занимается только однородными телами». «Химическим соединением вообще называют такое соединение двух или более тел, продукт которого представляется нам однородным, однообразным во всех своих мельчайших частицах... Это есть единственное определение, какое можно дать химическому соединению, и в этом отношении неопределенные соединения также совершенно ему подчиняются» (Д.И. Менделеев «Лекции
233
по теоретической химии»).
Таким образом, основатель современной химии Д.И. Менделеев отмечал существование однородных неопределенных соединений, т. е. веществ переменного состава в области гомогенности. К тому же современное учение о фазах не делает принципиального различия между химическими соединениями постоянного и переменного состава. А химическое соединение, по существу, представляет собой фазу, ибо оно всегда однородно. Поэтому состав химического соединения может быть как постоянным (молекулы), так и переменным (координационные кристаллы). В этом также заключается характерная черта определения химического соединения.
Однако фазами переменного состава являются и растворы. В случае газовых растворов, несмотря на их однородность, имеем смесь молекул (например, молекул кислорода, азота, диоксида азота (IV) и т. п. воздуха). В жидких растворах также отсутствуют молекулы с качественно новым химическим строением по сравнению с химическим строением исходных компонентов. Для твердых растворов характерно кристаллохимическое строение компонента-растворителя, т. е. твердый раствор не обладает качественно отличным кристаллохимическим строением. В отличие от них твердое химическое соединение переменного состава характеризуется присущим только ему кристаллохимическим строением. Поэтому в противоположность твердым растворам свойства соединений переменного состава резко отличаются от свойств составляющих веществ. Итак, качественно отличное химическое или кристаллохимическое строение – важнейшая особенность химического соединения.
Наконец, классическая химия к химическим соединениям относила лишь химические индивиды, состоящие из атомов различных элементов. Поэтому, например, молекула кислорода с характерным для нее химическим cтроением и специфическими свойствами не считалась химическим соединением. В действительности понятие химического соединения относится к соединению атомов друг с другом. Соединяющиеся атомы могут принадлежать либо к одному, либо нескольким химическим элементам. Поэтому все простые вещества являются химическими соединениями. Молекулы газов (водород, азот, кислород, и т. д.) состоят из двух атомов, а простых твердых веществ – из огромного числа одинаковых атомов, соизмеримого с числом Авогадро.
Химическому соединению присуще только ему свойственное химическое или кристаллохимическое строение. В химическом или кристаллохимическом строении главное – это химическая связь, ее природа. Именно химические соединения отличаются от смесей наличием химиче-
234
ской связи. С этой точки зрения молекулы и кристаллы, построенные из одинаковых атомов, являются химическими соединениями. Атомы в молекуле водорода связаны ковалентной связью. Все свойства (физические, химические, спектральные и т. п.) молекулярного водорода отличны от атомарного. А по Менделееву в результате химического взаимодействия образуется тело, отличное от взаимодействующих веществ. Еще большее различие в свойствах, например, металлической меди (атомы связаны металлической связью) от свойств составляющих атомов меди. Вообще кажется странным, почему классическая химия считает, что в результате процесса Н+F → Н–F образуется химическое соединение, а в случае Н + Н → Н–Н или F + F → F–F они не возникают? Это по меньшей мере не логично. Естественно признание как гетероатомных (например, НF), так и гомоатомных химических соединений (Н2, F2, металлы и т. п.).
Вкачестве неопределенных соединений с переменным химическим составом Менделеев приводил растворы и сплавы. В металлических сплавах важнейшие структурные составляющие – соединения металлов между собой (металлиды). Характерной особенностью металлидов оказалась изменчивость их состава в определенных границах. Таким образом, металлиды являются типичным примером соединений переменного состава.
Внастоящее время установлено, что к соединениям переменного состава относятся не только металлиды, а вообще все соединения в твердом состоянии. Так, многочисленные оксиды, сульфиды, селениды, теллуриды, нитриды, фосфиды, карбиды, силициды и др., как правило, относятся
ксоединениям переменного состава. Больше того, галогениды металлов в твердом состоянии также представляют собой фазы переменного состава, хотя для доказательства этого требуются более тонкие методы. Рассмотрим некоторые типичные примеры соединений переменного состава.
Известно, что состав природного (пирротин) и искусственно полученного сульфида железа FeS характеризуется «избыточным» содержанием серы против стехиометрии. Согласно стехиометрическому составу в FeS на один атом железа приходится атом серы, т. е. 50 ат. % Fe и 50 ат. % S. В действительности оказалось, что сульфид железа содержит не избыток серы, а в нем недостает атомов железа по сравнению со стехиометрическим составом. В синтетических образцах FeS состав его меняется от 45 до 50 ат. % Fe. Таким образом, формулу сульфида железа
правильнее писать в виде Fe1-xS, где х меняет значения от нуля (50 ат. % железа) до 0,05 (45 ат. % Fe). Для природных кристаллов сульфида железа х колеблется в пределах 0,1–0,2, т. е. наблюдается недостаток атомов железа против формульного состава от 10 до 20 ат. % железа. Это значит,
235
что условия формирования пирротина в земной коре были существенно иными по сравнению с синтетическим сульфидом железа. В то же время природный сульфид железа представляет собой пример истинного нестехиометрического соединения, для которого состав FeS (1:1) является идеальным, а нереальным (х = 0,1–0,2).
Хорошо изученным соединением переменного состава является и оксид железа (2 +) FеО. Как и для моносульфида, в оксиде железа (2+) наблюдается недостаток атомов железа по сравнению со стехиометрическим составом. Поэтому формулу оксида железа (2+) следует изображать Fe1-xO. Нестехиометричность и оксида и моносульфида железа в сторону недостатка железа понятна, если учесть химическую аналогию кислорода и серы. Для оксида железа (2+) впервые установлен факт повышения температуры плавления с нарушением стехиометрического состава. Так, для
Fe0,93O (х = 0,07) т. пл. 1378° С. Fe0,91O (х = 0,09) и Fe0,89O (х = 0,11) пла-
вятся соответственно при 1382 и 1387 С. Для координационных решеток температура плавления характеризует прочность соединения. Таким образом, до определенного предела устойчивость оксида железа растет вместе со степенью нарушения стехиометрического состава. Кроме того, оксид железа (2+) как соединение эквиатомарное (1 атом Fе на 1 атом О) просто не существует, так как область нестехиометрии на самом деле не включает стехиометрический состав.
Однако соединения переменного состава не обязательно должны иметь очень широкие области гомогенности, как это было в приведенных примерах. Ширина области гомогенности прежде всего зависит от физи- ко-химической природы самого соединения. Примером двусторонней фазы с довольно узкой областью гомогенности может служить сульфид
свинца PbS0,9995-1,0005. Еще меньшую область гомогенности имеет сульфид кадмия CdS, представляющий собой одностороннюю фазу с недостатком
атомов серы против стехиометрического состава.
5.4. Синергетические аспекты в химии и химической технологии
«Мы плывем вверх по течению, борясь с огромным потоком дезорганизованности, который, в соответствии со вторым законом термодинамики, стремится свести к тепловой смерти – всеобщему равновесию и одинаковости. В этом мире наша первая обязанность состоит в том, чтобы устраивать произвольные островки порядка и системы»
Н. Винер
Среди великих научных достижений XIX века два достижения удив-
236
ляют своей противоположной направленностью. Эта эволюционная теория Ч. Дарвина и феноменологическая термодинамика. Первая обосновала развитие живой материи от низших форм к высшим, т.е. усложнение организации в процессе эволюции. Вторая предсказала дезорганизацию, или разрушение, изначально заданной структуры в изолированной системе при эволюции к равновесию. Таким образом, эволюционная идея в XIX в. возникла в двух прямо противоположных формах – в виде теории создания структур Ч. Дарвина и теории разрушения структур: последней, в сущности, является классическая термодинамика. Обе эти теории подтверждены огромным числом экспериментальных фактов, однако прямой связи между нет.
Вместе с тем они отражают единую физическую реальность, но только соответствуют различным её проявлениям. Возникает проблема, как дополнить классическую термодинамику отсутствующей в ней теорией создания структур. Эта проблема принадлежит к числу фундаментальных проблем естествознания.
В течение последних 20 лет физики, химики и биологи сумели приблизиться к пониманию процессов формирования структур в открытых системах, т.е. в системах, обменивающихся веществом и энергией с окружающей средой. Ответ на вопрос о причинах и общих закономерностях самоорганизации содержится, как теперь стало ясно, в термодинамике необратимых процессов, или, как часто её называют, неравновесной термодинамикой (неудачное название).
Таким образом, в середине XIX века почти одновременно были сформулированы второе положение термодинамики и законы биологической эволюции. Однако вопрос о совместности концепции тепловой смерти (процесса хаотизации) с непрекращающимся процессом структурообразования оставался на протяжении целого столетия открытым. И огромной заслугой явилось установление того факта, что самоорганизация присуща не только живым системам.
Оказывается, способность к самоорганизации является общим свойством открытых систем. При этом брюссельской школой возглавляемой лауреатом Нобелевской премии И.Р. Пригожиным, было показано, что именно неравновесность в открытых системах служит источником упорядоченности.
Что же изучает классическая термодинамика и термодинамика необратимых (неравновесных) процессов?
Классическая термодинамика – это область естествознания, которая занимается изучением общих свойств макроскопических систем в состоянии равновесия, а также общих закономерностей, имеющих место при ус-
237
тановлении термодинамического равновесия. Под состоянием термодинамического равновесия подразумевается состояние, в которое с течением времени приходит система, находящаяся при неизменных внешних условиях и постоянной температуре окружающей среды.
Задача термодинамики необратимых процессов – количественное изучение неравновесных процессов для состояний, близко или далеко удаленных от равновесия, в которых это удаление удерживается благодаря обмену массой и энергией системы с окружающей средой. Классическая термодинамика сформировалась во второй половине XIX века. В её становлении выдающуюся роль сыграли работы Н. Карно, Б. Клапейрона, Р. Майера, У. Томпсона, Р. Клаузиуса, Д. Гиббса и др.
Термодинамика неравновесных процессов (ТНП) сформировалась в законченную область естествознания в 50-х годах XX столетия. Колоссальный шаг в развитии термодинамики неравновесных процессов был сделан в 1931 г. Л. Онзагером, который сформулировал принцип симметрии кинетических коэффициентов в термодинамических потоках и в 1968г. был удостоен Нобелевской премии по химии [24, 33].
Однако особенно бурное развитие термодинамики необратимых процессов началось вскоре после второй мировой войны в значительной мере благодаря работам голландско-бельгийской школы (И. Пригожин, С. Де Грот, П.Мазур И.Стенгерс и их сотр.). За разработку теории диссипативных структур Пригожину была присуждена в 1977 г. Нобелевская премия.
Диссипативные структуры образуются в открытых системах, когда в ходе непрерывного процесса из пространственно-однородного состояния самопроизвольно самоорганизуется пространственная или временная структура. Самоорганизация в системе связана с формированием структуры более сложной, чем первоначальная. Такой переход сопровождается понижением симметрии.
Величайшей заслугой ТНП является осознание того факта, что неравновесность может быть причиной порядка. Таким образом, удалось связать два таких понятия, как самоорганизация и хаос, или порядок и беспорядок. Оказалось, что необратимые (неравновесные) процессы в открытых системах могут приводить к возникновению нового типа динамических состояний материи – диссипативным самоорганизующимся структурам.
Синергетика как наука для описания неравновесных процессов пользуется аппаратами нелинейной динамики и ТНП, что позволяет успешно изучать динамику и механизм этих процессов. Большинство процессов являются фактически неравновесными с кооперативными (синергетическими), диссипативными и нелинейными эффектами. Примерами таких
238
процессов могут служить химические осцилляторы (иначе – колебательные реакции Белоусова – Жаботинского, Бриггса – Раушера, Брея – Либавского и др.), а также реакции в проточных реакторах с рециклами или концентрационные колебания в процессах с фазовыми превращениями. Колебательные явления могут возникать не только вследствие физических и химических особенностей процессов, но и из-за гидродинамики, в частности конвекции, как, например, в реакторах со взвешенным слоем, где наблюдаются колебания скорости движения частиц.
Врассматриваемых неравновесных системах очень часто из хаотических состояний возникают высокоупорядоченные пространственновременные структуры (в частности, концентрационные колебания). Большое число таких систем проявляет поразительное сходство в поведении при переходе от неупорядоченного состояния к упорядоченному, что позволяет различные физико-химические процессы описать универсальными математическим соотношениями.
Химические реакции дают много примеров образования пространственных, временных и пространственно-временных структур. Одной из первых исследованных и наиболее впечатляющих реакций этого типа является реакция Белоусова – Жаботинского [32]. Более подробна эта реакция рассмотрена в разделе 6.12.
Втермостатированной колбе исследуются окислительно-восстанови-
тельные реакции: Ce 3+ => Ce 4+ Ce 4+=> Ce 3+
BrO–3 + 4 Ce 3+ + CH2(COOH)2 + H20=> BrCH(COOH)2 + 4 Ce4+ + 3H20
бромат-ион церий(III) в растворе серной кислоты H2SO4, малоновой кислоты CH(COOH)2, сульфата церия Ce2(SO4)3 и бромата калия KBrO3.
При добавлении в раствор индикатора окислительно-восстанови- тельной реакции (ферроина) можно следить за ходом реакции по изменению цвета или более точно – по спектральному поглощению. При достаточно высокой концентрации веществ, участвующих в реакции, наблюдаются весьма необычные явления. Цвет раствора периодически (при определенных концентрациях) меняется от красного (избыток Ce4+) до синего (избыток Ce3+). Кривая изменения поглощения света показывает, что наблюдаются типичные колебания.
Колебательные явления чрезвычайно широко распространены как в живой, так и в неживой природе. Интерес к химическим колебаниям определяется прежде всего надеждой понять механизм ряда периодических биологических процессов. Колебательная реакция была открыта Б.П. Белоусовым в 1951 г. Любопытно отметить, что первое сообщение Белоусо-
239
ва об этой реакции, посланное в 1951 г. в один из химических журналов, было отвергнуто. В отзыве говорилось, что публиковать работу не следует, потому что описанная в ней реакция невозможна. Такая же участь постигла и второе сообщение, направленное в печать в 1955 г. Лишь в 1958 г. по настоянию С.Э. Шноля Белоусов сумел опубликовать маленький реферат своей работы в «Рефератах по радиационной медицине» за 1958 г., издаваемых Институтом биофизики Министерства здравоохранения
СССР. С 1964 г., когда этой реакцией стал заниматься А.М. Жоботинский (аспирант С.Э. Шноля), изучение реакций подобного типа набирает темп. В 1980 г. Б.П. Белоусову (посмертно), В.И. Кринскому, А.М. Жоботинскому, А.Н. Заикину и др. за цикл работ по исследованию этих реакций была присуждена Ленинская премия.
Методы синергетики в химии и химической технологии позволяют изучить явления самоорганизации в химических системах и отвечают на вопросы: как происходит эволюция в физико-химических системах, каковы её движущие силы и критерии, какова природа самоорганизации эволюционирующих химических систем.
Развитие и применение синергетики в химии и химической технологии стали возможными благодаря химической кибернетики, воспринимающей, хранящей и перерабатывающей информацию для оптимального управления химико-технологическими объектами. В России химическая кибернетика сформировалась к 60-м годам XX столетия. Большую роль в становлении химической кибернетики сыграли работы академика В.В. Кафарова.
Для того, чтобы область знаний сформировалась как наука, необходимо найти ответ, по крайней мере, на четыре вопроса: что является объектом её изучения, каков метод исследования, каковы средства и цели исследования. В химической кибернетике объектом изучения являются хи- мико-технологические процессы; методом – метод математического моделирования, позволяющий описывать явления, протекающие в химикотехнологических процессах, в виде математических моделей; средством изучения является вычислительная техника; целью исследования – организация оптимального управления химико-технологическим процессом.
Средства исследования, как в химической кибернетике, так и в синергетике (в химии и химической технологии) одни и те же. Объект исследования в синергетике более узок: изучаются неравновесные (находящиеся вдали от равновесия) химико-технологические процессы, описываемые нелинейными математическим моделями. В качестве методов исследования рассматриваются метод математического моделирования, позволяющий построить нелинейные модели изучаемых объектов, увидеть сцена-
240
