
- •Министерство образования и науки российской федерации
- •Рецензент:
- •6. Теоретические основы современных методов контроля качества продовольственных товаров
- •6.1. Оптические методы
- •6.1.1. Электромагнитное излучение
- •6.1.2. Происхождение атомных спектров
- •6.1.3. Классификация оптических методов анализа
- •Вопросы для самоконтроля
- •6.2. Поглощение излучения
- •6.2.1. Ультрафиолетовая и видимая области
- •6.2.2. Цвет раствора
- •6.2.3. Фотометрические методы анализа
- •6.2.4. Спектрофотометрия
- •Характеристические полосы поглощения некоторых хромофоров
- •6.2.5. Инфракрасная спектроскопия
- •Вопросы для самоконтроля
- •6.3. Молекулярная люминесценция: флуориметрия, фосфорометрия
- •Вопросы для самоконтроля
- •6.4. Спектры комбинационного рассеяния (Рамановская спектроскопия)
- •Вопросы для самоконтроля
- •6.5. Атомная спектроскопия
- •Конус зона
- •Вопросы для самоконтроля
- •6.6. Фотоакустическая спектроскопия
- •Вопросы для самоконтроля
- •6.7. Рентгено-спектральный анализ
- •Вопросы для самоконтроля
- •6.8. Электронная и ионная спектроскопия
- •Вопросы для самоконтроля
- •6.9. Спектроскопия магнитного резонанса (Радиочастотные спектральные методы)
- •Вопросы для самоконтроля
- •6.10. Масс-спектрометрия
- •Вопросы для самоконтроля
- •6.11. Ядерно-физические методы анализа
- •6.11.2. Величины и единицы измерения радиоактивности
- •6.11.3. Α-распад
- •6.11.4. Β-превращения
- •6.11.5. Γ-излучение
- •6.11.6. Детекторы радиоактивности
- •Вопросы для самоконтроля
- •6.12. Термические свойства потребительских товаров
- •6.12.1. Термические методы анализа
- •6.12.2. Термометрия
- •6.12.3. Термотитрометрия
- •6.12.4. Термогравиметрический анализ (тга)
- •6.12.5. Дифференциальный термический анализ (дта)
- •6.12.6. Дифференциальная термогравиметрия (тгп)
- •6.12.7. Дифференциальная сканирующая калориметрия (дск)
- •Вопросы для самоконтроля
- •6.13. Цвет и свет
- •6.13.1 Основные колориметрические и фотометрические величины
- •6.13.2 Основы измерения цвета
- •Вопросы для самоконтроля
- •6.14. Микроскопия
- •Примерные диапазоны применения различных методов исследования растительных объектов
- •Вопросы для самоконтроля
- •6.15. Хроматографические методы разделения и идентификации веществ
- •Важнейшие виды хроматографии
- •Вопросы для самоконтроля
- •7. Статистическая обработка результатов измерения
- •Оценка правильности результатов измерений(определений)
- •Оформление контрольной работы
- •Контрольная работа
- •Тематика рефератов (по указанию преподавателя)
- •Рекомендованная литература
6.12.3. Термотитрометрия
Поскольку практически все химические реакции сопровождаются тепловым эффектом, за ходом реакции можно проследить, наблюдая за выделением или поглощением тепла при титровании в маленьком адиабатическом калориметре. Изменение температуры можно контролировать термопарой или термистором. При титровании между определяемым веществом и титрантом происходит химическая реакция, сопровождающаяся поглощением или выделением теплоты. В момент эквивалентности реакции температурные изменения в системе заканчиваются. Следовательно, поместив в титруемую смесь чувствительный датчик температуры, можно зафиксировать момент эквивалентности по прекращению изменений температуры смеси.
Кривые термометрического титрования регистрируют с помощью самописца в координатах «температура смеси» - «объем титранта» или «время титрования при постоянной скорости подачи титранта». В момент эквивалентности на кривой титрования наблюдается характерный перегиб, соответствующий прекращению изменений температуры смеси.
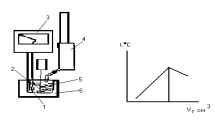
а) б)
Рис. 28. Схема установки для термометрического титрования (а) и вид кривой титрования (б): 1- термопара; 2- мешалка; 3- самописец; 4- блок автоматического титрирования; 5- титрируемый раствор; 6- термозащитный кожух
Недостатками метода являются его сравнительно невысокая точность, связанная с потерями теплоты в окружающую среду, и низкая избирательность.
6.12.4. Термогравиметрический анализ (тга)
Этот метод основан на наблюдении за изменением массы пробы в течение некоторого периода времени при линейном повышении температуры, сопровождающемся ее высушиванием, разложением. Эти процессы идут в несколько стадий. Например, при высушивании сначала удаляется свободная, а затем более прочно связанная кристаллизационная влага. При дальнейшем нагревании проходят процессы пиролиза вещества, которые также могут быть многостадийными. Каждый из указанных процессов проходит при достижении для данного вещества одной постоянной температуры и сопровождается потерей массы. Поэтому на графике зависимости массы образца от температуры нагревания при некоторых температурах регистрируются изменения массы, соответствующие определенным стадиям термических превращений вещества. Например, термические превращения СuSO45Н2O состоят из следующих стадий.
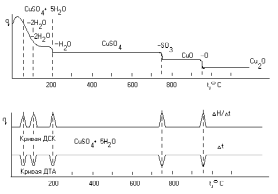
Рис. 29. Термогравиграмма (а) и кривые ДСК и ДТА (б) сульфата меди (II):
стадия - удаление двух молекул воды (при t = 60 - 80°С)
стадия - удаление двух молекул воды (при t = 105 - 115°С)
стадия - удаление одной молекулы воды (при t = 220 - 240°С)
стадия - разложение до СuО (при t = 700 - 750°С)
стадия - разложение до Сu20 (при t = 900 - 950°С).
Таким образом, термограмма показывает, что кристаллизационная вода связывается в сульфате меди по крайней мере тремя видами связи, отличающимися своей прочностью. При этом изменения массы образца эквивалентны содержанию в нем разных форм воды и продуктов разложения. Термогравиметрический анализ проводят на специальных термовесах, включающих следующие устройства: 4 - печь для нагрева образца 3, регулирования температуры и давления, регистрирующие весы 9; датчики температуры 2 и массы 10, самописец 1 для записи показаний термовесов. Термогравиметрический анализ является точным и чувствительным методом для определения составных частей веществ и примесей в них. Термические характеристики примесей отличаются от термических характеристик вещества и на термограмме появляются соответствующие изменения, качественно и количественно связанные со свойствами примесей.
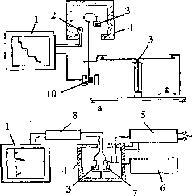
Рис. 30. Схемы установок для термического анализа
