
- •Министерство образования и науки российской федерации
- •Рецензент:
- •6. Теоретические основы современных методов контроля качества продовольственных товаров
- •6.1. Оптические методы
- •6.1.1. Электромагнитное излучение
- •6.1.2. Происхождение атомных спектров
- •6.1.3. Классификация оптических методов анализа
- •Вопросы для самоконтроля
- •6.2. Поглощение излучения
- •6.2.1. Ультрафиолетовая и видимая области
- •6.2.2. Цвет раствора
- •6.2.3. Фотометрические методы анализа
- •6.2.4. Спектрофотометрия
- •Характеристические полосы поглощения некоторых хромофоров
- •6.2.5. Инфракрасная спектроскопия
- •Вопросы для самоконтроля
- •6.3. Молекулярная люминесценция: флуориметрия, фосфорометрия
- •Вопросы для самоконтроля
- •6.4. Спектры комбинационного рассеяния (Рамановская спектроскопия)
- •Вопросы для самоконтроля
- •6.5. Атомная спектроскопия
- •Конус зона
- •Вопросы для самоконтроля
- •6.6. Фотоакустическая спектроскопия
- •Вопросы для самоконтроля
- •6.7. Рентгено-спектральный анализ
- •Вопросы для самоконтроля
- •6.8. Электронная и ионная спектроскопия
- •Вопросы для самоконтроля
- •6.9. Спектроскопия магнитного резонанса (Радиочастотные спектральные методы)
- •Вопросы для самоконтроля
- •6.10. Масс-спектрометрия
- •Вопросы для самоконтроля
- •6.11. Ядерно-физические методы анализа
- •6.11.2. Величины и единицы измерения радиоактивности
- •6.11.3. Α-распад
- •6.11.4. Β-превращения
- •6.11.5. Γ-излучение
- •6.11.6. Детекторы радиоактивности
- •Вопросы для самоконтроля
- •6.12. Термические свойства потребительских товаров
- •6.12.1. Термические методы анализа
- •6.12.2. Термометрия
- •6.12.3. Термотитрометрия
- •6.12.4. Термогравиметрический анализ (тга)
- •6.12.5. Дифференциальный термический анализ (дта)
- •6.12.6. Дифференциальная термогравиметрия (тгп)
- •6.12.7. Дифференциальная сканирующая калориметрия (дск)
- •Вопросы для самоконтроля
- •6.13. Цвет и свет
- •6.13.1 Основные колориметрические и фотометрические величины
- •6.13.2 Основы измерения цвета
- •Вопросы для самоконтроля
- •6.14. Микроскопия
- •Примерные диапазоны применения различных методов исследования растительных объектов
- •Вопросы для самоконтроля
- •6.15. Хроматографические методы разделения и идентификации веществ
- •Важнейшие виды хроматографии
- •Вопросы для самоконтроля
- •7. Статистическая обработка результатов измерения
- •Оценка правильности результатов измерений(определений)
- •Оформление контрольной работы
- •Контрольная работа
- •Тематика рефератов (по указанию преподавателя)
- •Рекомендованная литература
6.12.1. Термические методы анализа
Термические методы анализа основаны на измерении температур фазовых переходов и теплот химических реакций. Развитие получили следующие виды термического анализа:
термометрия (термоанализ) - измерение температуры фазовых переходов
- плавление, кипение, затвердевание веществ и их смесей;
термогравиметрия - измерение массы веществ, подвергаемых нагреванию;
калориметрия (энтальпометрия) - измерение теплоты химических реакций;
термометрическое титрование - титрование, в котором точка эквивалентности определяется по изменению температуры титруемой смеси.
По способу отсчета различают следующие виды термометрического анализа - прямые, в которых определяют значение температуры или количество теплоты, и дифференциальные, основанные на измерении разности температур.
Термометрические методы основаны на положениях и законах термодинамики. При протекании любой химической реакции изменяются свободная энергия системы Е°; ее изменения Е° связаны с константой равновесия К химической реакции, а также с изменениями энтальпии & Н°, энтропии 8° и температурой Т соотношениями:
E° = -RTlnK, (6.12.1)
Е° = ΔН°-ТΔS0. (6.12.2)
Изменения энтальпии регистрируют либо по тепловому эффекту реакции Q, либо по изменениям температуры системы Т, поскольку обе эти величины зависят от энтальпии:
Q = -n ΔH, (6.12.3)
Q = cΔT (6.12.4)
Т = ΔН°n/с, (6.12.5)
где n - число молей продукта реакций,
с - теплоемкость системы.
В уравнения 6.12.3 и 6.12.5 входит концентрация продукта реакции (число молей), что позволяет применять термометрические методы для аналитических определений.
Термометрические методы универсальны, поскольку любая химическая реакция сопровождается изменениями энергии в системе, обладает высокой чувствительностью, позволяет надежно устанавливать присутствие примесей, определять чистоту веществ, проводить идентификацию веществ по температурным константам и их изменениям, исследовать процессы нагревания, сушки, плавления, кристаллизации.
6.12.2. Термометрия
При нагреве или охлаждении вещества его температура непрерывно меняется, но в момент фазового перехода в некотором интервале наступает постоянство температуры, связанное с поглощением или выделением теплоты при изменении фазового состояния. Постоянная температура, сопровождающая плавление, затвердевание или кипение вещества, остается стабильной до завершения фазового перехода и только после этого перехода начинает изменяться дальше. Температуры фазовых переходов являются константами веществ и используются для определения их идентичности (по плавлению смешанных проб), для проведения физико-химического анализа и определения молекулярных масс веществ по изменению температуры фазового перехода системы.
t,˚C
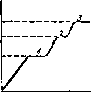
t,c
Рис. 27. Измерения температуры в момент фазового перехода: 1 - испарение кристализационной воды; 2- плавление примеси; 3- плавление вещества.
Константы фазовых переходов являются важнейшими физико-химическими и идентификационными характеристиками веществ. Обычно определяют следующие константы: температуру плавления, температуру затвердевания, температуру кипения. При измерениях используют шкалу Цельсия, в которой за нулевую точку принята температура плавления льда, а за 100°С - температура кипения воды. Системой СИ рекомендуется к использованию термодинамическая шкала в Кельвинах К, где за нулевую отметку принимают температуру абсолютного нуля - 0°К или - -273.16°С. Температура плавления льда в этой шкале соответствует - +273.16°К.
