- •3 Вопрос
- •4. Объемные отношения при взаимодействии газообразных веществ. З-н Гей-Люссака
- •1. Атом, молекула, эквив-т. Молярный объем. Число Авогадро
- •6. Многоэлектронные атомы. Порядок заполнения электронных оболочек атомов.
- •8. Энергия ионизации и сродство к электрону. Электроотрицательность элементов.
- •9) Типы связей между атомами.
- •Вопрос 12
- •2 . II начало термодинамики. Энтропия и термодинамическая вероятность
- •6) Давление насыщ-го пара над раствором
- •17. Теория электролитич-й диссоц-и
- •24 Вопрос.
- •25. Окислители и восстановители
- •Вопрос 27
- •28. Комплексные соед-я
- •Вопрос 29
- •33) Металлы подгруппы цинка
- •Вопрос41
- •42. Углерод, химические свойства. Оксиды углерода, свойства. Соли угольной кислоты. Соединения углерода с металлами и неметаллами
- •43 Вопрос. Кремний
- •40. Сера
- •Вопрос 43 вода
- •52. Галогены.
- •7 Билет.
- •Вопрос 10.
- •Вопрос 11
- •Вопрос 13
- •19 Вопрос: сильн.Электролиты,кажущаяся степень диссоциации сильн.Электролитов, понятие об активности и степени активности.
- •Вопрос 14
- •Вопрос 15
- •Вопрос 21: гетерогенные равновесия, произведение растворимости (пр),растворимость.
- •26 Вопрос
- •30 Вопрос
- •31 Вопрос
- •32 Вопрос
- •34 Вопрос: углерод, хим.Св-ва; оксиды углерода,св-ва;соли угольн.К-ты;соединения углеррода с металлами и неметаллами.
- •35)Германий,олово,свинец.Оксиды и гидрооксиды,их взаимодейств. С к-тами и щелочами
- •37 Вопрос. Аммиак..
- •38 Вопрос. Кислородн.Соединения азота.Хим.Разложение нитрата и нитрита аммония. Окислит.Св-ва азотн.К-ты и зависимость продуктов ее восстановления от концентрации и природы восстановителя.
- •39 Вопрос: фосфор
- •42Водород
- •4 Вопрос
- •5 Вопрос
6) Давление насыщ-го пара над раствором
В рез-те естеств- процессов при стоянии р-ра в нем протекают 2 противоположных процесса – испарение и конденсация. Состояние равновесия между этими процессами характеризуется давлением насыщенного пара над р-ром. При этом экспериментально доказано, что давление насыщенного пара над раствором меньше чем над чистым растворителем.
З-н Рауля: парциальное давление над р-ром прямо пропорц. мольной доле растворенного в-ва.
ЭБУЛИОСКОПИЯ, физ.-хим. метод исследования жидких р-ров нелетучих в-в, основанный на измерении повышения т-ры кипения р-ра по сравнению с т-рой кипения чистого р-рителя.
Эбулиоскопию используют для определения мол. массы растворенного в-ва, степени диссоциации слабых электролитов.
КРИОСКОПИЯ физ.-хим. метод исследования жидких р-ров нелетучих в-в, основанный на понижении т-ры замерзания р-ра по сравнению с т-рой замерзания чистого р-рителя.. Криоскопию используют для определения мол. массы растворенного в-ва, степени диссоциации слабых электролитов, термодинамич. активности р-рителя и растворенного в-ва, исследования комплексообразования в р-рах, определения констант равновесия р-ций, чистоты орг. в-в.
17. Теория электролитич-й диссоц-и
Электролиты - в-ва,водн. растворы и расплавы кот. проводят электрич. ток. Их электропроводность зависит от концентрации.Исследуя р-ры электролитов,Аррениус показал,что электролиты в р-рах распадаются на ионы.
Электролитич. диссоциация-это распад электролита на ионы под действием м-л растворителя.
Опыт показыв.,что не все электролиты полностью диссоциируют на ионы,часть м-л остается недиссоциируемой.Между ионами и непродиссоциировавшими -лами в р-ре устанавливается динамич. равновесие.С колличественной стороны процесс диссоциации хар-ся степенью диссоциации а(альфа) и К(константой степени диссоциации).Альфа показывает отношение числа продиссоциировавших м-л к общ. числу растворенных м-л.
Основания. Название "основание" первоначально было отнесено к вещ-вам, кот. в реакциях с кис-тами образуют соли. К основаниям принадлежат гидроксиды многих металлов. Прим: NaOH - гидроксид натрия, KOH - гидроксид калия, Ca(OH)2 - гидроксид кальция. Основания, кот.хорошо растворяются в воде, назыв. щелочами. К ним относятся гидроксиды щелочных и щелочно-земельных металлов. С точки зрения ТЭД основания-это вещ-ва, диссоциирующие в водном р-ре с образованием анионов одного вида - гидроксид - ионов ОН-. В общем виде уравнение электролитич. диссоциации основания имеет вид: Основание -> Катион основания + Гидроксид-ион
|
NaOH |
Кислоты.Кис-ты исторически получили своё название из-за кислого вкуса водн. р-ров таких вещ-в, как хлороводород или уксусная кислота. С точки зрения ТЭД кислоты-это вещ-ва, диссоц. в водн. р-ре с образованием катионов одного вида - катионов водорода Н+. В общ. виде ур-ние электролитич. диссоциации кислоты имеет вид: Кислота -> Катион водорода + Анион кислотного остатка
|
H2SO4 |
Соли. С точки зрения ТЭД соли - это вещ-ва, кот. в водном р-ре диссоциируют с образованием катионов основания и анионов кислотного остатка. В общ. виде ур-ние электролитич. диссоциации солей имеет следующий вид: Соль -> Катион основания + Анион кислотного остатка
|
BaCl2 18. Слабые электролиты Слабые электролиты-со степенью диссоциации <3.К ним относятся слаб. кис-ты (H2CO3,HCN,HSCN,CH3COOH),слаб. основания и некоторые соли.Cлаб. электролиты диссоциируют незначительно, и между ионами и непродиссоциировавшими м-лами устанавливается динамич. равновесие.Можно применить ЗДМ и написать константу равновесия,кот назыв. константой диссоциации.Слаб. многоосновн. кис-ты диссоциируют ступенчато и каждая ступень характеризуетя своей Кд.
I ступень: H2SO4 ↔ H+ + HSO4¯ II ступень: HSO4¯ ↔ H+ + SO42– Слабые основания:гидроксиды d-элементов,амфотерные гидроксиды, NH4OH,Mg(OH)2,CU(OH)2,Cr(OH)3. Слабые электролиты диссоциируют ступенчато.Для каждой ступени своя Кд.
Влияние одноименного иона на диссоциацию слабого электролита: Одноименными называются ионы,кот входят в состав данного элемента
Если к р-ру слаб. эл-та уксусной кислоты прибавить ее соль ацетат натрия,то при этом вводится одноименный ион CH3COO
При введении одноименных ионов в -р слаб. эл-та его диссоциация уменьшается. Вопрос 20 Ионное произведение воды. KВ=[Н⁺][ОН⁻]= 10⁻14 при 25ᵒС Это произведение концентрации ионов водорода и гидроксильных групп. Величина постоянная const=10⁻14 при 25ᵒС Т.к. КВ(константа воды)≠0, то в любом водном р-ре есть ионы [Н⁺]≠0, [ОН⁻]≠0. В кислой среде: [H⁺]>[OH⁻] , [H⁺]>10⁻⁷ моль-ионов/литр В нейтральной среде: [H⁺]=[OH⁻] =√10⁻⁴=10⁻⁷ м-и/л В щелочной среде: [H⁺]<[OH⁻] [H⁺]<10⁻⁷ Водородный показатель. pH= -lg[H⁺], [H⁺]=10⁻ ᵖᴴ . В.п – это отрицательный десятичный логарифм концентрации ионов водорода. Гидроксильный показатель. pОH= -lg[ОH⁻] [ОH⁻]= 10⁻ᵖᴼᴴ. Для сильных электролитов более правильно писать pH=-lg aᴴ⁺ Активность аᴴ⁺=fᴴ⁺•Cᴴ⁺ f – коэффициент активности, учитывает все силы взаимодействия между ионом в растворе .чем сильнее взаимодействие, тем меньше коэффициент активности f<1. Вопрос №22г Амфотерные оксиды – это оксиды, которым соответствуют амфотерные гидроксиды. Амфотерные оксиды – оксиды металлов в с. о. атомов +3, +4, а также BeO, ZnO, PbO, SnO и некоторые другие. Амфотерные оксиды могут проявлять и кислотные, и основные свойства в зависимости от веществ, с которыми они взаимодействуют. С кислотами и кислотными оксидами амфотерн. оксиды проявл.св-ва основн.оксидов, а с основаниями и основными оксидами – cв-ва кислотн.оксидов. Однако не у всех амфотерных оксидов кислотн. и основные св-ва выражены в одинаковой мере. Например, у оксида мышьяка(III) кислотные свойства преобладают над основными, а у оксида сурьмы(III) основные свойства преобладают над кислотными.
Амфотерные оксиды с водой не взаимодействуют, например:
Амфотерные оксиды при взаимодействии с кис-тами проявл. св-ва основн. оксидов, образуя соль и воду, например:
При избытке многоосновной кис-ты образуется кислая соль, например:
При избытке оксида образуется основная соль, например: ZnO (изб.) + HCl = ZnOHCl. Двойные оксиды образуют две соли, например:
Например:
Амфотерн. оксиды при взаимодействии со щелочами проявл.св-ва кислотн. оксидов. Состав продуктов реакции зависит от условий реакции. При сплавлении образуется средняя соль и вода, в р-ре – комплексная соль, например: ZnO
+ 2NaOH (тв.)
ZnO
+ 2NaOH + Оксид
алюминия при взаимодействии со щелочью
в зависимости от ее концентрации
образует одну из двух комплексных
солей – с четырьмя и шестью
ОН-группами(Na Оксиды
Например:
Гидратные формы амфотерных оксидов получают косвенно, например, из солей: H2SiO3 → SiO2 + H2O 23 вопрос Гидролиз солей. Гидролиз солей – это взаимодействие ионов соли с водой с образованием малодиссоциирующих частиц. Сущность гидролиза сост. в ом,что в рез-те обменна ионов соли с мол-лами воды происх смещение равновесия электролитич.диссоциации воды,и в рез-те накаплив.избыток тонов Н или ОН. Согласно ТЭД все соли,как правило,сильн.электролиты,т.е.в водн.р-ре полностью диссоц.на ионы. «Все ионы в р-ре окружены м-лами воды,кот.образуют гидратную оболочку»(по теории Каблукова). Со своей гидратной оболочкой ионы взаимодействуют по-разному: анионы слаб.кис-т связаны с волой Н-связью.Если это анионы слаб.к-ты,то они могут «оторвать» и присоед. к себе ион Н. При этом образуется слаб.к-та или кисл.анион. Анионы сильн.к-т с водой не взаимодействуют. Катионы связаны с м-лами воды донорно-акцепторной связью. Такое взаимодействие тем сильнее, чем больше заряд катиона и чем меньше его размер. Катионы, образующ.слаб.основания,будут взаимодействовать с мол-лами воды,притягивая к себе ОН. При этом образ. слаб.основаниеили гидроксокатион.Катионы сильн.оснований с водой не взаимодейств.,т.к. сильн.основания полностью диссоциированы в р-ре. Степень гидролиза – отношение кол-ва соли,подвергшиеся гидролизу общему кол-ву соли в р-ре. (h) При разбавлении р-ров солей и нагревании гидролиз усиливается. Степень гидролиза для солей,образован. слаб.к-той и сильн.основанием или сильной к-той и слаб.основанием невелика(~1%). Если в рез-те гидролиза накаплив. ионы Н,то чтобы подавить гидролиз, надо добавить к-ту, а чтобы усилить – основание. Если в резте гидролиза накаплив.ионы ОН, то чтобы подавить гидролиз надо добав. основание, чтобы усилить – к-ту. |

 CH3COONA
CH3COO+Na
CH3COONA
CH3COO+Na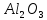 +
+
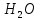 ≠
≠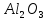 +
+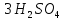 =
=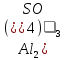 +
+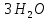
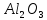 +
+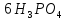 (изб.)=
(изб.)=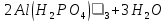
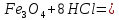 Fe
Fe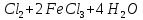
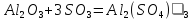
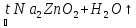
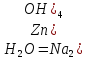
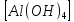 и N
и N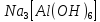 )
) взаимодействуют
со щелочами только при сплавлении.С
нерастворимыми основаниями амфотерные
оксиды не взаимодействуют.
взаимодействуют
со щелочами только при сплавлении.С
нерастворимыми основаниями амфотерные
оксиды не взаимодействуют.