
- •Глава 13
- •13.1. Классификация, номенклатура и Строение спиртов
- •13.1.1. Классификация спиртов
- •13.1.2. Номенклатура спиртов
- •13.1.3. Строение спиртов
- •13.1.4. Изомерия
- •13.2. Физические свойства спиртов
- •13.2.1. Спектроскопия спиртов
- •13.3. Получение одноатомных спиртов в промышленности
- •13.4. Методы синтеза одноатомных спиртов в лаборатории
- •13.5. Химические свойства одноатомных спиртов
- •13.5.1. Разрыв связи с–он
- •13.5.2. Разрыв связи о–н
- •13.6. Отдельные представители одноатомных спиртов
- •13.7. Непредельные спирты и их эфиры
- •13.7.1. Енолы
- •13.7.2. Получение производных енолов
- •13.7.3. Аллиловый спирт
- •13.7.4. Высшие непредельные спирты
- •13.7.5. Ацетиленовые спирты и простые эфиры
- •13.8. Гликоли
- •13.8.1. Физические свойства гликолей
- •13.8.2. Методы синтеза гликолей
- •13.8.3. Химические свойства гликолей
- •А) реакции окисления с сохранением углеродной цепи;
- •13.8.4. Применение гликолей
- •13.9. Многоатомные спирты
- •13.9.1. Получение глицерина
- •13.9.2. Химические свойства глицерина
- •13.9.3. Применение глицерина
- •13.9.4. Многоатомные спирты
- •13.9.5. Жиры и масла
13.5. Химические свойства одноатомных спиртов
Реакции спиртов можно разделить на два типа: протекающие с разрывом связи С–ОН и СО–Н, в силу того, что спирты проявляют кислотно-основные свойства.
13.5.1. Разрыв связи с–он
Замещение гидроксильной группы на галоген. Существует большое количество реакций замещения гидроксильной группы на галоген. Наиболее известные из них – взаимодействие спиртов с галогенводородными кислотами, а также галогенидами фосфора и серы. В зависимости от строения исходного спирта, реакция замещения может протекать по механизму SN1 или SN2.
Взаимодействие спиртов с галогеноводородами. Успех реакции, кроме условий проведения, определяется природой спирта и кислотностью галогеноводорода. Реакционная способность последних уменьшается в ряду HI > HBr > HCl >> HF, а в ряду спиртов скорость замещения ОН-группы резко снижается при переходе от третичного спирта к первичному. Так, третичный спирт реагирует с галогенводородными кислотами, за исключением фтороводорода, уже на холоду. Первичные и вторичные спирты превращаются в галогеналканы при нагревании со смесью галогеноводородной и серной кислот в течение нескольких часов.

Иногда галогеноводородные кислоты получают в реакционной смеси из их натриевых и калиевых солей действием концентрированной серной кислоты.
Следует отметить, что хлорид-ион является весьма слабым нуклеофилом из-за высокой сольватации его в водных средах. Для увеличения скорости реакции добавляют хлорид цинка, который облегчает замещение на хлорид-ион.

Так, т. е. по механизму SN2, реагируют метанол и большинство пространственно незатрудненных первичных спиртов. Протонирование спиртов превращает гидроксильную группу в хорошо уходящую группу.
![]()
В реакциях SN2 реакционная способность первичных спиртов R – CH2OH ниже, чем для самого метанола. Это связано с увеличением пространственных затруднений для атаки протонированного спирта галогенид-ионом.
Третичные и частично вторичные спирты реагируют по механизму SN1, когда протонированный спирт легко и быстро выбрасывает молекулу воды, образуя карбокатион. Его дальнейшая стабилизация определяется атакой более сильным нуклеофилом – галогенид-анионом, чем вода.

При этом следует учитывать, что образующийся из вторичных спиртов карбокатион способен за счет 1,2-гидридного или алкильного сдвига превращаться в третичный, например:
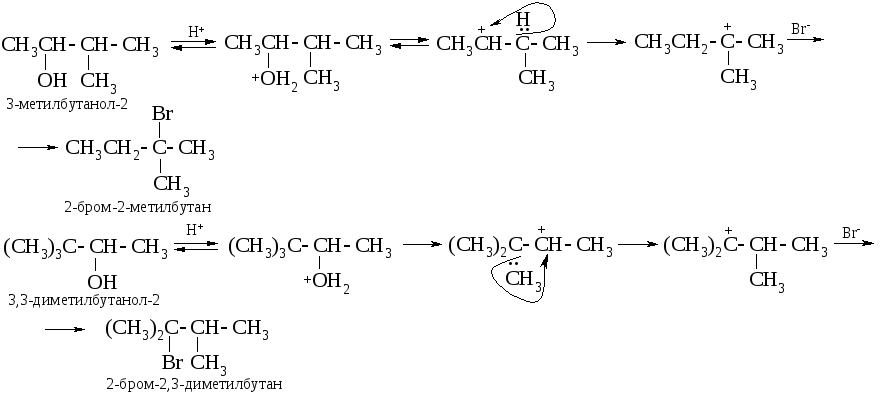
Последняя стадия осложняется побочной реакцией Е1 – отщеплением протона с образованием алкена.

Некоторые пространственно затрудненные первичные спирты могут реагировать по механизму SN1, например, неопентиловый спирт. Образующийся первичный карбкатион быстро перегруппировывается в третичный карбкатион за счет 1,2-метильного сдвига:

Вторичные спирты могут реагировать как по механизму SN1, так и SN2. Он определяется концентрацией спирта, кислоты, температурой проведения реакции и природой растворителя.
Проба Лукаса. Является ли спирт первичным, вторичным или третичным, можно установить с помощью пробы Лукаса, которая основана на различной реакционной способности трех классов спиртов по отношению к галогеноводородам. Третичные спирты реагируют с реактивом Лукаса (смесь концентрированной HCl с безводным ZnCl2) сразу же, о чем свидетельствует мгновенное помутнение реакционной смеси, вторичные – в течение 5 минут, а первичные спирты – при комнатной температуре заметно не реагируют. Третичные спирты легко образуют карбкатионы, вторичные – медленнее, а первичные не реагируют. Так как спирты растворимы в концентрированной соляной кислоте в присутствии хлорида цинка, а образованные из них галогениды – нет, то, соответственно, наблюдается помутнение. Исключением являются первичные аллиловый и бензиловый спирты, которые образуют устойчивые карбкатионы, и поэтому дают положительную реакцию.
Взаимодействие спиртов с галогенидами фосфора и серы. По сравнению с галогеноводородами более удобными реагентами для получения галогеналканов из спиртов является галогениды фосфора и серы, а также галогенангидриды некоторых неорганических кислот, например, SOCl2, PCl3, PCl5, POCl3, COCl2.
R-OH + PCl5 → R-Cl + POCl3 + HCl
3 R-OH + PBr3 → 3 R-Br + H3PO3
6 CH3OH + 2 P + 3 I2 → 6 CH3I + H3PO3 (P + 3 I2 → 2PI3)
Для реакций с тригалогенидами фосфора наиболее вероятен следующий механизм реакции. Первоначально образуется триалкилфосфит и, если процесс вести в присутствии оснований, это соединение может быть конечным продуктом реакции.
![]()
Если бромоводород не нейтрализовать, то промежуточное соединение триалкилфосфит легко протонизируется и алкильные группы превращаются в галогеналканы.
![]()
Реакции спиртов с пентагалогенидами фосфора обычно не сопровождаются перегруппировками и ведут к изменению конфигурации асимметрического атома углерода, связанного с гидроксильной группой.

В реакциях спиртов с тионилхлоридом сначала образуется хлорсульфитный эфир.
RОН + SOCl 2 → ROSOCl + HCl
Далее реакция может протекать по двум механизмам. В нуклеофильных растворителях, таких как диоксан, растворитель принимает участие в реакции и в конечном продукте сохраняется исходная конфигурация.

В том случае, когда растворитель не принимает участия в реакции, атака хлорид-аниона молекулы хлорсульфитного эфира протекает с тыла с обращением конфигурации продукта реакции.
![]()
Применение n-толуолсульфохлоридов в замещении гидроксигрупп. Известно, что спирты взаимодействуют с п-толуолсульфохлоридом (ТsCl) в присутствии пиридина с образованием алкил-п-толуолсульфонатов (тозилатов).

Поскольку п-толуолсульфат-ион является очень легко уходящей группой, то она может быть легко замещена без перегруппировок в реакциях с нуклеофилами, в том числе и с галогенид-ионами.
Дегидратация спиртов при помощи таких кислот как серная, фосфорная и щавелевая ведет к образованию алкенов.

Как уже упоминалось ранее, легче всего дегидратируются третичные спирты, потом вторичные и, наконец, первичные. Процесс дегидратации спиртов подчиняется правилу Зайцева, согласно которому атом водорода отщепляется от наименее гидрогенизированного атома углерода, что находится в -положении к ОH-группе, например:
 .
.
Дегидратация спиртов протекает в два этапа. Сначала происходит протонирование ОН-группы, а затем элиминирование молекулы воды по механизму Е2, если речь идет о первичных спиртах, или по Е1 – механизму, если спирты третичные. Вторичные спирты в зависимости от условий реакции могут дегидратироваться по Е2 или Е1 механизму.
Например, по механизму Е1 происходит дегидратация трет-бутилового спирта.

Третичные спирты дегидратируются настолько легко, что возможна избирательная дегидратация диола, содержащего первичную и третичную гидроксильные группы.

Дегидратацию третичных спиртов можно проводить уже в 20-50%-ной серной кислоте при 85-100 ºС. Вторичные спирты подвергаются дегидратации в более жестких условиях: 85%-ная фосфорная кислота, нагревание до 160 ºС или 60-70%-ная серная кислота при температуре 90-100 ºС.
![]()
Образование алкена определяется стабильностью промежуточного карбокатиона и термодинамической стабильностью разветвленного алкена. Например, для изоамилового спирта согласно правилу Зайцева должен образоваться только 3-метилбутен-1, а реально получается три алкена.

Образовавшийся сначала первичный карбокатион – наименее стабильный, поэтому он в результате 1,2-гидридного сдвига переходит в более стабильный вторичный карбокатион.

В свою очередь, вторичный карбкатион легко превращается в третичный как наиболее стабильный.

Больше всего в продуктах реакции будет 2-метилбутена-2 как наиболее разветвленного алкена.
Следует отметить, что изоамиловый спирт относится к первичным спиртам, тем не менее его дегидратация протекает по механизму Е1, что объясняется невозможностью реализации механизма Е2 из-за стерических затруднений.
Первичные спирты дегидратируются в концентрированной серной кислоте в интервале температур 170-190 С.
![]()
Для них реализуется механизм отщепления Е2. В реакцию вступает не сам спирт, а алкилсульфат, а роль нуклеофила играет гидросульфат-анион или вода.

Интересно отметить, что при проведении реакции при низкой температуре процесс можно остановить на стадии алкилсульфата.

Для дегидратации спиртов в промышленности вместо серной кислоты удобнее использовать в качестве дегидратирующего агента оксид алюминия. Гетерогенная каталитическая дегидратация осуществляется для первичных, вторичных и третичных спиртов.
Наряду с серной и фосфорной кислотами, оксидом алюминия для дегидратации спиртов также используют щавелевую кислоту, бензолсульфокислоту, хлорид цинка и оксид тория ТhО2. Примечательно, что при нагревании вторичных спиртов с оксидом тория(IV) получаются алкены с терминальной (концевой) двойной связью.
Наряду с образованием алкенов в зависимости от условий реакции (температура и концентрация кислоты) спирты могут превращаться в простые эфиры, о которых речь пойдет в соответствующей главе.
Синтез сложных эфиров сульфокислот. Спирты реагируют с сульфохлоридами с образованием с образованием сложных эфиров:

Наиболее часто применяют хлорангидриды толуолсульфокислоты, метансульфокислоты и трифторметансульфокислоты:
|
|
СH3SO2Cl |
CF3SO2Cl |
|
n-толуолсульфохлорид (тозилхлорид, ТsCl) |
метансульфохлорид (мезилхлорид) |
трифторметансульфорид (трифлилхлорид) |
Эфиры сульфокислот подходящие соединения для различных нуклеофильных реакций, т.к. сульфонатная группа легко, часто при комнатной температуре, подвергается замещению, особенно это относится к «трифлатам» R-O-SO2CF3.
![]()
Реакции протекают стереоспецифически с обращением конфигурации.

Синтез аминов из спиртов. Алкилирование аммиака или аминов спиртами проводят при нагревании реагентов в кислой среде.
![]()
В зависимости от соотношения реагентов могут быть получены первичные, вторичные и третичные амины, а также четвертичные аммониевые соли. Использование в качестве катализатора оксида алюминия при 300 ºС приводит к таким же результатам.
