
- •Глава 13
- •13.1. Классификация, номенклатура и Строение спиртов
- •13.1.1. Классификация спиртов
- •13.1.2. Номенклатура спиртов
- •13.1.3. Строение спиртов
- •13.1.4. Изомерия
- •13.2. Физические свойства спиртов
- •13.2.1. Спектроскопия спиртов
- •13.3. Получение одноатомных спиртов в промышленности
- •13.4. Методы синтеза одноатомных спиртов в лаборатории
- •13.5. Химические свойства одноатомных спиртов
- •13.5.1. Разрыв связи с–он
- •13.5.2. Разрыв связи о–н
- •13.6. Отдельные представители одноатомных спиртов
- •13.7. Непредельные спирты и их эфиры
- •13.7.1. Енолы
- •13.7.2. Получение производных енолов
- •13.7.3. Аллиловый спирт
- •13.7.4. Высшие непредельные спирты
- •13.7.5. Ацетиленовые спирты и простые эфиры
- •13.8. Гликоли
- •13.8.1. Физические свойства гликолей
- •13.8.2. Методы синтеза гликолей
- •13.8.3. Химические свойства гликолей
- •А) реакции окисления с сохранением углеродной цепи;
- •13.8.4. Применение гликолей
- •13.9. Многоатомные спирты
- •13.9.1. Получение глицерина
- •13.9.2. Химические свойства глицерина
- •13.9.3. Применение глицерина
- •13.9.4. Многоатомные спирты
- •13.9.5. Жиры и масла
13.8. Гликоли
До сих пор мы рассматривали только свойства одноатомных спиртов, хотя, конечно, обращалось внимание на то, как эти свойства изменяются в присутствии других заместителей.
Теперь перейдем к некоторым наиболее важным классам полифункциональных соединений. В веществах этих классов функциональные группы влияют на свойства друг друга до такой степени, что в результате возникают определенные свойства, не характерные ни для одной из этих групп, а лишь для данной комбинации. Первыми в этом ряду будут рассмотрены двухатомные спирты или гликоли.
Следует отметить, что присутствие двух гидроксильных групп у одного атома углерода невозможно, т. к. такие соединения вследствие дегидратации превращаются в альдегиды или кетоны.

Однако их производные – ацетали и ацилали – устойчивы.
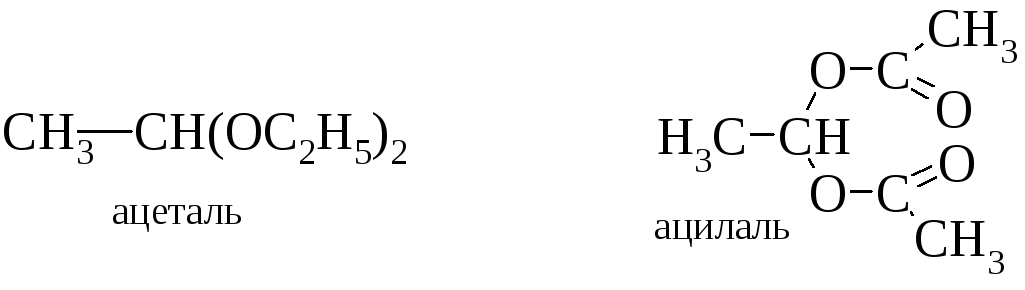
В свободном состоянии соединения устойчивы, если две и более гидроксильные группы содержатся у различных атомов. К важнейшим многоатомным спиртам принадлежат гликоли (две гидроксильные группы), глицерины (три гидроксила), инозиты (шесть гидроксилов) и моносахариды с различным числом гидроксильных групп. Последние содержат кроме гидроксилов еще альдегидную или кетонную группу. Рассмотрим сначала двухатомные спирты.
1,2-Гликоли имеют сладкий вкус, откуда и произошло название этого класса веществ. Примечательно, что с увеличением количества гидроксильных групп сладкий вкус усиливается.
13.8.1. Физические свойства гликолей
Как и следовало ожидать из рассмотрения структуры гликолей, в которых имеется более одного центра для образования водородной связи, для них характерны высокие температуры кипения. Уже для простейшего члена ряда, этиленгликоля, температура кипения равна 197 С. Низшие гликоли смешиваются с водой, и даже гликоли, содержащие семь атомов углерода, обнаруживают заметную растворимость в воде. Гликоли – вязкие жидкости большей плотности, чем одноатомные спирты.
Этиленгликоль находит применение в качестве компонента антифриза из-за своей высокой температуры кипения, низкой температуры замерзания и высокой растворимости в воде. Смесь 66,7% этиленгликоля и 33,3% воды, составляющая основу антифриза, замерзает при –75 С.
13.8.2. Методы синтеза гликолей
Синтез Вюрца. Гликоли были открыты Ш. Вюрцем при действии ацетата серебра на вицинальные дигалогенпроизводные и последующем омылении образовавшихся гликолевых эфиров уксусной кислоты.
![]()
Этот способ получения гликолей оставался наиболее применимым до последнего времени; правда, теперь вместо ацетата серебра обычно пользуются более дешевым, но вполне пригодным ацетатом калия. Возможна также прямая замена галогенов гидроксильными группами при действии слабых оснований, например, раствора соды, но этот процесс протекает с плохими выходами вследствие побочных реакций.
Гидроксилирование алкенов.

Пример:
![]()
Различные способы гидроксилирования алкенов уже подробно рассматривались ранее. Напомним только, что окисление алкенов разбавленным раствором перманганатом калия (реакция Вагнера) приводит к цис-1,2-гликолям, так же как и окисление пероксидом водорода в присутствии оксида осмия(VIII) (реагент Майлса). Гидратация гомологов оксида этилена в кислой среде протекает по механизму SN2, в результате чего эпоксидное кольцо расщепляется с образованием транс-изомера. Следует отметить, что для получения исходных синтонов – эпоксидов, кроме традиционных методов – реакции Прилежаева или окисления алкенов над серебряным катализатором, – используют галогенгидрины.
![]()
Гидролиз галогенгидринов.
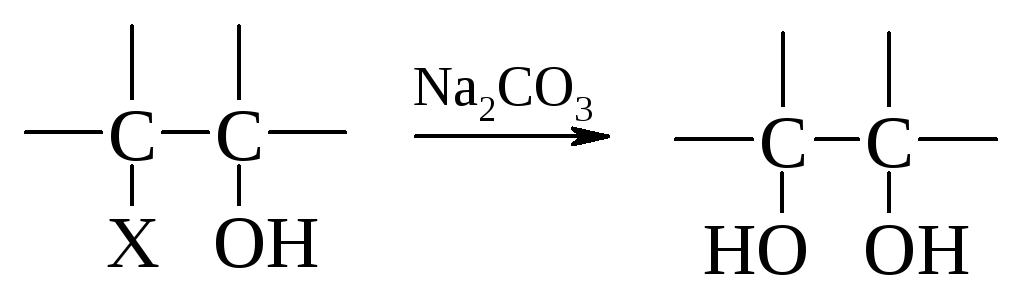
Пример:
![]()
Бимолекулярное восстановление карбонильных соединений. Классическим методом получения симметричных 1,2-диолов является восстановительная димеризация кетонов. В качестве восстановительных агентов применяют магний и цинк. На первой стадии две молекулы кетонов присоединяют по одному электрону. Такие анионоподобные частицы называются кетилами. Они димеризуются с последующим образованием алкоголята. Последний расщепляется водой до пинакона. По этой причине эта реакция называется пинаколиновым восстановлением.

Синтез 1,3-диолов по реакции Принса. Формальдегид в кислой среде присоединяется к алкенам с образованием циклического ацеталя и 1,3-диола.

Восстановление сложных эфиров двухосновных кислот. 1,3-Диолы и диолы с более удаленными друг от друга гидроксилами получают путем восстановления сложных эфиров высших двухосновных кислот по методу Буво-Блана или алюмогидридом лития, либо дикарбонильных соединений боргидридом натрия, например:
![]()

Гидрированием бутин-2-диола-1,4 получают в промышленности бутандиол-1,4 – важный продукт, являющийся промежуточным соединением в производстве бутадиена и далее синтетического каучука. Исходное соединение легко синтезируется из ацетилена и формальдегида по реакции Реппе.
