- •Глава 14
- •14.1. Классификация и номенклатура
- •14.1.1. Классификация эфиров
- •14.1.2. Номенклатура июпак.
- •14.2. Физические свойства простых эфиров
- •14.2.1. Спектроскопия простых эфиров
- •14.3. Получение простых эфиров
- •14.4. Химические свойства простых эфиров
- •14.5. -Оксиды
- •14.5.1. Получение -оксидов
- •14.5.2. Химические свойства эпоксидов
- •14.6. Краун-эфиры
Глава 14
|
ПРОСТЫЕ ЭФИРЫ |
Простыми эфирами называются такие производные спиртов, в которых водород гидроксильной группы замещен на углеводородный радикал.
14.1. Классификация и номенклатура
14.1.1. Классификация эфиров
|
Ациклические эфиры |
Циклические эфиры | ||
|
симметричные |
смешанные или несимметричные |
эпоксиды или -оксиды |
циклические эфиры |
|
Н3СОСН3
метоксиметан
диметиловый эфир |
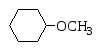
метоксициклогексан метилциклогексиловый эфир |
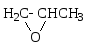
1,2-эпоксипропан пропиленоксид |
тетрагидрофуран 1,4-диоксан |
14.1.2. Номенклатура июпак.
Заместительная номенклатура. По заместительной номенклатуре в простых эфирах типа ROR’ один радикал рассматриваются как углеводород-основа, а другой как R-окси-заместитель. Название таких заместителей образуется из названий углеводородных радикалов с добавлением окончания -окси. Для алкоксигрупп, содержащих от 1 до 4 углеродных атомов, используются сокращенные названия.
|
CH3(CH2)4O |
CH2=CHCH2O |
CH3O |
|
|
|
пентилокси- |
аллилокси |
метокси- |
изопропокси- |
втор-бутокси- |
|
этоксипропан |
пропоксиэтен |
1-хлор-2-этоксиэтан |
|
За основу взята более длинная цепь. |
За основу взята цепь с двойной связью. |
За основу взята цепь с большим количеством заместителей. Начало нумерации – от первого по алфавиту заместителя. |
|
пропилэтиловый эфир |
винилпропиловый эфир |
2-хлорэтилэтиловый эфир |
Атом кислорода, присоединенный к двум соседним атомам углерода, называют префиксом -эпокси, отсюда название подобных соединений «эпоксиды». Циклические эфиры обычно называют как гетероциклические соединения.
Радикально-функциональная номенклатура. Название симметричных простых эфиров включает название радикала в форме прилагательного с добавлением числительного префикса ди- и названия функции эфир. Для несимметричных простых эфиров названия радикалов записывают в алфавитном порядке.
Эпоксиды в радикально-функциональной номенклатуре называют с использованием названий двухвалентных радикалов и функции -оксид.
Примеры таких названий даны выше курсивом.
14.2. Физические свойства простых эфиров
|
В целом, пространственное строение простых эфиров подобно строению спиртов и воды. Угол между связями С–О–С не равен 180º и, следовательно, дипольные моменты двух связей С–О не компенсируют друг друга; вследствие этого простые эфиры имеют небольшой дипольный момент. Его наличие существенно не |
|
влияет на температуры кипения простых эфиров, которые близки к температурам кипения алканов с такой же молекулярной массой и значительно ниже температур кипения изомерных спиртов. Сравните, например, температуры кипения н-гептана (98 С), метил-н-пентилового эфира (100 С), и н-гексилового спирта (157 С). В простых эфирах в отличие от спиртов нет ассоциации за счет образования межмолекулярных водородных связей.
Только два первых представителя эфиров – диметиловый и метилэтиловый эфиры – в нормальных условиях газы, остальные все жидкости. Плотность простых эфиров меньше плотности воды.
Растворимость простых эфиров и спиртов в воде примерно одинакова; например, и диэтиловый эфир, и н-бутиловый спирт растворяются в воде в количестве 8 г на 100 г воды. Растворимость низших спиртов в воде объясняют образованием водородных связей между молекулами спирта и воды; растворимость простых эфиров в воде можно объяснить аналогично:
![]()
1,4-Диоксан содержит два эфирных атома кислорода на четыре атома углерода. Поэтому он образует значительно большее количество водородных связей с водой и может смешиваться с ней в любых соотношениях. Такое же свойство тетрагидрофурана объясняется большей доступностью неподеленной электронной пары атома кислорода по сравнению с диэтиловым эфиром благодаря циклической структуре тетрагидрофурана.
Растворимость простых эфиров в протонных кислотах обусловлена основными свойствами атома кислорода. Как и в случае атома азота в аммиаке, атом кислорода проявляет основные свойства вследствие наличия в его свите двух свободных электронных пар (у атома азота одна свободная пара электронов). Эти электронные пары не могут быть использованы для проявления обычной валентности, поскольку в молекуле эфира вокруг атома кислорода уже имеется восемь электронов (октет). Атом кислорода поэтому не может принять электроны, но может односторонне предоставить одну пару электронов в совместное обладание для осуществления связи, например, с протоном:
![]()